随着组织工程与再生医学的发展,利用毛囊细胞移植以实现毛囊再生或者构建组织工程毛囊为秃发的治疗提供了极具前景的解决方案。构建组织工程毛囊,具有生发能力的种子细胞、支架及信号分子均必不可少。毛乳头细胞是毛囊重建重要的种子细胞,在毛囊球部相互聚集形成多细胞的乳头状结构。早在1967年OLIVER[1]就证实了新鲜分离的完整毛乳头结构具有毛囊诱导能力。既往研究证实了体外培养的毛乳头细胞(dermal papilla cell, DPC)也具有毛囊诱导能力[2-3]。研究发现,新生鼠真皮中含有大量的DPC,经酶消化分离后与上皮细胞一起移植能成功诱导出毛囊,说明新鲜分离的DPC也具有诱导能力[4]。因此,获取足够数量的具有诱导能力的DPC是构建组织工程毛囊的前提。目前,DPC的获取来源主要局限于小鼠的触须毛囊或者是手术废弃的人头皮毛囊,其来源非常有限。一只处于毛发生长期的小鼠两侧的触须毛囊的数量不超过50个,因此需要大量的小鼠以满足实验所需毛囊。目前,国内外尚少见使用小鼠背部毛囊进行分离培养DPC的报道。国内外学者目前主要通过显微解剖法及酶消化法分离获取鼠触须毛乳头(dermal papilla,DP)及其人头皮DP,虽然方法在不断改进,但是分离的关键步骤仍然需要依靠显微解剖,操作难度较大[5-6]。鼠背部皮肤毛囊数目丰富,与触须毛囊特有的血窦结构不同[7-8],其背部毛囊结构单一,与人毛囊具有更高的相似性;然而,其背部毛囊体积较小,排列密集。这些解剖特点限制了背部毛囊的应用。因此本研究尝试采用酶消化结合Ficoll密度梯度离心,探索一种简单、高效的小鼠被毛DP的分离获取方法,从而为组织工程毛囊的构建提供一种新的DPC来源。
1 材料与方法 1.1 实验动物SPF级健康C57BL/6近交系小鼠5只,5周龄。BALB/C雄性裸鼠28只,4~6周龄。C57BL/6近交系小鼠20只,出生1 d内,均购自南方医科大学实验动物中心。
1.2 主要试剂DMEM高糖培养基、胎牛血清(FBS)、磷酸盐缓冲液(PBS)、青霉素和链霉素双抗液、0.25%胰蛋白酶溶液(Trypsin-EDTA)购自Gibco公司;二甲基亚砜(DMSO)、Ⅰ型胶原酶(type Ⅰ collagenase)、DAPI、荧光标记二抗山羊抗兔抗体购自Sigma公司;Ficoll试剂购于碧云天生物科技有限公司;CCK-8细胞增殖活性检测试剂盒购自上海贝博生物;兔抗小鼠碱性磷酸酶(alkaline phosphatase,ALP)、多功能蛋白聚糖(Versican)、β连环蛋白(β-catenin)、磷酸甘油醛脱氢酶(GAPDH)克隆抗体购自Santa Cruz公司。
1.3 酶消化法分离C57小鼠被毛及触须DP被毛DP的分离:取5周龄C57BL/6小鼠,断颈处死,剃毛器剃掉背部毛干,75%乙醇消毒小鼠背部皮肤,剪下背部全层皮肤,用含1%青-链霉素的PBS漂洗3次,0.2%Ⅰ型胶原酶37 ℃消化2 h,去除毛囊周围脂肪及真皮组织。经PBS漂洗3次后,真皮面朝上用剪刀刮下毛囊球部,于PBS溶液中匀速吹打,1 000 r/min离心5 min,去上清,全培(10%FBS+DMEM)重悬后加入等量的9% Ficoll溶液,200 r/min梯度离心5 min,取下层部分,1000 r/min离心5 min,取沉淀,再次加入全培,混匀后加入到等量9% Ficoll溶液中,200 r/min梯度离心5 min,取上层成分,800 r/min离心5 min,取沉淀。
小鼠触须DP的分离:5周龄的C57小鼠,断颈处死。安尔碘消毒触须垫皮肤,剪下触须垫,PBS冲洗。体视显微镜下将触须垫真皮下筋膜组织去除,暴露毛囊球部,剪下毛球部置于0.2%Ⅰ型胶原酶溶液中37 ℃消化2 h,加入全培终止消化,1 000 r/min离心5 min,弃上清液。
1.4 小鼠真皮成纤维细胞培养用二氧化碳窒息法将出生后1 d内的C57BL/6小鼠处死。安尔碘消毒背部皮肤,剪下小鼠背部皮肤。PBS冲洗后置于0.1%中性蛋白酶溶液中37 ℃消化1 h。等量全培终止消化,真皮面朝上,用显微镊将表皮和真皮分离,将真皮剪碎后予0.2%Ⅰ型胶原酶37 ℃消化1 h,等量全培终止消化。200 μm筛网过滤后收集单细胞混悬液1 000 r/min离心5 min,弃上清,全培重悬后接种至培养瓶中,细胞长至80%融合时传代培养。P2代真皮成纤维细胞用于后续实验。
1.5 新生鼠表皮细胞的制备将上述分离获得的新生鼠表皮剪碎后,用0.25%胰蛋白酶于37 ℃消化10 min,加入DMEM高糖培养基(含10%FBS)终止消化。200 m筛网过滤后收集单细胞混悬液于离心管中以1 000 r/min离心5 min,重复离心2次,弃上清液,加入DMEM高糖培养基重悬,备用。
1.6 DPC的体外培养、扩增将上述分离获取的毛乳头,调整其浓度为30个/mL,取1 mL悬液接种至培养瓶中培养,细胞近80%融合时,按照1:2或1:3的比例传代培养、扩增。根据情况取第1~10代(P1~P10) DPC进行后续实验。
1.7 毛乳头的形态、贴壁及细胞迁出观察显微镜下大体观察经酶消化及密度梯度离心后获取的毛乳头形态。将消化分离获得的毛乳头接种至培养瓶内,培养5~7 d,于倒置显微镜下观察毛乳头贴壁及细胞迁出情况,计算毛乳头贴壁率,以及P1~P10各代毛乳头细胞体外生长的形态学特点和生长方式的改变。
1.8 DPC标记物qRT-PCR检测1 mL TRIzol溶液分别提取P2触须DPC,P2被毛DPC,P2真皮细胞的总RNA。根据试剂盒说明书操作。引物设计如下:β-Catenin:上游5′-GTCCTATTCCGAATGTCTG AGGAC-3′,下游5′-CAATGTCCAGTCCA A-GATCTGC-3′;Versican:上游5′-TGGAAGGCACAGC-AGTTACC-3′,下游5′-TCATGGCCCACACGATTCAC-3′;ALP:上游5′-CAGGTCCCACAAGCCCGCAA-3′,下游5′-CCCGGTGGTGGGCCACAAAA-3′; GAPDH:上游5′-ATAACCACCAACTGCTTAGCCCC-3′,下游5′-TAATTGCCCACAGCCTTGGCAGC-3′。
反应条件:50 ℃ 3 min→95 ℃ 3 min→95 ℃ 20 s→ 60 ℃ 25 s读板,40个循环;熔解曲线分析:温度70~95 ℃。每个样重复3次。
1.9 DPC标记物蛋白定性检测4%甲醛固定P2代触须DPC,P2代被毛DPC及P2代真皮成纤维细胞4 ℃,30 min。PBS清洗3次后Triton X-100破膜10 min,再予1% BSA封闭30 min后加入兔抗小鼠抗体200 μL,稀释浓度分别为ALP 1:100、Versican1:200、β-catenin1:100,4 ℃过夜。过夜孵育后,PBS清洗3次,每孔加入200 μL山羊抗兔二抗,按1:200稀释配置,室温静置1 h后PBS漂洗3次,每孔加入200 μL DAPI溶液,室温静置20 min,PBS漂洗3次。荧光显微镜下观察。
1.10 细胞移植体内毛囊重建将28只裸鼠随机分为4组(新鲜表皮细胞+新鲜真皮细胞组;新鲜表细胞+P2被毛DPC组;新鲜表皮细胞+P2触须DPC组;新鲜表皮细胞组),经腹腔注射戊巴比妥钠10 mg/mL麻醉成功后,安尔碘消毒背部皮肤,细胞重悬于20 μL高糖培养基后皮内注射(表皮细胞1×106个;真皮细胞1×106个),每只裸鼠背部注射移植2个部位。细胞移植后3~4周,大体观察移植部位毛囊形成及毛干生长情况;对移植部位组织进行取材,行常规石蜡切片染色。
1.11 统计学分析计量资料以x±s表示,使用SPSS16.0统计软件进行统计分析,多组计量资料采用方差分析比较,方差齐采用单因素方差分析,两两比较用LSD分析,方差不齐则应用威尔士检验,两两比较用Dunnett’s T3分析,同一时间点两组的比较采用独立样本t检验。检验水准:α=0.05。
2 结果 2.1 毛乳头的形态、贴壁及细胞迁出C57小鼠背部皮肤中含有大量的毛囊(图 1A),予胶原酶消化后,剪刀刮下的毛球部经吹打,获取的细胞悬液为毛母质细胞、毛乳头及成纤维细胞等混杂成分,经过2次不同的浓度差的Ficoll重力梯度离心后,可获取较纯的毛乳头及少量毛干杂质(图 1B)。新鲜分离获取的小鼠被毛毛乳头呈圆形或椭圆形,接种6 h后可自然贴壁,贴壁率达90%。贴壁培养24 h后可见毛乳头细胞向四周迁出(图 1C),刚迁出的细胞多呈三角形或短梭形,细胞质丰富,细胞体积较大,呈长梭形或不规则多边形,4 d后细胞围绕毛乳头组织呈放射状生长聚集。

|
| A:小鼠被毛毛囊(×2.5);B:获取的毛乳头(×40);C:毛乳头接种贴壁24 h后(×100);D:P1~P4代的DPC聚集性生长(×100);E:P6代以后的DPC聚集性生长不明显(×100);F:P1~P4代DPC呈旋涡状生长现象(×100) 图 1 小鼠被毛DP外观、体外原代培养及毛乳头细胞生长特性观察 |
2.2 DPC的形态学及生长方式观察
体外培养的C57小鼠被毛DPC呈长梭形,外形与成纤维细胞类似,但有较多触角伸出。低传代的DPC可观察到明显的聚集性生长现象,P4代以前的毛乳头细胞聚集性生长现象非常明显(图 1D),但是随着传代次数的增加,DPC聚集性生长现象逐渐消失,P6代以后的DPC聚集性生长特性不明显(图 1E), 尤其是P10代的毛乳头细胞生长缓慢可观察到细胞衰老的征象。P1~P4代DPC生长达80%融合时,细胞呈现特有的旋涡状图案(图 1F), 但是P6代以后或者更高代数的毛乳头细胞,其旋涡状生长图案并不明显。
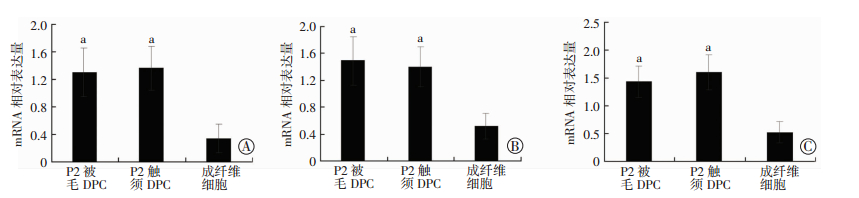
2.3 小鼠被毛DPC细胞标记物的基因表达qRT-PCR检测小鼠触须DPC,被毛DPC及Fb中ALP、Versican和β-catenin mRNA的表达情况(图 2),触须DPC及被毛DPC ALP、Versican和β-catenin mRNA表达量分别与真皮成纤维细胞(阴性对照组)相比,差异具有统计学意义(P < 0.05)。ALP、Versican和β-catenin mRNA在触须DPC与被毛DPC中表达量相比,差异无统计学意义(P > 0.05)。
|
| A:ALP组;B:Versican组;C:β-catenin组a:P < 0.05,与成纤维细胞比较 图 2 被毛DPC、触须DPC及成纤维细胞ALP、β-catenin及Versican mRNA的表达 |
2.4 小鼠被毛DPC细胞标记物蛋白的定性表达
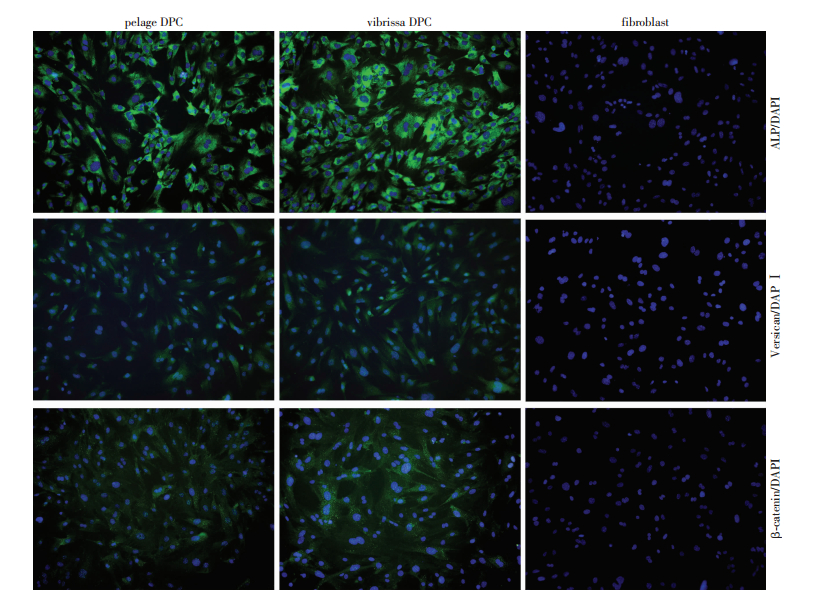
P3触须DPC、P3被毛DPC均能维持包括ALP、Versican和β-catenin在内的DPC相对特异性细胞标记物的表达,而成纤维细胞并未观测到其表达DPC特殊的细胞标记物ALP、Versican和β-catenin(图 3)。
|
| 图 3 小鼠被毛乳头细胞标记物表达(免疫荧光×100) |
2.5 细胞移植后组织学观察
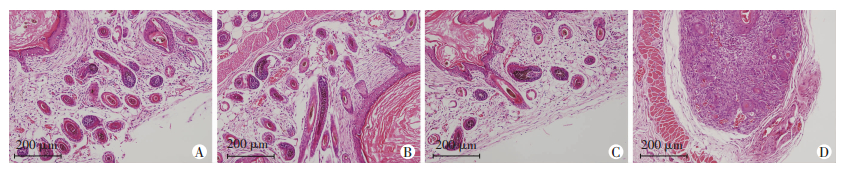
细胞移植后2周,受体裸鼠移植部位取材,常规石蜡切片HE染色,显微镜下观察见新鲜表皮细胞+P2代被毛DPC组、新鲜表皮细胞+P2代触须DPC组及新鲜表皮细胞+新鲜真皮细胞组均形成结构完整的毛囊结构,而仅新鲜表皮细胞移植组无毛囊形成(图 4)。
|
| A:新鲜表皮细胞+P2代被毛DPC组;B:新鲜表皮细胞+P2代触须DPC组;C:新鲜表皮细胞+新鲜真皮细胞组;D:新鲜表皮细胞移植组 图 4 细胞移植后组织学观察 |
3 讨论
显微解剖法被广泛用于分离毛乳头,COHN[9]和OLIVER[10]首次用显微解剖法分离获取了大鼠触须毛乳头。此后,MESSENGER[11]采用相似的方法分离获取了人毛乳头。但是,单纯的显微解剖法,劳动强度大,操作步骤繁杂,需要长时间在显微镜下操作,分离的效果依赖于操作者的熟练程度。此外,长时间体外操作也增加了细胞污染的机会。后来有学者将显微解剖分离获取毛乳头的方法进行了改良[12],缩短了操作时间。但是,无论操作时间如何,显微解剖法分离获取的毛乳头均存在不容易贴壁,细胞迁出困难,生长缓慢等缺陷。采用酶消化可明显简化毛乳头的分离过程,提高效率。WARREN等[5]用显微解剖法分离获取毛乳头以后加入Ⅳ型胶原酶进行消化,增强了毛乳头的贴壁能力,加速了细胞的迁出。伍津津等[13]采用Ⅳ型胶原酶消化法分离获取人毛乳头,明显提高了分离的效率,并加速了细胞的贴壁与迁出。李宇等[14]采用“一步酶消化法”分离获取人毛乳头,降低了工作强度,减小了污染的机会并且保留了毛乳头贴壁容易、细胞迁出快的优点。酶消化法因此获得广泛应用。但是,以上酶消化的方法均需在体视显微镜下剪下毛球部后进行,劳动强度大,由于小鼠背部毛囊体积较小,显微镜下分离获取毛球部非常困难。本实验中,我们采用胶原酶消化后,剪刀可刮下小鼠背部毛囊毛球,同时混杂了大量的毛母质细胞、毛干、未消化完全的毛球、真皮成纤维细胞、脂肪细胞等。而目前常用Ficoll密度梯度离心法,直接从人或动物外周血,分离和纯化有活性的单个核细胞。因此,我们用Ficoll密度梯度离心法,根据密度不同,获取有活性的毛乳头,经过两次密度梯度离心后,可快速获取大量的,较纯净的被毛毛乳头,很大程度上减小了劳动强度,且提供了一种新的DPC来源。分离获取的DPC, 体外培养容易贴壁,24 h贴壁率高达90%。作为毛囊真皮成分中的特殊细胞群体,DPC具有其独特的生物学特性,包括聚集性生长、相对特异性的分子标记物表达。
DPC作为毛囊真皮成分细胞与毛囊其他真皮细胞(如真皮鞘细胞、成纤维细胞)不同,DPC能表达特定的基因及蛋白[15]。研究发现,毛乳头层粘连蛋白及纤维连接蛋白呈高强度表达[16]。ALP活性表达可作为标记以检测毛乳头的存在,并可用于区分毛乳头与毛囊其他成分[17]。此外,也可作为DPC诱导能力相关的细胞标记物检测[18]。Versican也是与DPC诱导能力相关的一个细胞标记物,在毛囊生长期,Versican在毛乳头中呈现高表达。研究发现,Versican在毛囊开始长出毛发纤维时开始表达,随着毛囊的发育成熟,在毛囊生长期Versican表达达到高峰,此后表达量逐渐减少[19]。Wnt通路蛋白是毛囊形态发生最初的信号分子,Wnt信号通路的激活被认为是参与上皮与真皮间相互作用的第1个真皮信号[20]。研究发现Wnt信号是通过抑制胞质中β-catenin的降解来发挥生物学效应的[21]。毛乳头细胞内Wnt/β-catenin的激活对于毛囊周期循环的调控至关重要[22]。本实验对体外培养的低代小鼠被毛DPC诱导能力进行了检测,发现体外培养的低代小鼠被毛DPC表达包括ALP、Versican和β-catenin在内与毛囊诱导能力相关的细胞标记,且与触须DPC表达无明显差异。这说明被毛DPC具有毛囊诱导能力,可像触须DPC一样用于毛囊重建。
本实验将表皮细胞与P2代被毛DPC移植后,可诱导重建出毛囊,与P2代触须DPC诱导重建出的毛囊无明显差异,进一步次证实了被毛DPC具有毛囊诱导能力。基于此,我们实现了简便、高效的鼠背部毛乳头细胞的获取分离方式,不但解决了传统解剖法的操作费时、费力的缺点,而且也实现了一次性大量毛乳头细胞的获取。而且被毛毛乳头细胞同样具有高效的诱导能力,相比触须毛乳头无法重建具有血窦的毛囊结构,被毛毛乳头能够实现完全的毛囊结构重建,从而为组织工程提供一种更佳的种子细胞来源。
综上所述,将成年小鼠背部全层皮肤消化后,刮下整片毛球部,结合Ficoll梯度离心法,是一种简单、有效的分离获取小鼠背部毛乳头细胞的方法。该方法获取的小鼠被毛毛乳头细胞具有诱导毛囊再生的能力,可用于毛囊重建的实验研究。
| [1] | OLIVER R F. The experimental induction of whisker growth in the hooded rat by implantation of dermal papillae[J]. J Embryol Exp Morphol, 1967, 18(1): 43–51. |
| [2] | JAHODA C A, HORNE K A, OLIVER R F. Induction of hair growth by implantation of cultured dermal papilla cells[J]. Nature, 1984, 311(5986): 560–562. DOI:10.1038/311560a0 |
| [3] | REYNOLDS A J, JAHODA C A. Cultured dermal papilla cells induce follicle formation and hair growth by transdifferentiation of an adult epidermis[J]. Development, 1992, 115(2): 587–593. |
| [4] | LICHTI U, ANDERS J, YUSPA S H. Isolation and short-term culture of primary keratinocytes, hair follicle populations and dermal cells from newborn mice and keratinocytes from adult mice for in vitro analysis and for grafting to immunodeficient mice[J]. Nat Protoc, 2008, 3(5): 799–810. DOI:10.1038/nprot.2008.50 |
| [5] | WARREN R, CHESTNUT M H, WONG T K, et al. Improved method for the isolation and cultivation of human scalp dermal papilla cells[J]. J Invest Dermatol, 1992, 98(5): 693–699. DOI:10.1111/1523-1747.ep12499909 |
| [6] | WU J J, LIU R Q, LU Y G, et al. Enzyme digestion to isolate and culture human scalp dermal papilla cells: a more efficient method[J]. Arch Dermatol Res, 2005, 297(2): 60–67. DOI:10.1007/s00403-005-0554-z |
| [7] | FUKUDA J. A pure, monolayer culture of Merkel cells from sinus hair follicles of the rat[J]. Neurosci Lett, 1996, 216(2): 73–76. DOI:10.1016/0304-3940(96)12945-1 |
| [8] | KIM J N, KOH K S, LEE E, et al. The morphology of the rat vibrissal follicle-sinus complex revealed by three-dimensional computer-aided reconstruction[J]. Cells Tissues Organs (Print), 2011, 193(3): 207–214. DOI:10.1159/000319394 |
| [9] | COHEN J. The transplantation of individual rat and guineapig whisker papillae[J]. J Embryol Exp Morphol, 1961, 9: 117–127. |
| [10] | OLIVER R F. Whisker growth after removal of the dermal papilla and lengths of follicle in the hooded rat[J]. J Embryol Exp Morphol, 1966, 15(3): 331–347. |
| [11] | MESSENGER A G. The culture of dermal papilla cells from human hair follicles[J]. Br J Dermatol, 1984, 110(6): 685–689. DOI:10.1111/j.1365-2133.1984.tb04705.x |
| [12] | MAGERL M, KAUSER S, PAUS R, et al. Simple and rapid method to isolate and culture follicular papillae from human scalp hair follicles[J]. Exp Dermatol, 2002, 11(4): 381–385. DOI:10.1034/j.1600-0625.2002.110414.x |
| [13] |
伍津津, 刘荣卿, 叶庆佾, 等. 毛乳头细胞高效培养方法探索[J].
中华皮肤科杂志, 1997, 30(6): 383–385.
WU J J, LIU R Q, LIU Q Y, et al. An Efficient method for isolation and cultivation of human scalp dermal papilla cells[J]. Chin J Dermatol, 1997, 30(6): 383–385. |
| [14] |
李宇, 李国强, 纪影畅, 等. 一步酶消化法高效快速分离培养人头皮毛乳头细胞[J].
中国美容医学, 2004, 13(3): 264–266.
LI Y, LI G Q, JI Y C, et al. An efficient and rapid method to isolate and culture dermal papilla cells from human hair follicles by one step digestive treatment[J]. Chin J Aesth Med, 2004, 13(3): 264–266. |
| [15] | MORGAN B A. The dermal papilla: an instructive niche for epithelial stem and progenitor cells in development and regeneration of the hair follicle[J]. Cold Spring Harb Perspect Med, 2014, 4(7): a015180. DOI:10.1101/cshperspect.a015180 |
| [16] | MESSENGER A G, ELLIOTT K, WESTGATE G E, et al. Distribution of extracellular matrix molecules in human hair follicles[J]. Ann N Y Acad Sci, 1991, 642: 253–262. DOI:10.1111/j.1749-6632.1991.tb24392.x |
| [17] | MCELWEE K J, KISSLING S, WENZEL E, et al. Cultured peribulbar dermal sheath cells can induce hair follicle development and contribute to the dermal sheath and dermal papilla[J]. J Invest Dermatol, 2003, 121(6): 1267–1275. DOI:10.1111/j.1523-1747.2003.12568.x |
| [18] | LEE S H, YOON J, SHIN S H, et al. Valproic Acid Induces Hair Regeneration in Murine Model and Activates Alkaline Phosphatase Activity in Human Dermal Papilla Cells[J]. PLoS One, 2012, 7(4): e34152. DOI:10.1371/journal.pone.0034152 |
| [19] | DU CROS D L, LEBARON R G, COUCHMAN J R. Association of versican with dermal matrices and its potential role in hair follicle development and cycling[J]. J Invest Dermatol, 1995, 105(3): 426–431. DOI:10.1111/1523-1747.ep12321131 |
| [20] | RABBANI P, TAKEO M, CHOU W, et al. Coordinated activation of Wnt in epithelial and melanocyte stem cells initiates pigmented hair regeneration[J]. Cell, 2011, 145(6): 941–955. DOI:10.1016/j.cell.2011.05.004 |
| [21] | WODARZ A, NUSSE R. Mechanisms of Wnt signaling in development[J]. Annu Rev Cell Dev Biol, 1998, 14: 59–88. DOI:10.1146/annurev.cellbio.14.1.59 |
| [22] | SHIMIZU H, MORGAN B A. Wnt signaling through the beta-catenin pathway is sufficient to maintain, but not restore, anagen-phase characteristics of dermal papilla cells[J]. J Invest Dermatol, 2004, 122(2): 239–245. DOI:10.1046/j.0022-202X.2004.22224.x |



