2. 400037重庆,第三军医大学新桥医院肾内科,全军肾脏病中心
2. Department of Nephrology, Center of Nephrology, Xinqiao Hospital, Third Military Medical University, Chongqing, 400037, China
近年来,高尿酸血症和痛风的患病率逐年上升[1]。高尿酸血症是痛风最重要的生化基础,导致关节乃至肾脏病变,严重危害人类健康。研究证实,高尿酸血症导致慢性肾病(chronic kidney disease,CKD)发生并促进CKD进展,也增加心血管事件发生风险,而降低尿酸则可以延缓CKD进展。当尿酸长期沉积于肾脏,可引起高尿酸肾病,导致肾小球肥大、硬化和肾小管间质纤维化。而肾小管间质纤维化是各种慢性肾脏病发展为终末期肾脏病(end stage renal disease, ESRD)的共同途径[2]。因此,寻找导致肾小管间质纤维化机制有助于CKD的治疗。肾小管上皮-间充质细胞转化(epithelial-mesenchymal transition,EMT)在肾间质纤维化的发生、发展中起重要作用,是肾间质纤维化的重要机制之一[3]。研究[4-5]表明,尿酸长期沉积于肾脏,可造成肾小管上皮细胞EMT以及肾间质纤维化的发生,但其机制并不明确。炎症与EMT以及肾间质纤维化的发病密切相关,高尿酸血症可以诱导炎症的发生[6-7]。新近研究发现,TLR4(Toll-like receptor 4) 在炎症调控中扮演着重要角色,在糖尿病肾病等与炎症有关的肾脏疾病中也发挥着重要作用,但其是否参与了高尿酸血症导致的肾损伤并不明确。NF-κB是TLR4下游重要的靶基因,也是介导炎症因子产生的关键信号分子[8]。本研究探讨高尿酸是否通过活化TLR4/NF-κB信号通路诱导肾小管上皮细胞EMT的发生,旨在进一步阐明高尿酸血症导致肾间质纤维化的深层机制,为其防治提供有效干预靶点。
1 材料与方法 1.1 主要试剂人肾小管上皮细胞(HK-2,美国ATCC细胞库),α-平滑肌肌动蛋白(α-SMA,美国Millipore),角蛋白(cytokeratin)抗体、波形蛋白(vimentin)抗体(武汉博士德公司),NF-κB抑制剂二硫代氨基甲酸吡咯烷(PDTC,上海碧云天),Trizol RNA抽提试剂、SYBR Green PCR Master Mix(日本TaKaRa公司),逆转录试剂盒(日本TOYOBO公司),IL-1β、IL-6、TNF-α ELISA试剂盒(上海碧云天),β-肌动蛋白(β-actin)引物(上海生工生物工程有限公司设计合成)。
1.2 HK-2细胞培养与传代利用10%胎牛血清的DMEM/F12培养基进行HK-2细胞培养,pH值7.2~7.4,在37 ℃、体积分数5%CO2的条件下恒温培养箱培养,细胞贴壁生长,用0.25%胰酶每2~4天消化传代。
1.3 细胞形态观察将HK-2细胞以2×105/孔接种于6孔板中,置于37 ℃、体积分数5% CO2恒温培养箱培养。12 h后分别加入0、9、12、15 mg/dL尿酸的血清培养基,继续培养48 h。倒置显微镜观察细胞形态变化。
1.4 HK-2细胞总RNA抽提及cDNA制备应用Trizol试剂抽提细胞总RNA,去除基因组DNA,按照逆转录试剂盒说明书进行逆转录,制备cDNA。反应体系:2 μg模板RNA,1 μL Oligo(dT)18,65 ℃热变性5 min,冰上冷却后,加入4 μL的5×Ribonucleasw Inhibitor酶抑制剂,2 μL 4 dNTP,加入超纯水至终体积为20 μL。逆转录后所得的cDNA于-20 ℃保存备用。
1.5 Real-time PCR检测炎症因子mRNA表达变化扩增IL-1β、IL-6、TNF-α基因引物序列见表 1。取2 μL cDNA作为模板,用IL-1β、IL-6、TNF-α、β-actin和GAPHD引物进行PCR扩增。通过标准化处理得到的△Ct值和各反应的扩增曲线,采用相对定量2-△△Ct法比较各基因的表达差异。
| 基因 | 引物序列(5′→3′) | 片段大小(bp) |
| IL-1β | 上游: ATGATGGCTTATTACAGTGGCAA | 132 |
| 下游: GTCGGAGATTCGTAGCTGGA | ||
| IL-6 | 上游: ACTCACCTCTTCAGAACGAATTG | 149 |
| 下游: CCATCTTTGGAAGGTTCAGGTTG | ||
| TNF-α | 上游: CCTCTCTCTAATCAGCCCTCTG | 220 |
| 下游: GAGGACCTGGGAGTAGATGAG | ||
| β-actin | 上游: CATGTACGTTGCTATCCAGGC | 250 |
| 下游: CTCCTTAATGTCACGCACGAT |
1.6 Western blot分析
收集不同质量浓度尿酸(0、9、12、15 mg/dL)处理48 h后的HK-2细胞,加入蛋白裂解液,制备蛋白样品,具体实验步骤参考本课题组前期的研究[9]。抗体Fibronectin、α-SMA、E-cadherin(1 :1 000) 和β-actin (1 :1 000) 一抗4 ℃孵育过夜。TBST洗涤后用1 :1 000相应二抗37 ℃孵育1 h,再次洗涤后用ECL显影成像。采用Image J软件扫描目的条带净灰度值,将目的条带灰度值与β-actin条带灰度值比值作为最终结果,进行统计分析。
1.7 免疫荧光染色将HK-2细胞接种于24孔板中。根据文献[10]报道,PDCT为NF-κB特异性抑制剂。因此,用PDTC预处理HK-2细胞2 h后,吸弃培养基,采用PBS润洗细胞2~3次充分去除残余的PDTC。采用15 mg/dL尿酸继续孵育HK-2细胞48 h。免疫荧光的具体实验步骤参考本课题组前期的研究[11]。共聚焦显微镜下观察并照相。
1.8 统计学分析采用SPSS 20.0统计软件,计量资料数据用x±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验法进行分析。检验水准α=0.05。
2 结果 2.1 尿酸处理对HK-2细胞形态学的影响用不同质量浓度尿酸(0、9、12、15 mg/dL)处理HK-2细胞48 h后,倒置显微镜下观察HK-2细胞形态学变化。正常培养的HK-2细胞贴壁生长,呈铺路石样,排列整齐紧密。而尿酸作用48 h后,HK-2细胞呈长梭形,分支增多,细胞间隙变宽(图 1)。且随着尿酸质量浓度增加,HK-2细胞形态变化越来越明显。说明在尿酸的诱导下,HK-2细胞发生了形态重塑,且具有剂量依赖性。
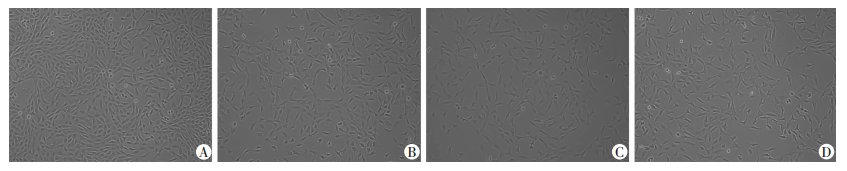
|
| A:空白对照组;B:尿酸9 mg/dL组;C:尿酸12 mg/dL组;D:尿酸15 mg/dL组 图 1 倒置显微镜观察尿酸处理48 h后HK-2细胞形态变化(×100) |
2.2 尿酸处理对HK-2细胞标志物表达的影响
用不同质量浓度尿酸(0、9、12、15 mg/dL)处理HK-2细胞48 h后,Western blot检测间充质细胞标志物Fibronectin和α-SMA及上皮细胞标志物E-cadherin表达变化。结果显示,随着尿酸浓度增加,间充质细胞标志物Fibronectin和α-SMA(图 2)表达逐渐增加,而上皮细胞标志物E-cadherin表达逐渐降低,进一步证实尿酸可以诱导HK-2细胞发生EMT,且存在剂量依赖性。
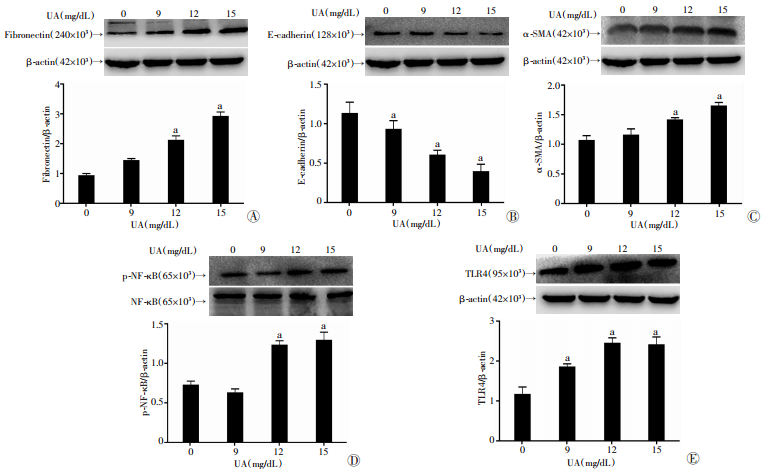
|
| A~C:Fibronectin、E-cadherin和α-SMA表达改变;D~E:不同浓度的尿酸对TLR4/NF-κB信号通路的影响;a:P < 0.01, 与对照组(0 mg/dL)比较 图 2 Western blot检测尿酸对HK-2细胞EMT标志物及TLR4/NF-κB信号通路的影响 |
2.3 尿酸处理对HK-2细胞TLR4/NF-κB信号通路的影响
Western blot检测结果显示,不同质量浓度尿酸作用HK-2细胞48 h后,与对照组相比,TLR4和p-NF-κB的表达明显升高(图 2)。说明高尿酸可能通过活化TLR4/NF-κB信号通路诱导肾小管上皮细胞EMT的发生。
2.4 尿酸对HK-2细胞炎症因子mRNA表达的影响定量PCR结果显示,尿酸作用HK-2细胞48 h后,IL-1β、IL-6和TNF-α mRNA的表达呈现上升趋势。与对照组相比,15 mg/dL剂量组中IL-1β和TNF-α mRNA的表达水平升高最为明显,差别具有统计学意义(P < 0.05,图 3)。说明高尿酸可以诱导HK-2细胞炎症因子的表达增加,且存在剂量依赖性。
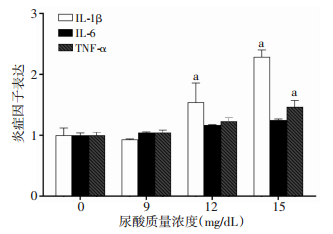
|
| a: P < 0.01, 与对照组(0 mg/dL)比较 图 3 定量PCR检测不同质量浓度尿酸处理HK-2细胞48 h后对炎症因子IL-1β、IL-6和TNF-α mRNA表达的影响 |
2.5 抑制TLR4的活化对尿酸诱导HK-2细胞EMT的影响
Western blot结果显示,与对照组相比,尿酸处理组(15 mg/dL)的TLR4和磷酸化NF-κB表达明显增加,Fibronectin和α-SMA表达明显增加,而E-cadherin表达明显降低(P < 0.05),用TLR4siRNA预处理可以显著抑制尿酸引起的磷酸化NF-κB和α-SMA表达(P < 0.05,图 4)。
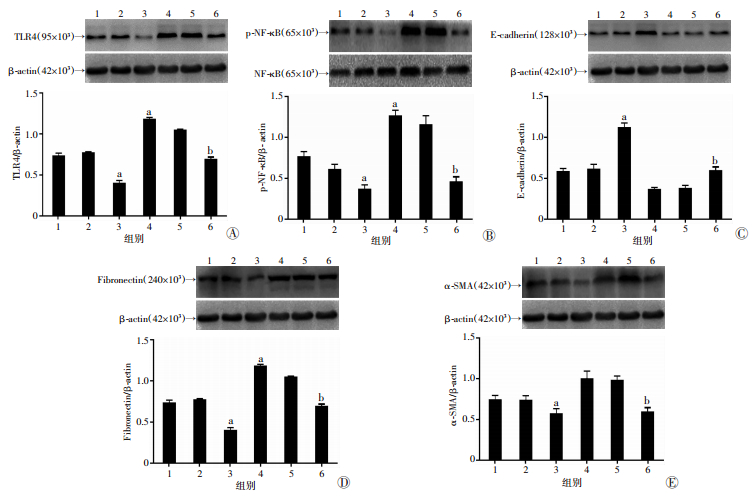
|
| A~E:分别为TLR4、p-NF-κB、E-cadherin、Fibronectin、α-SMA表达;1:对照组;2:空载体组;3:小RNA干扰组;4:尿酸15 mg/dL组;5:空载体+尿酸15 mg/dL组;6:尿酸15 mg/dL+小RNA干扰组;a: P < 0.01,与对照组比较;b:P < 0.01, 与尿酸15 mg/dL组比较 图 4 Western blot检测TLR4抑制剂对尿酸诱导HK-2细胞EMT的影响 |
2.6 抑制NF-κB的活化对尿酸诱导HK-2细胞EMT的影响
Western blot结果显示,与对照组相比,尿酸处理组(15 mg/dL)的Fibronectin和α-SMA表达明显增加,而E-cadherin表达明显降低(P < 0.05),PDTC预处理可以显著抑制尿酸引起Fibronectin和α-SMA表达增加(P < 0.05,图 5)。免疫荧光结果显示:尿酸组间充质细胞标志物vimentin较对照组表达明显升高,而上皮细胞标志物cytokeratin表达显著下降;相反,PDTC预处理组vimentin较尿酸组表达明显下降,cytokeratin表达升高(图 6),提示PDTC预处理可逆转尿酸诱导的EMT。以上实验结果说明抑制NF-κB的活化可以逆转尿酸诱导的EMT发生,而PDTC则抑制了TLR4/NF-κB信号通路活性。
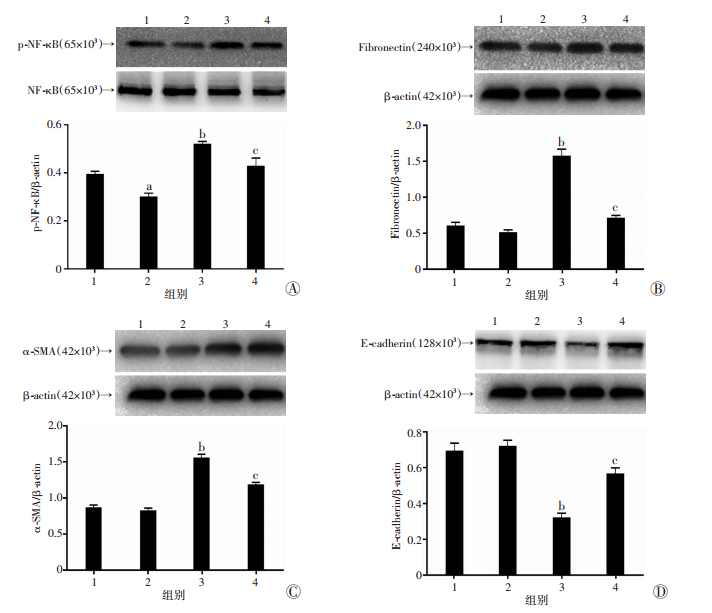
|
| A~D:分别为p-NF-κB、Fibronectin、α-SMA、E-cadherin表达;1:对照组;2:PDTC预处理组;3:尿酸15 mg/dL组;4:PDTC预处理+15 mg/dL尿酸处理组;a: P < 0.05,b:P < 0.01,与对照组比较;c:P < 0.01, 与尿酸15 mg/dL组比较 图 5 Western blot检测抑制NF-κB的活化对尿酸诱导HK-2细胞EMT的影响 |

|
| 图 6 免疫荧光检测抑制NF-κB的活化对HK-2细胞中vimentin(A)、cytokeratin(B)表达的影响(×400) |
3 讨论
在CKD中,高尿酸血症一直被认为是肾小球滤过率下降的结果,而不是肾脏疾病发生或发展的危险因素。然而,最近的流行病学研究表明,在健康人和肾功能受损的受试者,尿酸本身也可以促进CKD的发展。当机体出现尿酸排泄障碍时,尿酸会类似于痛风性关节炎一样形成尿酸盐结晶沉积在集合管,引起肾小管上皮细胞损伤、内皮功能障碍,肾素血管紧张素系统激活,氧化应激等病理改变,最终导致肾小管间质纤维化和肾小球硬化[12]。肾脏进行性慢性纤维化过程是CKD进展的共同途径,延缓或防止肾纤维化是防治CKD进展的关键[11],其中肾小管上皮细胞EMT在肾间质纤维化过程中发挥着至关重要的作用。
本研究首先观察到尿酸可以明显诱导人肾小管上皮细胞发生EMT,包括形态学明显改变、间充质标志物Fibronectin和α-SMA表达显著增加和上皮标志物E-cadherin表达明显降低。新近研究发现,高尿酸引起的肾间质纤维化与炎症反应密切相关。肾脏固有细胞和免疫调节细胞均成为炎症的始动点和作用靶点。肾脏固有细胞收到损伤刺激后会产生各种细胞因子和粘附分子等前炎症介质,介导循环中的T淋巴细胞(CD4+T细胞)、树突状细胞、中性粒细胞、巨噬细胞迁徙至肾脏浸润和活化,分泌产生IL-1、IL-6、TNF-α、IL-18、IL-17、MCP-1等炎症和趋化因子,进一步放大炎症反应。各种炎症因子和趋化因子表达的增加与各种肾脏疾病相关,包括急性肾损伤与慢性肾纤维化。既往研究发现,可溶性尿酸可以刺激人单核细胞产生IL-1β、IL-6及TNF-α等炎症因子的表达而作用于血管平滑肌诱导炎症反应,促进肾脏纤维化[13]。TNF-α是由浸润细胞产生的非常重要的促炎因子,可以刺激肾小管上皮细胞产生趋化因子,招募炎症细胞[14]。IL-1β和IL-6是肾间质纤维化发生过程中炎性细胞分泌的重要细胞因子,也与肾纤维化的发生发展密切相关[15]。因此我们采用Real-time PCR检测炎症因子IL-1β、IL-6和TNF-α mRNA的表达变化,结果显示IL-1β和TNF-α mRNA表达显著增加,而IL-6尽管有增加趋势,但差异无统计学意义。这可能与尿酸作用的剂量以及时间有关。在不同的时间点,炎症因子的表达也不一样。本研究结果表明高尿酸可以诱导HK-2细胞炎症因子的表达升高,这与前期的研究相一致[4, 16]。
TLR4作为TLRS家族成员之一,在肾小球系膜细胞及肾小管上皮细胞均有表达,是免疫炎症反应重要的上游调节因子[17-18]。研究证实,TLR4可以通过调控NF-κB信号通路,促进多种炎症因子的表达,进而激活炎症反应[19]。NF-κB作为重要的转录因子,参与了炎症反应、机体免疫和细胞分化的调控[20]。生理情况下,细胞胞浆中NF-κB与其抑制蛋白IκBα、IκBβ和IκBγ结合形成复合物。当细胞受到如细胞因子、病毒、氧化物外界刺激时,复合物NF-κB/IκB的形成被逆转,导致NF-κB被激活,进而转移到细胞核内调节多种基因的转录。既往研究表明,NF-κB与细胞内多种信号转导过程密切相关,在肾间质纤维化的发生发展过程中发挥着重要作用[21]。NF-κB在肾脏的肾小球细胞和肾小管上皮细胞中广泛存在。活化的NF-κB能够介导炎症反应,促进肾小管上皮细胞向成纤维细胞转分化,上调多种炎症因子和趋化因子的表达(如IL-1、IL-6、TNF-α、MCP-1等的表达),促进肾脏免疫炎症反应和肾小管间质纤维化的进程[20-21]。本研究发现尿酸可以通过活化TLR4/NF-κB信号通路诱导肾小管上皮细胞EMT的发生。同时,免疫荧光检测也证实,高尿酸可以诱导HK-2细胞vimentin表达增加和cytokeratin表达下降。而PDTC预处理可以逆转高尿酸诱导的EMT的发生。上述结果说明靶向抑制NF-κB的活化可以逆转尿酸诱导的EMT和肾间质纤维化的发生。
综上所述,高尿酸可以通过活化NF-κB信号通路调控炎症因子的表达,诱导肾小管上皮细胞发生EMT,这可能为临床上高尿酸诱导的肾纤维化提供治疗靶点。
| [1] | PEREZ-RUIZ F, BECKER M A. Inflammation: a possible mechanism for a causative role of hyperuricemia/gout in cardiovascular disease[J]. Curr Med Res Opin, 2015, 31(Suppl 2): 9–14. DOI:10.1185/03007995.2015.1087980 |
| [2] | NAITO Y, FUJII A, SAWADA H, et al. Association between renal iron accumulation and renal interstitial fibrosis in a rat model of chronic kidney disease[J]. Hypertens Res, 2015, 38(7): 463–470. DOI:10.1038/hr.2015.14 |
| [3] | SONGY, PENG C, LV S, et al. Adipose-derived stem cells ameliorate renal interstitial fibrosis through inhibition of EMT and inflammatory response via TGF-β1 signaling pathway[J]. IntImmunopharmacol, 2017, 44: 115–122. DOI:10.1016/j.intimp.2017.01.008 |
| [4] | RYU E S, KIM M J, SHIN H S, et al. Uric acid-induced phenotypic transition of renal tubular cells as a novel mechanism of chronic kidney disease[J]. Am J Physiol Renal Physiol, 2013, 304(5): F471–F480. DOI:10.1152/ajprenal.00560.2012 |
| [5] | NAGURA M, TAMURA Y, KUMAGAI T, et al. Uric acid metabolism of kidney and intestine in a rat model of chronic kidney disease[J]. Nucleosides Nucleotides Nucleic Acids, 2016, 35(10/12): 550–558. DOI:10.1080/15257770.2016.1163379 |
| [6] | ZHOU Y, FANG L, JIANG L, et al. Uric acid induces renal inflammation via activating tubular NF-κB signaling pathway[J]. PLoS ONE, 2012, 7(6): e39738. DOI:10.1371/journal.pone.0039738 |
| [7] | ALEMZADEH R, KICHLER J. Uric Acid-Induced Inflammation Is Mediated by the Parathyroid Hormone:25-Hydroxyvitamin D Ratio in Obese Adolescents[J]. MetabSyndrRelatDisord, 2016, 14(3): 167–174. DOI:10.1089/met.2015.0099 |
| [8] | LIANG W Y, ZHU X Y, ZHANG J W, et al. Uric acid promotes chemokine and adhesion molecule production in vascular endothelium via nuclear factor-kappa B signaling[J]. NutrMetab Cardiovasc Dis, 2015, 25(2): 187–194. DOI:10.1016/j.numecd.2014.08.006 |
| [9] | YANG K, WANG C, NIE L, et al. Klotho Protects Against Indoxyl Sulphate-Induced Myocardial Hypertrophy[J]. J Am SocNephrol, 2015, 26(10): 2434–2446. DOI:10.1681/ASN.2014060543 |
| [10] | REN K, LI Z, LI Y, et al. Sulforaphene enhances radiosensitivity of hepatocellular carcinoma through suppression of the NF-κB pathway[J]. J Biochem Mol Toxicol, 2017, 31(8): e21917. DOI:10.1002/jbt.21917 |
| [11] | GUAN X, NIE L, HE T, et al. Klotho suppresses renal tubulo-interstitial fibrosis by controlling basic fibroblast growth factor-2 signalling[J]. J Pathol, 2014, 234(4): 560–572. DOI:10.1002/path.4420 |
| [12] | CAI W, DUAN X M, LIU Y, et al. Uric Acid Induces Endothelial Dysfunction by Activating the HMGB1/RAGE Signaling Pathway[J]. Biomed Res Int, 2017, 2017(2): 4391920. DOI:10.1155/2017/4391920 |
| [13] | YONEDA M, THOMAS E, SUMIDA Y, et al. Uric acid levels decrease with fibrosis progression in patients with nonalcoholic fatty liver disease[J]. ClinBiochem, 2014, 47(12): 1138–1139. DOI:10.1016/j.clinbiochem.2014.04.026 |
| [14] | TAN X, WEN X, LIU Y. Paricalcitol inhibits renal inflammation by promoting vitamin D receptor-mediated sequestration of NF-kappaB signaling[J]. J Am SocNephrol, 2008, 19(9): 1741–1752. DOI:10.1681/ASN.2007060666 |
| [15] | MENG X M, WANG S, HUANG X R, et al. Inflammatory macrophages can transdifferentiate into myofibroblasts during renal fibrosis[J]. Cell Death Dis, 2016, 7(12): e2495. DOI:10.1038/cddis.2016.402 |
| [16] | KIM S M, LEE S H, KIM Y G, et al. Hyperuricemia-induced NLRP3 activation of macrophage contributes to the progression of diabetic nephropathy[J]. Am J Physiol Renal Physiol, 2015, 308(9): F993–F1003. DOI:10.1152/ajprenal.00637.2014 |
| [17] | LI Y W, ZHANG Y, ZHANG L, et al. Protective effect of tea polyphenols on renal ischemia/reperfusion injury via suppressing the activation of TLR4/NF-κB p65 signal pathway[J]. Gene, 2014, 542(1): 46–51. DOI:10.1016/j.gene.2014.03.021 |
| [18] | QI M, YIN L, XU L, et al. Dioscin alleviates lipopolysaccharide-induced inflammatory kidney injury via the microRNA let-7i/TLR4/MyD88 signaling pathway[J]. Pharmacol Res, 2016, 111: 509–522. DOI:10.1016/j.phrs.2016.07.016 |
| [19] | HUANG J, CHEN Z, LI J, et al. Protein kinase CK2α catalytic subunit ameliorates diabetic renal inflammatory fibrosis via NF-κB signaling pathway[J]. BiochemPharmacol, 2017, 132: 102–117. DOI:10.1016/j.bcp.2017.02.016 |
| [20] | CHUNG K W, JEONG H O, LEE B, et al. Involvement of NF-κBIZ and related cytokines in age-associated renal fibrosis[J]. Oncotarget, 2017, 8(5): 7315–7327. DOI:10.18632/oncotarget.14614 |
| [21] | ZHANG M, GUO Y, FU H, et al. Chop deficiency prevents UUO-induced renal fibrosis by attenuating fibrotic signals originated from Hmgb1/TLR4/NFκB/IL-1β signaling[J]. Cell Death and Disease, 2015, 6(8): e1847. DOI:10.1038/cddis.2015.206 |



