颅脑受到机械力直接打击以后,炎症反应、血脑屏障损伤以及脑水肿等损伤相继出现,这些病理过程直接加重病情,甚至导致死亡。其中血脑屏障损伤是继发性损伤的“中心”,与炎症反应和脑水肿发生发展密切相关。血脑屏障损伤介导包括继发性神经元死亡的一系列脑损伤[1-8],最终影响患者神经功能恢复。所以,血脑屏障损伤被认为是可以干预和控制的环节。因此,寻找能保护血脑屏障的治疗靶点至关重要,也是未来创伤研究的方向所在。
一般认为行使血脑屏障正常功能的主要是细胞间的紧密连接(tight junction)。紧密连接是维持内皮机械屏障和通透性的重要结构,由内皮细胞三类跨膜蛋白连接形成:Occludin,Claudins和JAMs。这些跨膜蛋白在胞外以二聚体形式相互结合,在细胞质内则直接或通过中间蛋白(ZO-1,ZO-2) 间接锚定于细胞骨架蛋白F-actin以稳定整体连接结构。生理状态下,血脑屏障的生物学功能严密控制内皮细胞间隙间的通透性[9-11],防止血液中的大分子物质特别是毒性物质直接进入脑组织内,是保护脑功能免受循环系统影响的天然屏障。病理状况下,紧密连接相关蛋白和细胞骨架结合紊乱都能引起血脑屏障通透性改变。动物实验和临床病例研究均证实在创伤性颅脑损伤后即出现血脑屏障损伤,持续数天至数月,甚至一年以上[12-13]。
膜粘连蛋白Ⅱ(annexin A2, A2) 属于膜粘连蛋白家族,是一种Ca2+依赖性的磷脂结合蛋白。近期研究结果表明,A2在内皮细胞膜上能与P11结合形成四聚体,促进血纤维蛋白溶酶原向血纤维蛋白溶酶转换,这一特性在肿瘤血管发生过程中起到了重要调节作用[14-16]。同时A2二聚体还能与紧密连接分子ZO-1、Occludin、Claudin-1共表达在内皮细胞顶端和基底膜外侧区域,协助紧密连接蛋白维持血脑屏障功能[17],A2的同系物膜粘连蛋白Ⅰ已经被证实能在生理和病理(多发性硬化)情况下保护血脑屏障功能[18],但是尚无研究证实A2对急性脑损伤后血脑屏障的影响,本文拟从血管保护的角度探索A2在创伤性脑损伤早期的神经保护作用。
1 材料及方法 1.1 实验动物与试剂C57BL/6J雄性成年小鼠(12周,25~30 g),均来自美国Charles River动物公司;PBS来自美国Gibco公司,PFA来自美国Electron microscopy sciences,Triton X-100来自美国Sigma公司,TBST来自美国Sigma公司,细胞裂解液、样本缓冲液、电泳胶来自美国Novex公司,蛋白测定液来自美国Bio-Rad公司,封片剂来自美国Cell signaling公司,样本还原缓冲液来自美国Invitrogen公司。
1.2 小鼠控制性皮质损伤(controlled cortical impact CCI)参照文献[19], 制作小鼠CCI模型。将2.5%的异氟醚与70%一氧化二氮和30%的氧气混合后通过面罩吸入麻醉小鼠,将小鼠摆成俯卧位,头部固定于三钉颅骨固定架上。切开头部皮肤,剥离帽状腱膜,显露颅骨。选取左侧前囟后1 mm、中线左侧旁开0.5 mm处为开颅位置,局部滴加生理盐水在颅骨表面防止开颅过程中高温损伤脑组织。然后以直径5 mm的环形电锯轻柔、均匀钻开颅骨,并移除游离骨瓣。操作过程中保护硬膜完整。调整打击探头(直径3 mm)的高度,使其刚好与骨窗内脑组织表面相接触,然后设置打击参数:打击速度5.0 m/s,打击深度0.6 mm,总打击时间150 ms,打击接触时间40 ms。准备完毕后实施打击,模拟中度颅脑损伤。打击后,处理表面出血,缝合皮肤。放回鼠笼中至清醒送回动物房。
1.3 小鼠创伤模型后行为学评估神经系统损伤评分(NSS)本实验采用10分标准评估小鼠术前及术后损伤程度,包括感觉、运动、警觉性等多项行为学参数。每失败一项得1分,分数越高表明损伤程度越严重(0~3分为轻度损伤;4~6分为中度损伤;7分以上为重度或者致死性损伤);Wire-gripping实验主要检测小鼠前庭运动功能,将小鼠置于距离地面45 cm高,长约45 cm的钢丝上,从钢丝中间位置释放小鼠使其抓住钢丝,计时60 s,根据停留时间及爬行距离进行评分。行为学实验从术前5 d起对小鼠进行训练,训练3 d排除个别差异动物,于术前1 d,术后1、3、7 d分别对小鼠进行测量并记录得分,每只小鼠重复3次实验,最后结果取平均值。
1.4 在体血脑屏障完整性检测脑创伤小鼠在术后24 h处死。在处死前1.5 h,尾静脉注射4 mL/kg的2%伊文思蓝(Evans blue,EB)染料。染料在体内循环1.5 h后,处死小鼠并用60 ml PBS灌注后取脑,切除嗅球、小脑后照相,并放入-80 ℃冰箱保存。正式开始检测样本前,需构建染料荧光光度标准曲线,根据标准曲线得到半球中的伊文思蓝浓度。
1.5 脑组织含水量检测创伤模型小鼠术后24 h处死,无需灌注,直接取脑并切除嗅球与小脑。将脑组织分成左右半球,分别称重后放入100 ℃烤箱,于48 h后取出烤干的脑组织并再次称重。组织含水量=100%×(湿重-干重)/湿重。
1.6 伤灶体积检测对伤灶体积进行测量时,首先需要对脑组织切片(动物处死及灌注过程同前)。为保证伤灶位置能完全覆盖,本实验中我们取前囟前1 mm到前囟后3 mm,每500 μm间隔取一次切片,然后将搜集的切片进行HE染色。染色完毕后,在Image J软件上计算每张切片伤灶面积=健侧半球面积-伤侧半球面积,接着统计总的伤灶体积=(层1面积+层2面积+……层n面积)×500 μm。
1.7 免疫组织化学染色切片取出后自然风干,4%PFA固定约20 min,随后用0.2% PBS-Triton在摇床上反复漂洗3次,5%FBS(蒸馏水)滴加组织上封闭至少60 min,滴加一抗放入湿盒在4 ℃房间过夜。次日标本用PBS洗去一抗后滴加二抗(in 5%FBS),并在室温下避光孵浴1.5 min。完毕再次用PBS洗去二抗加封片剂后在荧光显微镜下照相。
1.8 免疫印迹实验将冰冻保存脑组织块常温下解冻,每管加入380~400 μL细胞裂解液,轻轻捣碎组织块后再用组织匀浆器匀浆。在4 ℃温度下,使用高速离心机离心20 min,取上清液配制总共约30 μL反应体系,将配制好的样品在加热器上加热约5 min( > 95 ℃),再在冰上冷却1 min,最后离心5 s。在电泳槽中每个泳道加入24 μL待测蛋白样品,以120 V电压电泳约120 min。待目标蛋白行进至胶中央部后取出电泳胶,截取上下多余部分。用电转仪对电泳胶转膜完毕后,蛋白膜与配制好的牛奶在摇床上孵育40~50 min,在4 ℃下一抗孵育过夜。次日标本用TBST清洗后加入二抗,将显影液覆盖整张蛋白膜,暗室曝光打印胶片。
1.9 统计学方法采用SPSS 18.0进行统计学分析,数据以均数+标准误表示。处理组和对照组间伤灶大小、免疫组化、免疫印迹结果比较采用t检验;处理组和对照组间行为学评分采用重复测量方差分析(repeated measures ANOVA),设检验水准α=0.05。
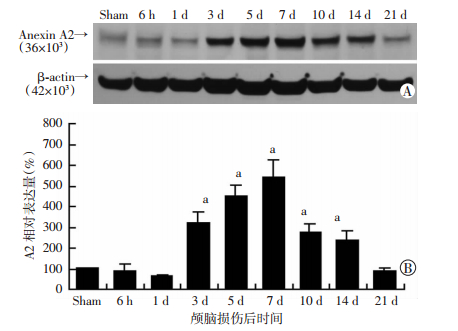
2 结果 2.1 颅脑创伤对内源性A2蛋白表达的影响图 1采用免疫印迹法(western blot)检测伤侧脑组织中A2蛋白表达(n=3/组)。CCI后初期(1 d内),A2表达在急性期变化不明显。从3 d起,A2表达明显增高(P < 0.05),并在7 d时达到高峰(约为伤前5倍左右)。在此以后,蛋白表达逐渐下降,21 d时基本恢复正常值。随后,我们取伤后7 d的脑组织标本,用免疫荧光组织化学观察A2在不同细胞类型中的表达。如图 2所示,伤前内皮细胞(CD31标记)几乎不表达A2,伤后在伤侧部分内皮细胞表达A2;伤前星形胶质细胞(GFAP标记)部分表达A2,伤后双侧胶质细胞均有活化,且活化的胶质细胞都能表达A2;神经元细胞(NeuN标记)在伤前已有A2表达,伤后未见明显改变。
|
| A:western blot结果;B:半定量分析a: P < 0.05与Sham组比较 图 1 CCI前后损伤侧大脑半球A2表达量的时间曲线 |

|
| △:A2的阳性表达 图 2 CCI前和CCI后7 d A2在内皮细胞、星形胶质细胞及神经元中的表达 |
2.2 血脑屏障通透性
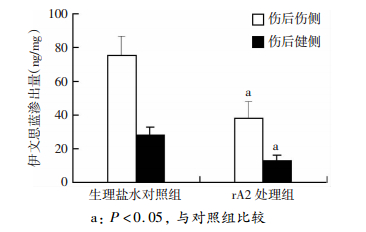
如图 3所示,CCI后24 h小鼠伤侧半球EB渗出量急剧增加,显示其血脑屏障完整性遭到严重破坏,健侧血脑屏障也受到波及(n=9/组)。而在给予rA2处理后,小鼠伤侧与健侧半球中EB渗出量均显著降低(P < 0.05)。
|
| a: P < 0.05, 与对照组比较 图 3 CCI后rA2对血脑屏障通透性影响 |
2.3 颅脑创伤后脑水肿
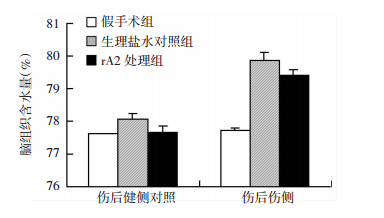
如图 4所示,相对于假手术组,CCI后24 h对照组双侧脑组织含水量明显增加(n=12/组)。而在给予rA2以后,双侧脑组织含水量下降有所下降,但不具有显著差异(P > 0.05)。
|
| 图 4 CCI后rA2对脑组织水肿的影响 |
2.4 颅脑创伤后海马神经元
如图 5所示,CCI后7 d海马区的神经元数量和结构受损严重(n=4/组),给予rA2能显著减少CA1和CA3区(箭头所指)神经元丢失,减轻海马区结构破坏(P < 0.05)。

|
| a: P < 0.05, 与对照组比较;A:生理盐水对照组;B:rA2处理组红色三角:CA1区神经元,白色三角:CA3区神经元;C:神经元存活数对比 图 5 CCI后rA2对海马神经元存活的影响 |
2.5 颅脑创伤后紧密连接相关蛋白表达
如图 6所示,CCI后24 h三种血脑屏障常见紧密连接相关蛋白表达均有明显降低(n=6/组),给予rA2以后表达量显著增加(P < 0.05),Occludin和Claudin-5的表达无明显改变(P > 0.05)。

|
| a: P < 0.05,与假手术组比较;A:蛋白印迹结果, B:半定量结果1:假手术组,2:生理盐水对照组,3:rA2处理组 图 6 CCI后rA2对紧密连接相关蛋白表达的影响 |
2.6 颅脑创伤后小鼠神经功能恢复和伤灶体积
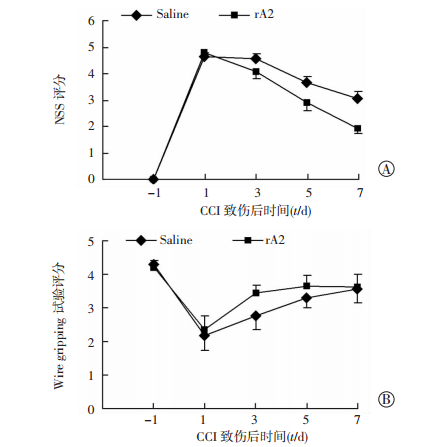
对比术前,伤后1 d小鼠的各项神经功能(NSS和wire-gripping)均明显受损,此后呈现修复趋势,功能逐渐改善,尤其是前庭功能(wire-gripping实验),伤后7 d时已接近正常水平(n=14/组)。在NSS实验中,rA2组从伤后3 d起就呈现出较好的恢复能力,在第7 d时优势具有显著性差异(P < 0.05)。通过ANOVA分析rA2组和对照组7 d以来的整体行为学表现,rA2能显著改善NSS评分(P < 0.01)(图 7)。而在wire-gripping实验,并没有发现rA2对CCI小鼠有明显改善作用(P > 0.05)(图 7)。除了神经功能评估外,我们还对rA2组和对照组伤灶的体积进行比较(n=14/组),两组在伤后7 d的伤灶体积并无显著性差异(P > 0.05)。
|
| A: NSS评分; B: wire-gripping试验结果 图 7 CCI后rA2对早期神经功能恢复的影响 |
3 讨论
本实验探讨了外源性重组A2蛋白在创伤性颅脑损伤早期的保护作用。以往研究结果提示A2可能参与维持保护血脑屏障稳定性[3-6]。血脑屏障在颅脑损伤后继发性损伤中扮演重要角色,其完整性破坏被认为是继发性脑损伤的重要病理机制。因此,我们假设外源性A2蛋白在颅脑损伤以后能通过保护血脑屏障功能,来减轻继发性脑损伤,从而促进预后恢复。在动物实验中对以上结论进行验证,CCI后2 h给予尾静脉注射rA2,结果证实A2能通过上调紧密连接蛋白ZO-1表达增加血脑屏障的稳定性,从而减轻继发性海马区神经元丢失,最终提高伤后神经功能恢复。
本试验证实了A2对改善血脑屏障的作用,而本实验通过CCI后内源性A2表达的时间变化曲线,我们检测到A2并未在损伤初期立即上调表达,而是在3 d后升高,在7 d时达到高峰。在这之前的时间里,内源性的A2并未显著升高,这就是应用外源性rA2干预尽早保护血脑屏障的时机,同时也可看出创伤后早期干预的重要性。尽管ZO-1蛋白并不直接参与相邻连接内皮细胞紧密连接的形成,但紧密连接蛋白需通过ZO-1与胞内的F-actin结合,从而将紧密连接结构固定在细胞的一侧[20]。正常情况下F-Actin均匀分布于胞内,在病理性刺激下,内皮细胞质膜的特定区域与基质之间常形成紧密黏附的黏着斑,在紧贴黏着斑的细胞膜质内侧有大量的微丝紧密排列成束,形成应力纤维。这种微丝的重排列导致紧密连接稳定性降低,血脑屏障通透性增加。当由于炎症、氧化应激导致内皮细胞损伤时,胞内的ZO-1表达减少,大量应力纤维出现[21-23]。本实验中给予rA2后,Occludin和Claudin-5的表达无明显改变,但是ZO-1表达显著增加,提示rA2并未直接作用于紧密连接蛋白,而是通过增加ZO-1表达,从而维持紧密连接的稳定性。脑水肿是一类危害颅脑创伤患者生命的严重并发症,由此引起的死亡率占到总死亡率的一半[24-25]。从成因上分类,脑水肿主要分为细胞毒性脑水肿和血管源性脑水肿。前者主要由于创伤内脑缺血缺氧引起神经细胞ATP生成减少,胞内离子潴留,渗透压增高,胞外水分进入细胞内引起肿胀;而血管源性脑水肿则是由于颅脑创伤后,血脑屏障通透性增加导致了包括蛋白质在内的高渗物质从血液转进入脑组织,导致组织胶体渗透压升高,水分被动进入脑实质内引起血管源性脑水肿[26-27]。本实验中,虽然rA2能改善血脑屏障功能,伤后rA2组脑组织水含量也低于对照组,但不具有统计学差异,一方面说明脑水肿病理机制的复杂性,A2对改善脑水肿的作用可能有限。另一方面,鉴于rA2有降低水肿的趋势,在下一步实验中我们将考虑加大剂量,以探索其改善脑水肿的可能性。
动物颅脑创伤模型中,尽管海马区未受到直接打击,但伤后仍能观察到该区域组织结构破坏与继发性神经元凋亡。海马区的神经元非常敏感,容易受到CCI后继发性损伤的影响,例如细胞毒性作用[28-29]、氧化应激[30-31]、炎症反应[32-33]、钙超载[34-35]和线粒体功能异常[31, 36]等。以往研究报道了脑缺血模型后,改善血脑屏障功能能减少海马区的神经元丢失[37]。本实验中,给予rA2降低了海马区神经元丢失,提示rA2通过血脑屏障发挥广泛的保护作用。由于海马区与记忆功能密切相关,下一步我们将进一步检测rA2对该区域的保护作用能否进一步影响小鼠记忆的恢复,从更多功能学探讨rA2的长期作用。
根据以上实验结果,我们证实了之前的假设,膜粘连蛋白Ⅱ作为一个脑保护因子,在颅脑损伤早期通过修复紧密连接,保护血脑屏障功能,从而减少神经元凋亡,促进伤后神经功能恢复。作为未来可能应用于创伤性颅脑损伤治疗的药物靶点,该因子有确切的疗效和良好的时间窗;尽管不能透过血脑屏障,但利用其血管重塑的特性可以从外周静脉给药,具有较好的临床转化前景。在下一步实验中,我们将更多探讨其远期疗效以及作用机制。
| [1] | WILLIS C L. Imaging in vivo astrocyte/endothelial cell interactions at the blood-brain barrier[J]. Methods Mol Biol, 2012, 814: 515–529. DOI:10.1007/978-1-61779-452-0_34 |
| [2] | ADELSON P D, WHALEN M J, KOCHANEK P M, et al. Blood brain barrier permeability and acute inflammation in two models of traumatic brain injury in the immature rat: a preliminary report[J]. Acta Neurochir Suppl, 1998, 71: 104–106. DOI:10.1007/978-3-7091-6475-4_31 |
| [3] | HAWKINS B T. The Blood-Brain Barrier/Neurovascular Unit in Health and Disease[J]. Pharmacological Reviews, 2005, 57(2): 173–185. DOI:10.1124/pr.57.2.4 |
| [4] | SHARMA H S, PATNAIK R, PATNAIK S, et al. Antibodies to serotonin attenuate closed head injury induced blood brain barrier disruption and brain pathology[J]. Ann N Y Acad Sci, 2007, 1122: 295–312. DOI:10.1196/annals.1403.022 |
| [5] | TOMKINS O, SHELEF I, KAIZERMAN I, et al. Blood-brain barrier disruption in post-traumatic epilepsy[J]. J Neurol Neurosurg Psychiatr, 2008, 79(7): 774–777. DOI:10.1136/jnnp.2007.126425 |
| [6] | UNTERBERG A W, STOVER J, KRESS B, et al. Edema and brain trauma[J]. Neuroscience, 2004, 129(4): 1021–1029. DOI:10.1016/j.neuroscience.2004.06.046 |
| [7] | VAN VLIET E A, DA COSTA ARA JO S, REDEKER S, et al. Blood-brain barrier leakage may lead to progression of temporal lobe epilepsy[J]. Brain, 2007, 130(Pt 2): 521–534. DOI:10.1093/brain/awl318 |
| [8] | ZLOKOVIC BV. The blood-brain barrier in health and chronic neurodegenerative disorders[J]. Neuron, 2008, 57(2): 178–201. DOI:10.1016/j.neuron.2008.01.003 |
| [9] | KORN A, GOLAN H, MELAMED I, et al. Focal cortical dysfunction and blood-brain barrier disruption in patients with Postconcussion syndrome[J]. J Clin Neurophysiol, 2005, 22(1): 1–9. DOI:10.1097/01.wnp.0000150973.24324.a7 |
| [10] | KIRCHHOFF C, STEGMAIER J, BOGNER V, et al. Intrathecal and systemic concentration of NT-proBNP in patients with severe traumatic brain injury[J]. J Neurotrauma, 2006, 23(6): 943–949. DOI:10.1089/neu.2006.23.943 |
| [11] | STAHEL PF, MORGANTI-KOSSMANN M C, Perez D, et al. Intrathecal levels of complement-derived soluble membrane attack complex (sC5b-9) correlate with blood-brain barrier dysfunction in patients with traumatic brain injury[J]. J Neurotrauma, 2001, 18(8): 773–781. DOI:10.1089/089771501316919139 |
| [12] | KORN A, GOLAN H, MELAMED I, et al. Focal cortical dysfunction and blood-brain barrier disruption in patients with Postconcussion syndrome[J]. J Clin Neurophysiol, 2005, 22(1): 1–9. DOI:10.1097/01.wnp.0000150973.24324.a7 |
| [13] | STRBIAN D, DURUKAN A, PITKONEN M, et al. The blood-brain barrier is continuously open for several weeks following transient focal cerebral ischemia[J]. Neuroscience, 2008, 153(1): 175–181. DOI:10.1016/j.neuroscience.2008.02.012 |
| [14] | GERKE V. ANNEXINS A2 and A8 in endothelial cell exocytosis and the control of vascular homeostasis[J]. Biol Chem, 2016, 397(10): 995–1003. DOI:10.1515/hsz-2016-0207 |
| [15] | LIU W, HAJJAR K A. The annexin A2 system and angiogenesis[J]. Biol Chem, 2016, 397(10): 1005–1016. DOI:10.1515/hsz-2016-0166 |
| [16] | ONISHI M, ICHIKAWA T, KUROZUMI K, et al. Annexin A2 regulates angiogenesis and invasion phenotypes of malignant glioma[J]. Brain Tumor Pathol, 2015, 32(3): 184–194. DOI:10.1007/s10014-015-0216-6 |
| [17] | LEE D B, JAMGOTCHIAN N, ALLEN S G, et al. Annexin A2 heterotetramer: role in tight junction assembly[J]. Am J Physiol Renal Physiol, 2004, 287(3): F481–F491. DOI:10.1152/ajprenal.00175.2003 |
| [18] | CRISTANTE E, MCARTHUR S, MAURO C, et al. Identification of an essential endogenous regulator of blood-brain barrier integrity, and its pathological and therapeutic implications[J]. Proc Natl Acad Sci USA, 2013, 110(3): 832–841. DOI:10.1073/pnas.1209362110 |
| [19] | LIGHTHALL J W. Controlled cortical impact: a new experimental brain injury model[J]. Journal of Neurotrauma, 1988, 5(1): 1. DOI:10.1089/neu.1988.5.1 |
| [20] | LAI C H, KUO K H, LEO J M. Critical role of actin in modulating BBB permeability[J]. Brain Research Reviews, 2005, 50(1): 7–13. DOI:10.1016/j.brainresrev.2005.03.007 |
| [21] | LUM H, ROEBUCK KA. Oxidant stress and endothelial cell dysfunction[J]. Am J Physiol, Cell Physiol, 2001, 280(4): C719–C741. |
| [22] | MARCOS-RAMIRO B, GARC A-WEBER D, MILL N J. TNF-induced endothelial barrier disruption: beyond actin and Rho[J]. Thromb Haemost, 2014, 112(6): 1088–1102. DOI:10.1160/TH14-04-0299 |
| [23] | ABU TAHA A, SCHNITTLER HJ. Dynamics between actin and the VE-cadherin/catenin complex: novel aspects of the ARP2/3 complex in regulation of endothelial junctions[J]. Cell Adh Migr, 2014, 8(2): 125–135. DOI:10.4161/cam.28243 |
| [24] | MARMAROU A. Pathophysiology of traumatic brain edema: current concepts[J]. Acta Neurochir Suppl, 2003, 86: 7–10. DOI:10.1007/978-3-7091-0651-8_2 |
| [25] | FEICKERT H J, DROMMER S, HEYER R. Severe head injury in children: impact of risk factors on outcome[J]. J Trauma, 1999, 47(1): 33–38. DOI:10.1097/00005373-199907000-00008 |
| [26] | DONKIN J J, VINK R. Mechanisms of cerebral edema in traumatic brain injury: therapeutic developments[J]. Curr Opin Neurol, 2010, 23(3): 293–299. DOI:10.1097/WCO.0b013e328337f451 |
| [27] | KLATZO I. Pathophysiological aspects of brain edema[J]. Acta Neuropathol, 1987, 72(3): 236–239. DOI:10.1007/bf00691095 |
| [28] | CHOI D W. Glutamate receptors and the induction of excitotoxic neuronal death[J]. Prog Brain Res, 1994, 100: 47–51. DOI:10.1016/s0079-6123(08)60767-0 |
| [29] | CHOI D W. Excitotoxic cell death[J]. J Neurobiol, 1992, 23(9): 1261–1276. DOI:10.1002/neu.480230915 |
| [30] | SMITH J A, PARK S, KRAUSE J S, et al. Oxidative stress, DNA damage, and the telomeric complex as therapeutic targets in acute neurodegeneration[J]. Neurochem Int, 2013, 62(5): 764–775. DOI:10.1016/j.neuint.2013.02.013 |
| [31] | SINGH I N, SULLIVAN P G, DENG Y, et al. Time course of post-traumatic mitochondrial oxidative damage and dysfunction in a mouse model of focal traumatic brain injury: implications for neuroprotective therapy[J]. J Cereb Blood Flow Metab, 2006, 26(11): 1407–1418. DOI:10.1038/sj.jcbfm.9600297 |
| [32] | ALLAN S M, ROTHWELL N J. Inflammation in central nervous system injury[J]. Philos Trans R Soc Lond, B, Biol Sci, 2003, 358(1438): 1669–1677. DOI:10.1098/rstb.2003.1358 |
| [33] | DAS M, MOHAPATRA S, MOHAPATRA S S. New perspectives on central and peripheral immune responses to acute traumatic brain injury[J]. J Neuroinflammation, 2012, 9: 236. DOI:10.1186/1742-2094-9-236 |
| [34] | HALL E D, SULLIVAN P G, GIBSON T R, et al. Spatial and temporal characteristics of neurodegeneration after controlled cortical impact in mice: more than a focal brain injury[J]. J Neurotrauma, 2005, 22(2): 252–265. DOI:10.1089/neu.2005.22.252 |
| [35] | DENG Y, THOMPSON B, GAO X, et al. Temporal relationship of peroxynitrite-induced oxidative damage, calpain-mediated cytoskeletal degradation and neurodegeneration after traumatic brain injury[J]. Experimental Neurology, 2007, 205(1): 154–165. DOI:10.1016/j.expneurol.2007.01.023 |
| [36] | MAZZEO A T, BEAT A, SINGH A, et al. The role of mitochondrial transition pore, and its modulation, in traumatic brain injury and delayed neurodegeneration after TBI[J]. Exp Neurol, 2009, 218(2): 363–370. DOI:10.1016/j.expneurol.2009.05.026 |
| [37] | LEE J Y, LEE H E, KANG S R, et al. Fluoxetine inhibits transient global ischemia-induced hippocampal neuronal death and memory impairment by preventing blood-brain barrier disruption[J]. Neuropharmacology, 2014, 79: 161–171. DOI:10.1016/j.neuropharm.2013.11.011 |



