2. 400038 重庆,第三军医大学西南医院生物治疗中心
2. Biological Therapy Center, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
肝细胞性肝癌(hepatocellular carcinoma,HCC)是世界范围内的恶性肿瘤,具有较高的发病率和病死率,也是我国常见的恶性肿瘤之一[1]。目前肝癌的治疗手段主要有手术切除、放化疗、肝移植等,但患者的术后生存率仍然很低。肝癌干细胞(liver cancer stem cells, LCSCs)存在于肝癌组织中,是一群具有自我更新能力并能产生异质性肿瘤的细胞。它的存在是肝癌发生、复发、侵袭和转移的根源,且与肝癌患者的预后差有重要关系[2]。因此,研究和开发靶向肝癌干细胞的治疗方案成为肝癌治疗的热点。FOXO是一类广泛存在于真核生物中的转录因子,是叉头框(forkhead box,Fox)蛋白家族的成员之一,在细胞代谢、增殖、氧化应激和凋亡等方面发挥重要作用[3-5]。FOXO3a是FOXO家族中的重要一员,研究证实FOXO3a的表达异常与多种肿瘤的发生、发展及预后密切相关,被认为是重要的肿瘤抑制因子[6-9]。FOXO3a是磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)信号通路的重要靶分子,通过上调凋亡前基因Bim和非特异性周期依赖性激酶抑制因子p27Kip1以及肿瘤坏死因子相关凋亡诱导配体(TRAIL)发挥抑癌作用[10]。在肝癌相关研究中发现,FOXO3a与肝癌细胞的部分生物学行为(如凋亡[11]和增殖[12]以及血管生成[13]等)有关,但FOXO3a在肝癌干细胞中的作用目前尚不清楚。我们前期研究发现,类胰岛素生长因子(insulin-like growth factor, IGF)信号在维持肝癌干细胞自我更新中发挥着重要作用[2],而IGF信号可通过PI3K/Akt通路磷酸化FOXO3a,使其从细胞核转位至细胞质并被降解[14]。这提示FOXO3a可能参与了肝癌干细胞自我更新的调节。因此,本研究首先检测了FOXO3a在肝癌干细胞中的表达情况,然后通过上调或干扰FOXO3a的表达,观察FOXO3a表达水平的改变对肝癌干细胞自我更新能力的影响及其重要的分子机制,以明确FOXO3a在肝癌干细胞自我更新中的作用。
1 材料与方法 1.1 实验材料稳定表达Lv-PNanog-GFP的肝癌细胞系Huh7、PLC/PRF/5,人胚肾细胞HEK-293FT均由第三军医大学西南医院生物治疗中心实验室保存。过表达FOXO3a的慢病毒质粒pCDH-CAG-Flag-FOXO3a-WPRE分别靶向FOXO3a基因CDS区与UTR区的2个干扰质粒(pLKO.1-shFOXO3a-1、pLKO.1-shFOXO3a-2) 以及3个包装质粒(pMD2.G、pRsv-REV、pMDLg/pRRE)均由本实验室保存。
1.2 主要试剂及仪器DMEM培养基、DMEM/F12培养基购自美国Gibco公司,胎牛血清(fetal bovine serum, FBS)购自以色列Biological industries公司,胰蛋白酶购自美国Sigma公司,细胞因子表皮生长因子(epidermal growth factor,EGF)、碱性成纤维细胞生长因子(basic fibroblast growthfactor,bFGF)以及肝细胞生长因子(hepatocytegrowth factor,HGF)均购自美国PeproTech公司,B27购自美国Gibco公司,青、链霉素购自华北制药,RNA提取试剂盒、RNA反转录试剂盒购自TaKaRa公司,GAPDH、FOXO3a抗体购自Cell Signaling Technology公司,p-FOXO3a抗体购自Millopore公司。CO2恒温培养箱(美国Thermo公司),流式细胞仪(美国BD公司),荧光定量PCR仪(美国Bio-Rad公司),多功能酶标仪(美国Thermo公司)。
1.3 实验方法 1.3.1 细胞的培养及肝癌干细胞的获得细胞用含有10%FBS的DMEM完全培养基进行培养,培养条件为:恒温37 ℃和5%(体积分数)CO2。待细胞生长状态良好,细胞汇合度达到80%左右时,弃去培养基,PBS洗1~2次,然后用胰酶消化,待细胞胞质回缩变圆,用含10%FBS的DMEM完全培养基终止消化,离心收集细胞,进行传代培养或后续使用。
基于我们前期建立的Nanog启动子驱动的GFP报告系统[2],将按上述方法培养的稳定感染Lv-PNanog-GFP慢病毒的肝癌细胞消化离心收集后,用PBS重悬,细胞悬液过200目筛网,利用流式细胞仪根据GFP荧光的强弱分选GFP阳性和GFP阴性细胞,即为Nanog阳性(+)的肝癌干细胞以及Nanog阴性(-)的肝癌细胞。
1.3.2 慢病毒的包装、纯化和对细胞的感染用含有10%FBS的DMEM完全培养基培养人胚肾细胞HEK-293FT至最佳状态,当细胞汇合度达到80%左右时,将HEK-293FT细胞在转染前24 h以合适的密度铺于10 cm培养皿中;转染前2 h换成含2%FBS的DMEM培养液。将6 μg pMD2.G质粒、3 μg pRsv-REV质粒、4 μg pMDLg /pRRE质粒和20 μg载体质粒轻柔混匀,再向混合液中加入50 μL 2.5 mol/L的CaCl2,用去离子水补齐至500 μL。将500 μL的2×HEPES缓冲液逐滴加入到上述500 μL混合液中,边滴加边涡旋振荡,室温静置20 min后,逐滴加到培养皿中,混匀,置于37 ℃,5%(体积分数)CO2细胞培养箱中培养。10~12 h后,更换为含10%FBS的DMEM培养液继续培养。转染48 h后收集上清,PEG6000纯化后,过滤除菌,测定滴度后进行分装,置于-80 ℃保存。
将培养良好的细胞以每孔2×105个铺于6孔细胞培养板中,待细胞贴壁后,换成含有4 mg/mL Polybrene的完全培养基进行培养,并以10个感染复数(multiplicity of infection,MOI)的病毒量感染细胞,然后置于37 ℃,5%CO2细胞培养箱中培养。10~12 h后更换新鲜的完全培养基继续培养。其中,以分别加入过表达FOXO3a的慢病毒pCDH-CAG-Flag-FOXO3a-WPRE和FOXO3a的干扰病毒pLKO.1-shFOXO3a-1、pLKO.1-shFOXO3a-2为实验组,不加病毒的为对照组。另外,以分别加入IGF激活剂IGF2或抑制剂AEW541为实验组,不加的为对照组。48 h后采用Western blot检测不同病毒的感染效率。
1.3.3 Western blot检测基因蛋白的表达收集细胞,PBS清洗1~2次,加入含有蛋白酶抑制剂和磷酸化蛋白酶抑制剂的细胞裂解液,冰上放置40 min,每隔10 min振荡1次。12 000 r/min离心15 min,收集上清,BCA测定蛋白浓度后按照体积比加入相应体积的5×loading buffer,涡旋混匀。100 ℃金属浴,10 min。然后进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。首先配制10%的分离胶和5%的浓缩胶制成胶版,根据测定的蛋白浓度调整上样体积,样品上样后进行电泳,电泳结束后将凝胶转到NC膜上,5%的脱脂奶粉室温封闭2 h。一抗孵育,4 ℃过夜。PBST洗膜3次,每次10 min,二抗孵育,室温2 h。PBST洗膜3次,每次10 min。最后加显影液曝光。
1.3.4 qRT-PCR检测基因mRNA的表达TRIzol提取细胞总RNA,紫外分光光度计检测RNA浓度。然后利用RNA反转录试剂盒将RNA反转为cDNA,采用实时荧光定量PCR仪进行扩增,用SYBR-GREEN进行检测,以GAPDH为内参,检测各组细胞内mRNA的表达水平。扩增程序为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃延伸30 s,70 ℃延伸30 s,共40个循环。
1.3.5 细胞克隆形成能力的检测收集细胞,按50个/孔接种于24孔板,每种细胞设置6个重复孔。用含10%FBS的DMEM完全培养基培养,放置于37 ℃,5% CO2细胞培养箱中。每3~4天更换1次新鲜培养液。根据不同细胞的生长状况,10~14 d时对克隆进行染色。弃去培养基,PBS洗1~2次;甲醇室温固定10 min;弃去甲醇,水洗,超净台中吹干;加入0.5%结晶紫溶液染色10~30 min;弃去结晶紫溶液,水洗,风干。根据不同细胞生长情况,一般以50个细胞以上的群体为1个克隆,统计克隆数,与接种的细胞数比较计算出克隆形成率。
克隆形成率=(平均克隆形成个数/接种细胞数)×100%
1.3.6 细胞成球生长能力的检测收集细胞,按10个/孔接种于低黏附的96孔板中,每种细胞设置6个重复孔。用成球培养基(DMEM/F12培养基中加入20 ng/mL bFGF、20 ng/mL EGF、10 ng/mL HGF、20 μL/mL B27及适量抗生素)进行培养,放置于37 ℃,5%CO2细胞培养箱中。每3~4天补加1次新鲜培液。根据不同细胞的生长状况,10~14 d后在显微镜下观察,统计每孔中直径>75 μm的细胞球,与接种的细胞数比较计算细胞球形成率。
成球率=(平均细胞球数/接种细胞数)×100%
1.4 统计学分析数据以x±s表示,采用Excel 2016统计软件进行方差分析及t检验。检验水准:α=0.05。
2 结果 2.1 FOXO3a在肝癌干细胞中低表达将稳定感染Lv-PNanog-GFP慢病毒的肝癌细胞系PLC/PRF/5,经过流式细胞仪分选为Nanog(+)和Nanog(-)两群细胞,采用qRT-PCR检测两群细胞中FOXO家族成员的表达情况。结果显示,FOXO3a在Nanog(+)肝癌干细胞中的表达明显低于Nanog(-)细胞(P < 0.01,图 1)。这提示FOXO3a可能与肝癌干细胞的“干性”有关。
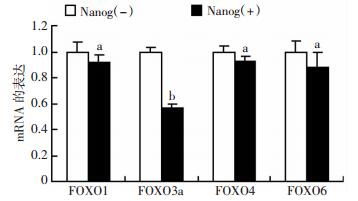
|
| a: P < 0.05,b: P < 0.01, 与Nanog(-)细胞比较 图 1 FOXO3a在Nanog(+)肝癌干细胞和Nanog(-)肝癌细胞中的表达 |
2.2 FOXO3a的表达受IGF负向调控
通过激活或抑制IGF活性检测FOXO3a的表达,以明确FOXO3a表达水平的改变是否受到IGF的调控。在肝癌细胞系Huh7和PLC/PRF/5的Nanog(+)肝癌干细胞中加入IGF受体IGF1R的抑制剂AEW541抑制IGF信号,在Nanog(-)肝癌细胞中加入IGF2因子激活IGF信号,通过Western blot和qRT-PCR检测FOXO3a蛋白和mRNA的表达情况。结果显示,使用IGF1R抑制剂AEW541处理Nanog(+)细胞后,引起FOXO3a以及p-FOXO3a(S253) 蛋白表达水平的上调和mRNA表达水平的显著提高(P < 0.01);在Nanog(-)细胞加入IGF2激活剂后,FOXO3a及p-FOXO3a蛋白的表达水平则降低。这表明FOXO3a的表达受到IGF信号的负向调控(图 2)。
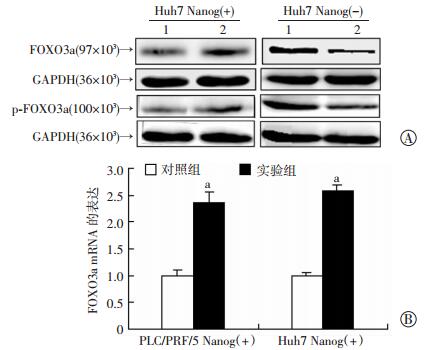
|
| A:Western blot检测Nanog(+)细胞使用IGF1R抑制剂AEW541、Nanog(-)细胞中加入IGF2激活剂处理后FOXO3a及p-FOXO3a的蛋白表达1:对照组,2:实验组;B:qRT-PCR检测Nanog(+)细胞使用IGF1R抑制剂AEW541处理后FOXO3a mRNA的表达 a:P < 0.01,与对照组比较 图 2 IGF活性的改变对FOXO3a表达水平的影响 |
2.3 FOXO3a过表达和干扰细胞模型的建立
分别用过表达FOXO3a的慢病毒pCDH-CAG-Flag-FOXO3a-WPRE和FOXO3a的干扰病毒pLKO.1-shFOXO3a-1、pLKO.1-shFOXO3a-2感染肝癌细胞系Huh7和PLC/PRF/5的Nanog(+)细胞和Nanog(-)细胞。72 h后消化、离心收集细胞,提取细胞总蛋白,Western blot检测病毒的感染效率。结果显示,Nanog(+)细胞过表达FOXO3a后,FOXO3a的表达水平提高(图 3A);Nanog(-)细胞进行FOXO3a干扰后,FOXO3a的表达水平降低(图 3B)。这说明两种慢病毒的感染效率均比较好,可作为稳定的过表达和干扰细胞模型进行后续实验。
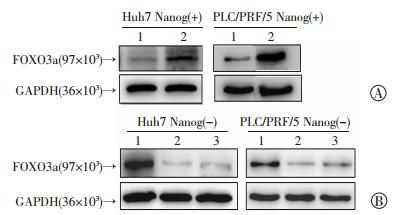
|
| A:过表达FOXO3a载体的效果检测 1:对照组,2:过表达FOXO3a组;B:FOXO3a两种干扰载体的效果检测 1:对照组,2:shFOXO3a-1组,3:shFOXO3a-2组 图 3 慢病毒上调或干扰FOXO3a的蛋白表达水平效率验证 |
2.4 过表达FOXO3a降低肝癌干细胞自我更新能力
采用克隆形成和细胞球形成实验检测Nanog(+)肝癌干细胞在过表达FOXO3a前后自我更新能力的改变。结果显示,肝癌细胞系Huh7和PLC/PRF/5的Nanog(+)细胞中感染pCDH-CAG-Flag-FOXO3a-WPRE后,细胞的克隆形成能力和成球生长能力均明显降低(P < 0.05,P < 0.01,图 4)。这表明FOXO3a在肝癌干细胞中低表达不仅仅是一种生物学现象,它对于肝癌干细胞自我更新的维持具有重要作用。
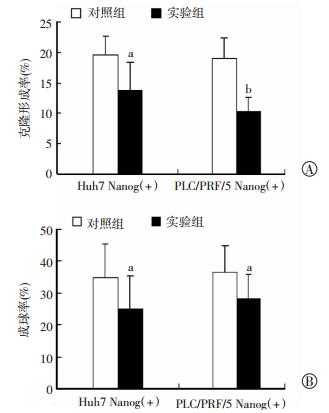
|
|
a:P < 0.05,b:P < 0.01,与对照组比较 A:Nanog(+)过表达FOXO3a后,细胞克隆形成能力降低;B:Nanog(+)过表达FOXO3a后,细胞成球生长能力降低 图 4 肝癌干细胞中FOXO3a过表达降低细胞自我更新能力 |
2.5 下调FOXO3a的表达提升肝癌细胞向肝癌干细胞的转化能力
利用稳定干扰FOXO3a的Nanog(-)细胞进行细胞克隆形成实验和细胞球形成实验。结果显示,肝癌细胞系Huh7和PLC/PRF/5的Nanog(-)细胞中感染Lv-sh-FOXO3a-1(实验组1) 或Lv-sh-FOXO3a-2(实验组2) 后,细胞的克隆形成能力和成球生长能力均得到明显提高(P < 0.05,P < 0.01,图 5)。这表明下调FOXO3a的表达增强了肝癌细胞向肝癌干细胞转化的能力。
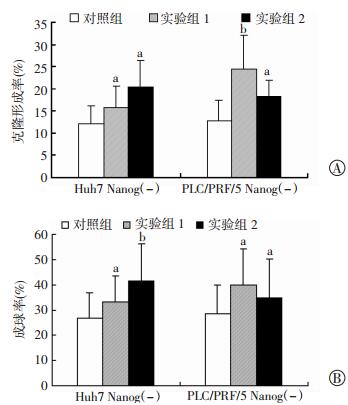
|
|
a:P < 0.05,b:P < 0.01,与对照组比较 A:Nanog(-)细胞中下调FOXO3a后细胞克隆形成能力提高;B:Nanog(-)细胞中下调FOXO3a后细胞成球生长能力提高 图 5 下调FOXO3a提升肝癌细胞向肝癌干细胞的转化能力 |
2.6 FOXO3a在IGF的负向调控下参与肝癌干细胞自我更新的维持
在肝癌细胞系Huh7的Nanog(-)中加入IGF2因子激活IGF信号,并在激活IGF的同时过表达FOXO3a,在FOXO3a表达变化下进一步检测细胞的自我更新能力。结果显示,IGF信号被激活后,FOXO3a的表达明显降低,在此基础上过表达FOXO3a后,FOXO3a的表达水平得到恢复, 且IGF对于细胞的克隆形成能力和成球生长能力的提升作用可被过表达FOXO3a显著抑制(P < 0.01,图 6)。这表明FOXO3a在IGF对肝癌干细胞自我更新的维持中起着重要的作用,FOXO3a通过IGF对其的负向调控,参与肝癌干细胞自我更新的维持。
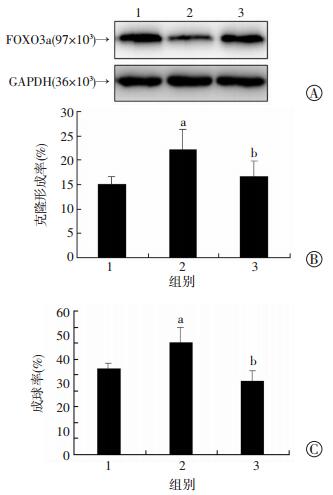
|
|
1:对照组;2:加入IGF2因子组;3:加入IGF2因子同时过表达FOXO3a组 a: P < 0.05,与对照组比较;b:P < 0.01,与加入IGF2因子组比较 A: Western blot检测各组FOXO3a的表达;B:各组细胞克隆形成能力的改变;C:各组细胞成球生长能力的变化 图 6 FOXO3a通过IGF对其的负向调控参与肝癌干细胞自我更新的维持 |
3 讨论
肝癌大多数情况下为原发性肝细胞癌,指肝细胞或肝内胆管细胞发生的癌,其发病率较高,术后生存率低,是常见的恶性肿瘤之一[15]。肝癌干细胞作为一群具有自我更新能力的肿瘤细胞,其在肝癌的发生、发展中起重要作用。FOXO3a是FOXO家族中最重要的一员,在肝癌细胞的凋亡和增殖等生物学行为中起重要作用,还与肝癌的组织学分级、肝硬化程度及肿瘤体积有关[16],被认为是重要的肝癌抑制因子和预后因子。
研究显示,在胚胎干细胞中FOXO高表达参与胚胎干细胞“干性”维持[17],在胶质瘤干细胞中则表现为促进分化[18]。为了探讨FOXO3a与肝癌干细胞之间的关系,本研究首先检测了肝癌干细胞中FOXO3a的表达,结果显示,与肝癌细胞相比,FOXO3a在肝癌干细胞中的表达明显降低,并证实了FOXO3a在肝癌干细胞中表达下调的相关机制,即FOXO3a受到了IGF的负向调控。我们通过上调或干扰FOXO3a的表达,检测细胞的克隆形成能力和成球生长能力,发现FOXO3a对肝癌干细胞的自我更新能力具有负向调节作用。这充分说明FOXO3a低表达不仅仅是一种生物学现象,而且在肝癌干细胞自我更新的维持中也起着重要作用。上调FOXO3a的表达,降低肝癌干细胞自我更新能力;反之,FOXO3a表达的下调可以提高肝癌细胞向肝癌干细胞转化的能力。联系到FOXO3a可受到IGF的负向调控,以及我们前期研究发现并证实的IGF在肝癌干细胞自我更新中发挥重要作用[2],我们对其之间的联系进行了深入探讨。结果发现在肝癌细胞中加入IGF2激活剂后,同时过表达FOXO3a,细胞的自我更新能力下降。此现象表明FOXO3a介导IGF对肝癌干细胞自我更新能力的调控,FOXO3a通过IGF对其的负向调节,在肝癌干细胞自我更新的维持中起到了重要作用。
本研究明确了FOXO3a在肝癌干细胞自我更新维持中的作用和部分相关机制。在FOXO3a的自身调节机制方面,FOXO3a的活性受到蛋白水平上的磷酸化、乙酰化、甲基化和泛素化修饰以及基因水平上的自身正反馈等调节[19],关于其具体的作用机制还有待进一步探讨。近年来,在肿瘤研究方面,基因的靶向治疗越来越受到重视。FOXO3a由于其在细胞相关进程如凋亡和增殖中的重要作用及其与肿瘤发生、发展的密切关系,已成为包括肝癌在内的癌症研究治疗中关键的新靶点,以FOXO3a为靶向的基因治疗具有潜在的应用价值。因此,需要更深层次地探讨FOXO3a的具体作用方式和作用机制。
| [1] | TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [2] | SHAN J, SHEN J, LIU L, et al. Nanog regulates self-renewal of cancer stem cells through the insulin-like growth factor pathway in human hepatocellular carcinoma[J]. Hepatology, 2012, 56(3): 1004–1014. DOI:10.1002/hep.25745 |
| [3] | HEDRICK S M, HESS MICHELINI R, DOEDENS A L, et al. FOXO transcription factors throughout T cell biology[J]. NatRev Immunol, 2012, 12(9): 649–661. DOI:10.1038/nri3278 |
| [4] | WEBB A E, BRUNET A. FOXO transcription factors: key regulators of cellular quality control[J]. Trends BiochemSci, 2014, 39(4): 159–169. DOI:10.1016/j.tibs.2014.02.003 |
| [5] | WANG Y, ZHOU Y, GRAVES D T. FOXO transcription factors: their clinical significance and regulation[J]. Biomed Res Int, 2014, 2014: 925350. DOI:10.1155/2014/925350 |
| [6] | NI D, MA X, LI H Z, et al. Downregulation of FOXO3a promotes tumor metastasis and is associated with metastasis-free survival of patients with clear cell renal cell carcinoma[J]. Clin Cancer Res, 2014, 20(7): 1779–1790. DOI:10.1158/1078-0432.CCR-13-1687 |
| [7] | LIU H, YIN J, WANG H, et al. FOXO3a modulates WNT/β-catenin signaling and suppresses epithelial-to-mesenchymal transition in prostate cancer cells[J]. Cell Signal, 2015, 27(3): 510–518. DOI:10.1016/j.cellsig.2015.01.001 |
| [8] | SANTO E E, STROEKEN P, SLUIS P V, et al. FOXO3a is a major target of inactivation by PI3K/AKT signaling in aggressive neuroblastoma[J]. Cancer Res, 2013, 73(7): 2189–2198. DOI:10.1158/0008-5472.CAN-12-3767 |
| [9] | JIANG Y, ZOU L, LU W Q, et al. Foxo3a expression is a prognostic marker inbreast cancer[J]. PLoS One, 2013, 8(8): e70746. DOI:10.1371/journal.pone.0070746 |
| [10] | NHO R S, HERGERT P. FoxO3a and disease progression[J]. World J Biol Chem, 2014, 5(3): 346–354. DOI:10.4331/wjbc.v5.i3.346 |
| [11] | CARBAJO-PESCADOR S, STEINMETZ C, KASHYAP A, et al. Melatonin inducestranscriptional regulation of Bim by FoxO3a in HepG2 cells[J]. Br J Cancer, 2013, 108(2): 442–449. DOI:10.1038/bjc.2012.563 |
| [12] | LIANG C, CHEN W, ZHI X, et al. Serotonin promotes the proliferation of serum-deprived hepatocellular carcinoma cells via upregulation of FOXO3a[J]. Mol Cancer, 2013, 12(1): 14. DOI:10.1186/1476-4598-12-14 |
| [13] | WANG J, ZHENG X, ZENG G, et al. Purified vitexin compound 1 inhibits growthand angiogenesis through activation of FOXO3a by inactivation of Akt in hepatocellular carcinoma[J]. Int J Mol Med, 2014, 33(2): 441–448. DOI:10.3892/ijmm.2013.1587 |
| [14] | ZHANG X, RIELLAND M, YALCIN S, et al. Regulation and function of FoxO transcription factors in normal and cancer stem cells: what have we learned?[J]. Curr Drug Targets, 2011, 12(9): 1267–1283. DOI:10.2174/138945011796150325 |
| [15] | FORNER A, LLOVET J M, BRUIX J. Hepatocellular carcinoma[J]. Lancet, 2012, 379(9822): 1245–1255. DOI:10.1016/S0140-6736(11)61347-0 |
| [16] | LU M, MA J, XUE W, et al. The expression and prognosis of FOXO3a and Skp2 in human hepatocellular carcinoma[J]. Pathol Oncol Res, 2009, 15(4): 679–687. DOI:10.1007/s12253-009-9171-z |
| [17] | VILCHEZ D, BOYER L, MORANTTE I, et al. Increased proteasome activity in human embryonic stem cells is regulated by PSMD11[J]. Nature, 2012, 489(7415): 304–308. DOI:10.1038/nature11468 |
| [18] | SUNAYAMA J, SATO A, MATSUDA K, et al. FoxO3a functions as a key integrator of cellular signals that control glioblastoma stem-like cell differentiation and tumorigenicity[J]. Stem Cells, 2011, 29(9): 1327–1337. DOI:10.1002/stem.696 |
| [19] | EIJKELENBOOM A, BURGERING B M. FOXOs: signalling integrators for homeostasis maintenance[J]. Nat Rev Mol Cell Biol, 2013, 14(2): 83–97. DOI:10.1038/nrm3507 |



