2. 610083 成都,成都军区总医院: 检验科
2. Department of Clinical Laboratory, General Hospital of Chengdu Military Command, Chengdu, Sichuan Province, 610083, China
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是肝实质细胞脂肪变性和脂肪过量储存为特征的临床综合征。其病理基础是肝实质细胞的脂肪再分布, 其具体的机制为“二次打击学说”,即细胞脂肪堆积后线粒体代谢活跃而引起的生物膜损伤, 目前遏制和修复肝细胞损伤是临床治疗的重要措施[1]。由于膜损伤的具体机制未明,导致药物对肝细胞膜修复效果欠佳[2]。水通道蛋白(aquaporin, AQPs)是一个拥有13个成员的跨膜蛋白家族,其成员为AQP0 ~AQP12,它们介导不同类型细胞的跨膜水转运,对细胞膜结构和功能的完整性维持具有重要作用[3]。体外研究表明,AQP3、7、9可能参与了肝脏纤维化[4]和脂肪病变[5-6], 以及肝癌发展进程[5, 7],这些研究结果均提示AQPs与肝细胞膜损伤关系密切。药物多烯磷脂酰胆碱(plyene posphatidyl coline, PPC)通过提供细胞膜脂质组成,进而参与了肝细胞膜的修复,对NAFLD有明显的疗效[8],但临床实际应用中存在部分患者疗效欠佳,这是否与AQPs表达差异之间存在相关性,目前仍少见报道。本研究随访分析2014-2016年本院收治的NAFLD患者87例,探讨多烯磷脂酰胆碱对NAFLD的疗效与AQPs表达关系,为临床治疗提供参考。
1 资料与方法 1.1 研究对象收集2014-2016年在成都军区总医院入院病因诊断为NAFLD患者,所有患者转氨酶明显高于正常参考上限, 具有明显的肝炎表现, 患者均入消化内科肝脏穿刺,经《NAFLD诊疗指南》和病理肝脏组织活检查确诊为非酒精脂肪性肝硬化患者30例[男/女:15/15;年龄:(7.13±12.35) 岁],非酒精脂肪性肝纤维化患者24例[/女:11/13;年龄:(4.07±17.06) 岁],酒精性脂肪性肝炎患者33例[男/女:15/18;年龄:(9.01± 18.24) 岁]; 同时排除病毒性肝炎、自身免疫性肝炎、其他明确的肝损因素的肝炎、遗传病及其他基础代谢疾病,排除药物使用期间采用手术和化疗药物的患者。每位研究对象均随访3个月。期间所有患者均口服多烯磷脂酰胆碱胶囊456 mg 3次/d进行保肝治疗,期间无失访。本研究经医院伦理委员会2013年10月审批通过,研究对象均知情同意并签订知情同意书,保留详细的临床资料。
1.2 研究分组及PPC疗效判断随访开始按照病理和临床确认分组:肝硬化组(n=30), 肝纤维化组(n=24),肝炎组(n=33)。PPC疗效判别依据[8-9],有效组:超声评分下降一个等级以上; 无效组:超声评分下降未达到一个等级级。超声具体评分见表 1。
| 超声征象 | 0分 | 1分 | 2分 | 3分 |
| 肝肾皮质回声对比 | 无差别 | 肝回声增强 | 肝回声明显增强 | |
| 最深部肝和横膈 | 清楚 | 不清楚 | 不能辨认 | |
| 肝内血管 | 清楚 | 不清楚 | 不能辨认 | |
| 肝形态 | 正常 | 边缘饱满 | 轻度增大 | 明显增大 |
| 评分分度 | 一级:0~2基本正常;二级:3~4轻度;三级:5~7中度;四级:8~9重度 | |||
1.3 研究试剂
Mouse Anti-human AQP 3、7、9(cell signal)、HE染色试剂盒(上海歌凡生物科技有限公司)、anti-GAPDH(DAKO)、Rabbit Anti-mouse n IgG(DAKO)、免疫组化DAB试剂盒(北京中杉金桥),WB发光试剂(MILLIPORE公司)。主要仪器:BECKMAN DU640核酸蛋白分析仪、冰冻和石蜡切片机(瑞士Laica公司)。
1.4 方法 1.4.1 HE染色取肝穿刺组织标本进行固定,切片,后进行苏木精染色5 min,浸自来水中10 min冲洗,再用蒸馏水洗涤10s;95%乙醇5 s,伊红染色60 s, 70%乙醇2次洗涤, 脱水、透明后封片按后封片处理。
1.4.2 免疫组织化学染色(S-P法)组织切片经抗原修复、血清封闭后,加入Anti-AQP3、7、9抗体(1:100) 孵育过夜(>8 h)后,再滴加二抗(1:500) 孵育,DAB显色,50%甘油封片,在显微镜镜下观察采图。
1.4.3 免疫印迹检测取组织提取蛋白上样电泳,转膜并封闭;一抗杂交,按1:1 000加入到5%脱脂奶粉的TBST溶液中,室温下放置30 min,4 ℃过夜(超过8 h),0.01 mol/L PBST冲洗15 min×3次;二抗结合,按1:1 000加入到5%脱脂奶粉的TBST溶液中,室温下放置2 h,0.01 mol/L PBST洗15 min×3次;显色、压片、显影以及分析对比:将PVDF置于化学发光试剂中增强反应1~3min, 在暗室中使X线片曝光,常规方法显影,定影,进行灰度值计算分析。
1.5 统计学分析用SPSS 17.0统计软件包处理数据,计量资料以x±s表示,采用t检验;计数资料采用卡方检验和相关性进行统计,检验水准α=0.05。
2 结果 2.1 不同病程组NAFLD患者用药前的病理状态按随访的NAFLD患者病理病程分组,各组在药物使用前的肝功能酶指标谷丙转氨酶(ALT)和谷草转氨酶(AST)各组中差异无统计学意义(P > 0.05);超声评分差异有统计学意义(P < 0.01),其中肝硬化评分最高,肝炎组评分最低;肝组织的AQP 3和9表达差异无统计学意义(P > 0.05),AQP7在不同病程组中差异有统计学意义(P < 0.05,表 2)。
| 组别 | 年龄 (岁) |
性别 (男/女) |
ALT (IU/mL) |
AST (IU/mL) |
超声评分 (分) |
AQPs (灰度值×10) | ||
| 3 | 7 | 9 | ||||||
| 肝炎组(n=33) | 44.23±15.33 | 15/18 | 304.64±111.05 | 104.64±92.43 | 3.91±0.29 | 1.82±1.04 | 0.65±0.63 | 0.73±0.69 |
| 肝纤维化组(n=24) | 41.34±16.23 | 11/13 | 338.53±106.2 | 138.53±101.22 | 6.08±0.95 | 1.52±1.09 | 0.27±0.09 | 0.82±0.72 |
| 肝硬化组(n=30) | 43.23±12.33 | 15/15 | 328.81±145.23 | 128.81±87.22 | 8.3±0.46 | 1.55±0.91 | 0.91±0.72 | 0.92±0.70 |
| P | 0.588 | 0.547 | 0.585 | 0.778 | 0.000 | 0.240 | 0.018 | 0.586 |
2.2 PPC对不同病程NAFLD患者疗效差异分析
PPC持续使用3个月后,临床超声评分评价PPC对NAFLD的整体有效率约35.63%(31/87)。结合超声评估PPC疗效分组分析发现,不同病程组PPC治疗有效率差异无统计学意义(P > 0.01)。PPC对患者肝功能酶的调节,仅发现ALT在3个不同病程组均呈现显著(表 3)。对3个不同病程组的患者超声评分变化分成有效和无效组,发现3个不同病程组中超声评分变化与ALT改变均呈正相关,其中肝硬化组(R=0.780,P < 0.01),肝纤维化组(R=0.879,P < 0.01),肝炎组最高(R=0.900,P < 0.01),提示了ALT和超声评分变化可能反映了PPC治疗NAFLD效能。
| 组别 | 有效性分析 | ALT(IU/mL) | AST(IU/mL) | 超声评分 | ||||||||
| n | P | 下降程度 | P | 下降程度 | P | 下降程度 | P | |||||
| 肝硬化 | 无效组 | 19 | 0.669 | 56.53±19.99 | 0.000 | 65.3±29.10 | 0.457 | -0.47±0.51 | 0.019 | |||
| 有效组 | 11 | 195.09±49.76 | 85.09±42.11 | 2.18±0.40 | ||||||||
| 纤维化 | 无效组 | 14 | 44.71±19.39 | 0.000 | 24.72±29.55 | 0.987 | 0.64±0.50 | 0.000 | ||||
| 有效组 | 10 | 180.8±35.10 | 30.81±30.12 | 2.90±0.31 | ||||||||
| 肝炎 | 无效组 | 23 | 48.65±9.46 | 0.000 | 78.62±19.55 | 0.506 | 0.22±0.42 | 0.010 | ||||
| 有效组 | 10 | 201.1±20.78 | 91.11±30.72 | 2.40±0.70 | ||||||||
| AST和ALT正常范围0~50 U/mL | ||||||||||||
2.3 NAFLD患者初始肝组织AQPs的表达与PPC疗效的相关性分析
免疫组织化学和免疫印迹分析发现,PPC对不同病程组的NAFLD患者治疗效果差异与用药前的肝组织AQPs表达差异呈现相同趋势,即PPC治疗有效的NAFLD患者的肝组织AQP7、9表达明显高于无效患者,而肝组织AQP3的表达情况呈相反趋势(图 1、2)。AQPs表达水平分别与超声评分变化和ALT下降变化量相关,即NAFLD患者AQP7、9表达量与肝功能酶的变化量呈正相关(AQP9: R=0.972, AQP7: R=0.537),而AQP3的表达水平与肝功能酶的变化量呈负相关(R=-0.881); AQP7、9表达量与超声评分的变化量呈正相关(AQP9: R=0.763, AQP7: R=0.311),而AQP3的表达水平与超声评分的变化量呈负相关(R=-0.795)。

|
| 图 1 PPC不同疗效组的NAFLD患者治疗前的肝组织的AQP9、7、3的表达(×200) |
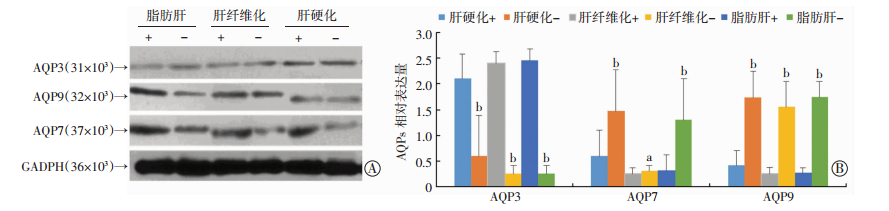
|
| A:免疫印迹检测结果;B:半定量分析结果a:P < 0.05, b:P < 0.01,与相同病理程度的治疗无效组比较,(+):药物作用后有效; (-):ALT药物作用后无效 图 2 免疫印迹检测NAFLD患者不同PPC疗效差异组之间的肝组织AQPs的表达 |
3 讨论
肝细胞的破坏及脂肪变、坏死、凋亡伴随于绝大多数慢性肝病的始终,是多种慢性肝病难以彻底治愈,甚至发展至肝纤维化、肝硬化的根本原因。有效地保护肝细胞,防止肝细胞的破坏,能够有效地阻止大多数慢性肝病的发生、发展[5]。但肝细胞发生水肿、变性、坏死的始动环节尚不十分明了,现有的保肝药物大多为抗炎、抗氧化制剂,其中细胞膜保护剂多烯磷脂酰胆碱含必需磷脂(天然胆碱磷酸二甘油酯[6],含多量不饱和脂肪酸,主要为亚油酸70%,亚麻酸和油酸)是一种临床常用的保肝药,在化学结构上与内源性磷脂一致,进入肝细胞后可以与肝细胞膜及细胞器膜相结合部分修复肝细胞膜,可用于保护肝细胞的治疗[7],但其药理作用并未根本上解决肝细胞膜损伤修复的问题,临床使用疗效有限[9]。本研究发现不同病程度的87例NAFLD患者多烯磷脂酰胆碱治疗3个月后其总体有效性仅为35.63%,PPC使用后肝功能酶的变化和超声评分的变化提示了PPC虽然在一定程度对损伤的肝细胞提供了细胞膜磷脂,但这种细胞膜磷脂对细胞的修补并不能真正完成肝细胞膜结构和功能的完整修复,特别是肝细胞膜上参与物质能量交换的跨膜蛋白通道减少和缺失可能就是PPC低效的重要原因[11]。
AQPs作为细胞中重要的物质能量交换通道蛋白[12],特别是在肝细胞的糖脂代谢和胆汁的代谢,以及肝癌的发生、发展中具有重要作用[10]。AQP3,7,9在人肝组织细胞膜中高表达参与细胞多种生理过程[13],在慢性肝病的发病初期以及肝癌的病程进展中,细胞膜的破坏引起的细胞坏死引起的组织器官功能的下调与AQPs表达异常密切相关[11]。本研究初步分析不同病程NAFLD患者在PPC使用前的肝组织AQPs的表达及表达水平,仅发现AQP7在不同病情严重程度的NAFLD患者中存在差异,在脂肪肝组和肝硬化组明显高于肝纤维化组, 这可能与AQP7蛋白调控甘油在细胞中的累积程度相关, 也可能与不同病程NAFLD患者肝脏组织中活性肝实质细胞数量, 以及AQP7的肝胆管和肝细胞原位强表达相关[13]。
本研究进一步分析了NAFLD患者PPC疗效和AQPs表达水平的相关性,发现NAFLD患者中的肝炎、肝纤维化以及肝硬化患者PPC疗效较好的患者AQPs的表达差异有统计学意义,具体表现为AQP7、9在PPC有效组中高表达,AQP3在PPC无效组中高表达;同时研究结果发现AQP7、9表达水平与PPC疗效评价指标(ALT下降程度和超声评分下降程度)正相关,而AQP3表达水平与PPC疗效呈负相关。这些结果提示了患者经PPC治疗AQP7和9高表达受益较好,而AQP3高表达则受益较差。其具体机制有以下两种可能:① AQPs蛋白作为肝细胞膜上重要的物质能力通道,对脂质和蛋白的代谢具有重要作用,有研究表明肝实质细胞高表达AQP7[12]和9[13-14]对脂类物质有高效的摄取能力,PPC进入血液循环到达肝组织释放脂质,肝细胞AQP7和AQP9表达直接影响了肝细胞对药物的获取,进而可能直接影响了药物的疗效;② AQP3的高表达显著提高肝星形细胞高在组织纤维化促进作用[15],AQP3的表达水平也在一定程度上反映了患者的肝组织总体细胞活力的大小,所以AQP3高表达可能明显下调了PPC的疗效;③ AQPs蛋白表达水平体现了肝组织中活性细胞的数量和肝脏代谢功能的多少,PPC使用的效果只能在适应于肝组织活性能力可能纠正的患者,而对肝组织损伤过重其修复能力较为有限,因而对于AQPs蛋白表达的种类和表达的程度可能是综合影响PPC的疗效。
本研究通过随访PPC在不同病情严重程度NAFLD的疗效发现,PPC作为肝细胞修复的物质来源,虽然在一定程度上修复缓解部分NAFLD患者肝细胞膜的损伤,但其实际疗效的高低可能需要考虑患者的本身的病理状态,即要考虑患者对于药物的吸收和补充能力,如AQPs在细胞中的不同功能。同时也提示了肝细胞膜修复不能单单依靠物质量的简单补充,也要考虑修复后的功能,如PPC的治疗虽然提供细胞膜的原材料物质磷脂,但需要考虑对肝细胞膜的功能完整性(细胞膜通道)的修复联合应用,进而提高PPC疗效。本研究结果可能为进一步的开发和完善肝细胞修复药物提供一些思路。
| [1] | PARK S H, JEON W K, KIM S H, et al. Prevalence and risk factors of non-alcoholic fatty liver disease among Korean adults[J]. J Gastroenterol Hepatol, 2006, 21(1 Pt 1): 138–143. DOI:10.1111/j.1440-1746.2005.04086.x |
| [2] | FAN J G, FARRELL G C. Epidemiology of non-alcoholic fatty liver disease in China[J]. J Hepatol, 2009, 50(1): 204–10. DOI:10.1016/j.jhep.2008.10.010 |
| [3] | MELO R, FIELDHOUSE R, MELO A, et al. A Machine Learning Approach for Hot-Spot Detection at Protein-Protein Interfaces[J]. Int J Mol Sci, 2016, 17(8). DOI:10.3390/ijms17081215 |
| [4] | TARDELLI M, MORENO-VIEDMA V, ZEYDA M, et al. Adiponectin regulates aquaglyceroporin expression in hepatic stellate cells altering their functional state[J]. J Gastroenterol Hepatol, 2017, J, 32(1): 253–260. DOI:10.1111/jgh.13415 |
| [5] | GU L Y, QIU L W, CHEN X F, et al. Oleic acid-induced hepatic steatosis is coupled with downregulation of aquaporin 3 and upregulation of aquaporin 9 via activation of p38 signaling[J]. Hormon-und Stoffwechselforschung = Hormones et metabolisme, 2015, 47(4): 259–264. DOI:10.1055/s-0034-1384569 |
| [6] | CAI C, WANG C, JI W, et al. Knockdown of hepatic aquaglyceroporin-9 alleviates high fat diet-induced non-alcoholic fatty liver disease in rats[J]. Int Immunopharmacol, 2013, 15(3): 550–556. DOI:10.1016/j.intimp.2013.01.020 |
| [7] | GUO X, SUN T, YANG M, et al. Prognostic value of combined aquaporin 3 and aquaporin 5 overexpression in hepatocellular carcinoma[J]. Biomed Res Int, 2013, 2013: 206525. DOI:10.1155/2013/206525 |
| [8] |
钱蕴秋. 超声诊断学[M]. 第2版. 西安: 第四军医大学出版社, 2008: 532.
QIAN Y Q. Diagnostic Medical Sonography[M]. The second edition. Xi'an: The Fourth Military Medical University Press, 2008: 532. |
| [9] |
苏红领, 朱玉侠, 高正军, 等. 双环醇与多烯磷脂酰胆碱治疗非酒精性脂肪肝的疗效比较[J].
中华肝脏病杂志, 2011, 19(7): 552–553.
SU H L, ZHU Y X, GAO Z J, et al. Efficacy comparison between bicyclol and polyene phosphatidylcholine treatments for the patients with nonalcoholic fatty liver disease[J]. Chin J Hepatol, 2011, 19(7): 552–553. DOI:10.3760/cma.j.issn.1007-3418.2011.07.019 |
| [10] |
李进, 李月翠, 胡伟跃, 等. 自拟降脂护肝方联合多烯磷脂酰胆碱治疗非酒精性脂肪肝的临床研究[J].
中华中医药学刊, 2015, 33(1): 236–239.
LI J, LI Y C, HU W Y, et al. Clinical Research of Self-Prepared Decoction of Lipid-Decreasing and Liver Protection Combined Polyene Phosphatidylcholine for Treatment of Nonalcoholic Fatty Liver Disease[J]. Chin Arch Tradi Chin Med, 2015, 33(1): 236–239. DOI:10.13193/j.issn.1673-7717.2015.01.071 |
| [11] |
刘梅, 陆伦根, 曾民德. 多烯磷脂酰胆碱对肝细胞保护机制的研究进展[J].
肝脏, 2006, 11(1): 43–45.
LIU M, LU L G, ZENG M D. Advances in the hepatocellulor protective machanisms of polyenylphosphatidylcholine[J]. Chin Hepatol, 2006, 11(1): 43–45. DOI:10.3969/j.issn.1008-1704.2006.01.016 |
| [12] | KOYAMA Y, YAMAMOTO T, TANI T, et al. Expression and localization of aquaporins in rat gastrointestinal tract[J]. Am J Physiol, 1999, 276(3 Pt 1): C621–C627. |
| [13] | ASHRAF Z, ALAMGEER, RASOOL R, et al. Synthesis, Bioevaluation and Molecular Dynamic Simulation Studies of Dexibuprofen-Antioxidant Mutual Prodrugs[J]. Int J Mol Sci, 2016, 17(12): pii: E2151. DOI:10.3390/ijms17122151 |
| [14] | LAFORENZA U. Water channel proteins in the gastrointestinal tract[J]. Mol Aspects Med, 2012, 33(5-6): 642–650. DOI:10.1016/j.mam.2012.03.001 |
| [15] | GREGOIRE F, LUCIDI V, ZERRAD-SAADI A, et al. Analysis of aquaporin expression in liver with a focus on hepatocytes[J]. Histochem Cell Biol, 2015, 144(4): 347–363. DOI:10.1007/s00418-015-1341-3 |



