急性缺血性脑卒中是致死、致残的主要疾病之一,而动脉粥样硬化是导致脑卒中事件发生的主要危险因素,动脉粥样硬化管腔的狭窄程度及斑块的稳定性是患者发生中风的重要预测性因素。高分辨磁共振成像(high-resolution MR imaging,HR-MRI)是一项成熟的检测动脉粥样硬化管壁结构及斑块成分的技术。自2001年Yuan等[1]利用颈动脉内膜剥脱术对患者的斑块进行术前影像与术后病理对比,得到斑块的信号特征与病理组织高度一致的结果后,近年有诸多研究报道HR-MRI在活体内识别颈动脉斑块成分具有较高的敏感性和特异性[2-3]。国内外基于颅内血管重度狭窄重构模式、斑块成分研究屡见不鲜,但对于轻中度狭窄血管重构模式与斑块易损性的研究尚鲜有报道。本研究旨在运用HR-MRI探讨轻中度血管狭窄重构模式,以及重构模式与斑块易损性之间的关系,揭示早期血管重构与斑块易损性在缺血性脑卒中事件发生、发展中的作用。
1 资料与方法 1.1 一般资料收集本院2015年12月至2016年12月住院及门诊颈性短暂性脑缺血发作(transient ischemic attack,TIA)或缺血性脑卒中患者。纳入标准:② 年龄18~75岁;② 经超声诊断颈动脉粥样硬化斑块病变者,且斑块最厚处厚度(≥2 mm);③ CTA或DSA证实颈动脉粥样硬化,且血管狭窄程度呈轻中度患者,血管程度分级参照北美颈内动脉内膜切除术(NASCET)标准。排除标准:① 非动脉粥样硬化性病变引起的颈动脉狭窄;② 心源性栓塞、血管炎、烟雾病等导致的脑血管事件;③ 有MRI检查禁忌证以及由于任何原因导致无法承受或配合MRI检查者。共纳入患者32例,其中男性28例,女性4例;年龄45~72(59±8) 岁。排除3例患者,其中1例由于图像质量欠佳,无法准确评估;另2例患者虽然超声提示斑块,但是磁共振扫描图像未发现斑块。本研究经本院伦理道德委员会审核批准,受试者均签署知情同意书。
1.2 仪器与方法患者均于发病时间窗 < 45 d内进行颈动脉斑块高分辨磁共振扫描,采用德国Siemens Trio 3.0T MRI磁共振扫描仪和颈部表面专用8通道线圈(上海辰光颈部线圈)。① 首先用3D Multislab TOF-MRA iPAT扫描检查:TR 20.00 ms,TE 4.17 ms翻转角(flip angle,FA)25°,视野(FOV)16 cm×16 cm,矩阵256×256,层厚1.0 mm,激励次数(NEX)1,耗时约1 min。该序列可生成直观的立体图像便于后续扫描的定位,后续扫描定位于颈总动脉分叉处,采集颈动脉分叉处上下2 cm图像。② T2WI:扫描序列用快速自旋回波(turbo spin echo,TSE)序列,TR 2500.00 ms,TE 74.00 ms,FOV 16 cm×16 cm,矩阵256×256,层厚2.0 mm,NEX 2。③ 质子密度加权成像(proton density-weighted imaging,PDWI):利用TSE序列,TR 2 000.00 ms,TE 15.00 ms,FOV 16 cm×16 cm,矩阵256×256,层厚2.0 mm,NEX 2。④ T1WI:利用双反转恢复TSE黑血序列,TR 1090.00 ms,TE 26.00 ms,FOV 16 cm×16 cm,矩阵256×256,层厚2.0 mm,NEX 2。⑤ 采集3D Multislab TOF-MRA:TR23.00 ms,TE 4.30,FOV 16 cm×16 cm,矩阵256×256,层厚2.0 mm,NEX 3,耗时约4 min。T2WI、PDWI、T1WI利用压脂技术抑制皮下脂肪的信号。
1.3 图像后处理及分析由本科两位高级职称医师采用双盲法独立观察黑血序列图像及3D-TOF-MRA图像,观察颈部血管的狭窄程度、重构模式及斑块的成分,判别斑块是否稳定。图像数据在siemens后处理工作站测量并计算斑块形态学参数。包括斑块最厚处、远端及近端参考点的血管总管腔面积(total lumen area,TLA)、管腔面积(lumen area,LA),参考点的测值[4]=(相对正常的近心端+相对正常的远心端)/2,管壁面积(wall area,WA)=TVL-LA,标准化管壁指数(normalized wall index,NWI)=管壁面积/总血管面积,斑块大小(plague size,PS)=斑块最厚处WA-正常参考值WA,斑块负荷(percent plague burden,PB)=PS/斑块最厚处TVL×100%,重构指数(remodeling index,RI)=斑块最厚处TVL/正常参考值TVL。
根据RI值分为正性重构(positive remodeling,PR)[5]组(RI≥1.05) 和非正性重构(non-PR)组(RI < 1.05)。
1.4 统计学分析采用SPSS 19.0统计学软件,计量资料以x±s表示,采用独立样本t检验;重构模式与斑块易损性的相关性采用卡方检验或Fisher确切概率法分析。P < 0.05表示差异有统计学意义。
2 结果 2.1 两组斑块高分辨磁共振成像分析32例患者共检出55个斑块,其中正性重构39个(70.9%),非正性重构16个(29.1%),HR-MRI斑块图像见图 1。经独立样本t检验,正性重构组和非正性重构组在总管腔、管壁面积、管壁标准化指数差异无统计学意义(P > 0.05),正性重构组斑块负荷、斑块大小显著高于非正性重构组(P < 0.001),见表 1。
| 组别 | n | 参考点总管腔面积(mm2) | 参考点管腔面积(mm2) | 最厚处总管腔面积(mm2) | 最厚处管腔面积(mm2) | 最厚处管壁面积(mm2) | 管壁标准化指数 | 斑块大小(mm2) | 斑块负荷 | 重构指数 |
| 正性重构组 | 39 | 70.31±4.25 | 35.71±2.68 | 88.33±4.79 | 30.42±2.82 | 57.91±2.41 | 0.68±0.02 | 23.31±1.66 | 0.28±0.02 | 1.29±0.03 |
| 非正性重构组 | 16 | 85.09±8.74 | 39.72±4.30 | 83.10±8.85 | 29.17±3.62 | 53.93±5.60 | 0.66±0.02 | 8.56±1.32 | 0.11±0.02 | 0.98±0.02 |
| t值 | 1.706 | 0.790 | 0.558 | 0.250 | 0.768 | 0.682 | 5.384 | 5.594 | 8.648 | |
| P值 | 0.094 | 0.428 | 0.415 | 0.803 | 0.446 | 0.498 | < 0.001 | < 0.001 | < 0.001 |
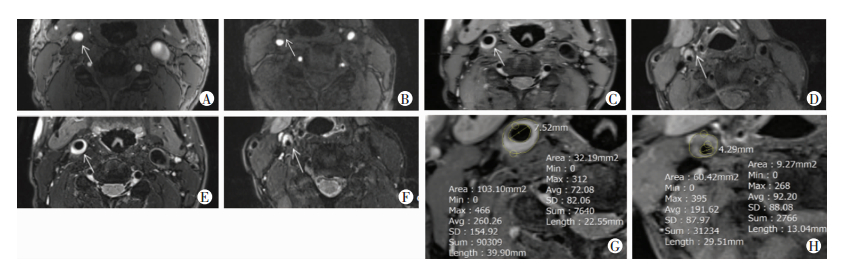
|
| A~D:正性重构;A:MRA示右侧颈总动脉充盈缺损,管壁增厚(箭头示);B、C:T1和T2示管壁环状高信号影,提示斑块内出血;D:右侧颈动脉斑块最厚层面测量,RI=1.20;E~H:非正性重构;E:MRA示右侧颈总动脉充盈缺损,管壁偏心性增厚,信号不均匀;F、G:T1和T2示管壁新月形高信号影,其内见脂质沉积和钙化;H:右侧颈动脉斑块最厚层面测量,RI=0.84 图 1 轻中度血管狭窄正性重构和非正性重构HR-MRI斑块图像 |
2.2 重构模式与斑块易损性发生率相关性分析
55个斑块,经两位高级职称医师诊断易损斑块20个(36.4%),稳定斑块35个(63.6%),见表 2。正性重构和非正性重构组在易损斑块发生率差异无统计学意义(χ2=0.532,P=0.446)。
3 讨论
颈动脉是动脉粥样硬化最早累及的位置,而动脉粥样硬化是导致缺血性脑卒中发生最主要的危险因素[7]。缺血性脑卒中发病率逐年递增,世界卫生组织报道,每6个人中就有1人在一生中会经历1次脑卒中,而我国以每年8.7%的速率上升,发病者约30%死亡,生存者抑或伴有偏瘫、失语等残障[6],生活质量明显下降。脑卒中病因按照TOAST分型,分为:① 大动脉粥样硬化性卒中;② 心源性脑栓塞;③ 小动脉闭塞性卒中或腔隙性脑梗死;④ 其他原因所致的缺血性卒中;⑤ 不明原因的缺血性卒中。其中大血管动脉粥样硬化型占脑卒中的52%左右[7]。部分基于血管狭窄程度≥50%的研究报道,在症状性及非症状性缺血性脑卒中患者中,正性重构在症状性患者中更为显著,并且症状性缺血性脑卒中患者卒中再发的风险也较高[8]。另一部分基于颅内无血管狭窄症状性缺血脑卒中患者的研究发现,症状性无血管狭窄的患者较正常人的重构指数存在差异,且以正性重构为主[9]。本研究结果显示,在症状性缺血性脑卒中患者中,轻中度血管狭窄的重构模式主要以正性重构为主,可能是由于动脉血管早期为了保证血流通畅的代偿表现,是病理生理学的正常反应。由于正性重构可以维持血管通畅或减轻斑块所致的狭窄效应,如果只看血管狭窄程度会漏掉很多重要信息。正性重构组较非正性重构组斑块大小、斑块负荷更大。这可能是由于早期血管重构模式建立,刺激斑块成分发生反复破损修复,纤维帽、脂质、坏死核心沉积导致斑块的负荷及大小增长。因此,在动脉粥样硬化所致的症状性缺血性脑卒中患者中,正性重构是导致缺血性脑卒中事件发生的独立危险因素之一。这些发现与在文献[10-11]报道在冠状动脉、颅内血管动脉粥样硬化的研究一致。
易损斑块(vulerableplague,VP)在高分辨磁共振成像影像上表现为斑块的信号强度是斑块同侧胸锁乳突肌信号强度的1.5倍[12],还包括斑块内出血(intra-plaquehemorrhage,IPH)、脂质成分( > 40%)、薄纤维帽及斑块破裂。在冠状动脉、颈总动脉、肾动脉、髂动脉以及下肢动脉都存在正性重构效应,而且重构效应在冠状动脉更为明显,正性重构的斑块更容易破裂,与急性冠脉综合征关系很密切。本研究显示,轻中度血管狭窄重构模式与斑块易损性的相关性分析差异无统计学意义。可能是由于轻中度血管狭窄的颈动脉粥样硬化在早期缺血性脑卒事件的发生、发展过程中,血管狭窄程度不是主要的危险因素,狭窄程度与斑块易损性不成正比,狭窄程度低不代表斑块就稳定,斑块的稳定性是由斑块自身的成分决定的,斑块自身成分的变化在缺血性脑卒中事件中扮演着至关重要的角色,而非斑块间接导致的血管狭窄所致,尤其是斑块内出血[13]。本研究发现有4个斑块内出血,血管狭窄程度不到30%,且患者都表现为责任斑块同侧急性脑梗死或TIA,由此可见,斑块内出血与临床缺血脑卒中事件发生密切相关,并且已得到大量病理证实,部分研究报道支撑斑块内出血是脑卒中发生的独立危险因素,斑块内出血在斑块的生长发展中起着中间桥梁的作用[14]。研究发现,超过20%的症状性轻度狭窄的颈动脉存在易损斑块,血管的狭窄程度与斑块的易损性还是存在一定的关系,随着狭窄程度的加重,诱发斑块的成分将发生更加复杂多样的变化,斑块内出血、脂质沉积厚度、纤维帽的破裂等发生率也显著增高[15-16]
综上所述,轻中度颈动脉血管狭窄患者血管重构模式以正性重构为主,早期血管狭窄的正性重构是一种代偿,正性重构与斑块稳定性不成正相关,斑块成分自身的演变是导致斑块易损的决定性要素,进而导致缺血性脑卒中事件的发生。本研究存在一定的局限性:样本量较少,斑块类别判定比较单一,缺乏活体相对应的病理标本;在高分辨磁共振图像上采用的是手动测量定量的数值,在测定血管远端与近端的参考值管壁有可能也是发生了动脉硬化的,可能导致在计算重构指数时值不准确;本研究是一个横断面研究,颈动脉粥样硬化呈动态进展与消退的过程,还缺乏纵向研究进一步的开展。
| [1] | ZHANG S, HATSUKAMI T S, POLISSAR N L, et al. Comparison of carotid vessel wall area measurements using three different contrast-weighted black blood MR imaging techniques[J]. Magn Reson Imaging, 2001, 19(6): 795–802. DOI:10.1016/s0730-725x(01)00408-8 |
| [2] | N RENBERG D, EBERSBERGER H U, DIEDERICHS G, et al. Molecular magnetic resonance imaging of atherosclerotic vessel wall disease[J]. Eur Radiol, 2016, 26(3): 910–920. DOI:10.1007/s00330-015-3881-2 |
| [3] |
宋昌鹏, 王德昭, 胡宏宇, 等. 3.0T高分辨率磁共振评价冠状动脉粥样硬化患者的颈动脉斑块特征[J].
中华心血管病杂志, 2016, 44(1): 38–42.
SONG C P, WANG D Z, HU H Y, et al. Carotid plaque characteristics detected with 3.0T high resolution nuclear magnetic resonance imaging in patients with coronary artery disease[J]. Chin J Cardiovasc, 2016, 44(1): 38–42. DOI:10.3760/cma.j.issn.0253-3758.2016.01.009 |
| [4] | MA N, JIANG W J, LOU X, et al. Arterial remodeling of advanced basilar atherosclerosis: a 3-tesla MRI study[J]. Neurology, 2010, 75(3): 253–258. DOI:10.1212/WNL.0b013e3181e8e714 |
| [5] | QIAO Y, ANWAR Z, INTRAPIROMKUL J, et al. Patterns and Implications of Intracranial Arterial Remodeling in Stroke Patients[J]. Stroke, 2016, 47(2): 434–440. DOI:10.1161/STROKEAHA.115.009955 |
| [6] | WANG Z, HU S, SANG S, et al. Age-Period-Cohort Analysis of Stroke Mortality in China: Data From the Global Burden of Disease Study 2013[J]. Stroke, 2017, 48(2): 271–275. DOI:10.1161/STROKEAHA.116.015031 |
| [7] | HEDNA V S, BODHIT A N, ANSARI S, et al. Hemispheric Differences in Ischemic Stroke: Is Left-Hemisphere Stroke More Common?[J]. Journal of Clinical Neurology, 2013, 9(2): 97–102. DOI:10.3988/jcn.2013.9.2.97 |
| [8] | STR MBERG S, NORDANSTIG A, BENTZEL T, et al. Risk of early recurrent stroke in symptomatic carotid stenosis[J]. Eur J Vasc Endovasc Surg, 2015, 61(2): 137–144. DOI:10.1016/j.ejvs.2014.11.004 |
| [9] | LEE W J, CHOI H S, JANG J, et al. Non-stenotic intracranial arteries have atherosclerotic changes in acute ischemic stroke patients: a 3T MRI study[J]. Neuroradiology, 2015, 57(10): 1007–1013. DOI:10.1007/s00234-015-1566-9 |
| [10] | VARNAVA A M, MILLS P G, DAVIES M J. Relationship between coronary artery remodeling and plaque vulnerability[J]. Circulation, 2002, 105(8): 939–943. DOI:10.1161/hc0802.104327 |
| [11] | CHUNG J W, BANG O Y, LEE M J, et al. Echoing Plaque Activity of the Coronary and Intracranial Arteries in Patients With Stroke[J]. Stroke, 2016, 47(6): 1527–1533. DOI:10.1161/STROKEAHA.116.013122 |
| [12] | PHAM T A, HUA N, PHINIKARIDOU A, et al. Early in vivo discrimination of vulnerable atherosclerotic plaques that disrupt: A serial MRI study[J]. Atherosclerosis, 2016, 244: 101–107. DOI:10.1016/j.atherosclerosis.2015.11.013 |
| [13] | SUN J, LIU J, BALU N, et al. Dynamic changes in MR signals of intraplague hemorrhage are strongly correlated with plaque progression: A serial imaging study on carotid atherosclerosis[J]. Atherosclerosis, 2016, 252: e255. DOI:10.1016/j.atherosclerosis.2016.07.072 |
| [14] | SUN J, LIU J, BALU N, et al. Intraplaque Hemorrhage-induced Atherosclerotic Plaque Progression as the Bridge Between Intact and Ulcerated Plaques: An Imaging-based Natural History Study[J]. Cortex, 2015, 29(1): 161–166. |
| [15] | ZHAO X, UNDERHILL H R, ZHAO Q, et al. Discriminating carotid atherosclerotic lesion severity by luminal stenosis and plaque burden: a comparison utilizing high-resolution magnetic resonance imaging at 3.0 Tesla[J]. Stroke, 2011, 42(2): 347–353. DOI:10.1161/STROKEAHA.110.597328 |
| [16] | SAAM T, SCHOENBERG S O, HATSUKAMI T S, et al. High-resolution magnetic resonance imaging of carotid atherosclerotic plaque[J]. Rofo, 2008, 180(2): 100–111. DOI:10.1055/s-2007-963666 |



