2. 400038 重庆,第三军医大学基础医学部生物化学与分子生物学教研室
2. Department of Biochemistry and Molecular Biology, College of Basic Medical Sciences, Third Military Medical University, Chongqing, 400038, China
近年来,乳腺癌高居女性新发肿瘤的第二位,严重威胁女性身心健康,影响其生活质量[1]。现阶段,除外科手术切除局部肿块之外,内分泌治疗、放疗、化疗以及生物治疗是常用的手段。内分泌治疗主要针对激素受体阳性的乳腺癌患者;曲妥珠单抗治疗是靶向人类表皮生长因子受体2(human epidermal growth factor receptor 2, HER2),主要针对HER2阳性的乳腺癌患者;而既不表达雌、孕激素受体,也不表达HER2的类型,称为三阴性乳腺癌,预后较差,现阶段药物治疗主要采用化疗[2]。以顺铂(cisplatin,DDP)为代表性的铂类药物是化疗常用的药物之一,但因其耐药性影响疗效,而提高剂量又会带来严重的副作用。因此,针对目前三阴性乳腺癌治疗尚无特异靶向药物的现状,设法寻找能提高乳腺癌细胞对经典药物(如DDP)敏感性的有效措施,具有重要的临床价值。
乳酸菌是人体正常的菌群,在肠道、阴道等器官定植,对人体有益。研究发现乳酸菌具有抗肿瘤、抗细菌、调节免疫等有益功效[3]。乳酸菌被证实可抑制宫颈癌细胞的增殖与转移[4];Fukui等[5]在结肠癌模型小鼠中发现,与安慰剂喂养组比较,乳酸菌喂养组明显降低肿瘤的发生率;Azam等[6]发现,乳酸菌培养上清液(lactobacilli supernatants,LS)可下调Piwil2基因在乳腺癌细胞的表达。Piwil2基因是癌-睾丸基因家族中的一员,被证实有修复DNA损伤的能力。因为DDP的作用机制与破坏癌细胞的DNA复制机制有关,故本实验探究LS能否通过下调Piwil2基因来增强乳腺癌细胞对DDP的敏感性,为开发顺铂的增敏药物积累研究资料。
1 材料与方法 1.1 材料MDA-MB-231三阴性乳腺癌细胞系由第三军医大学基础医学部生物化学与分子生物学教研室冻存。DMEM高糖培养基、胎牛血清、非必需氨基酸(NEAA)、胰酶(美国HyClone公司),DDP、二甲基亚砜(DMSO)试剂(美国Sigma公司),cockrail蛋白酶抑制剂(瑞士Roche公司),MRS(de Man, Rogosa and Sharp)培养基(中国广东环凯公司),技术琼脂粉(广东环凯公司),Cell Counting Kit-8(CCK-8) 试剂(日本Dojindo公司),RIPA裂解液、SDS-PAGE凝胶配制试剂盒、BCA浓度测定试剂盒、青霉素-链霉素(双抗)试剂(中国上海碧云天公司),ECL显色试剂盒(美国Thermo公司),Piwil2抗体(北京博奥森公司),Tubulin抗体、PBS试剂、山羊抗兔抗体(北京中杉公司),Lipofectamin 2000(美国Invitrogen公司),OPTI-MEM(美国Gibco公司),siNC、Piwil2 siRNA(中国莱博斯生物公司),siRNA-1(5′→3′):GGAACUGUGGUAGAUCAUAtt,siRNA-2(5′→3′):GGAUGAGUGUACAAGCUUtt。
1.2 方法 1.2.1 细胞培养MDA-MB-231细胞采用常规培养。培养基为1%NEAA、1%双抗、10%胎牛血清、88%DMEM培养基。细胞置于5%CO2、37 ℃细胞培养箱培养。当细胞处于对数生长期时,进行传代。
1.2.2 乳酸菌培养用MRS培养基分离培养市售酸奶(伊利乳业)中保加利亚乳酸杆菌。MRS粉末中加入28%琼脂,溶于蒸馏水中,分装,121 ℃高压灭菌15~20 min,冷却倒平板备用。用灭菌双蒸水稀释酸奶,用划线法分离培养乳酸菌,置于42 ℃培养箱内24 h。次日挑取划线上单个菌落,用灭菌双蒸水稀释,选取显微镜下杆状的乳酸菌,连续3次划线分离、培养、纯化。MRS粉末溶于蒸馏水中,分装,121 ℃高压灭菌15~20 min,制成MRS肉汤培养基。将纯化的乳酸杆菌培养在MRS肉汤培养基中,42 ℃培养24 h,置于4 ℃保存。
1.2.3 乳酸菌培养上清液提取取少量含乳酸杆菌的MRS肉汤,加入新鲜的MRS肉汤,42 ℃振荡培养24 h。而后将含乳酸菌的MRS培养基离心(4 ℃,1 100×g,15 min)。取上清液,用0.22 μm的滤膜过滤残留的细菌和杂质,待用。测得LS的pH值为4.0± 0.2,新鲜的MRS肉汤培养基作为阴性对照,pH值为6.0±0.2,故用酸调pH值至4.0。
1.2.4 siRNA转染实验按照Lipofectamine2000转染试剂说明书方法,转染前24 h,铺48孔板和6孔板,接种于不含双抗的DMEM培养基中,细胞汇合度在50%左右。转染时先用OPTI-MEM培养基稀释转染试剂和siRNA(48孔板:每孔siRNA 10 pmol、转染试剂0.5 μL,6孔板:每孔siRNA 100 pmol、转染试剂5 μL),室温孵育5 min,再混合稀释后的转染试剂和siRNA(总体积,48孔板:每孔25 μL,6孔板:每孔250 μL),siNC作为阴性对照与siRNA相同处理,室温孵育20 min。而后将混合液加入48孔板和6孔板中,6 h后更换新鲜培养基。
1.2.5 细胞增殖与活性检测用胰酶消化处于对数生长期的MDA-MB-231细胞,铺96孔板或48孔板,其中96孔板每孔约铺3 000个细胞,48孔板每孔约铺6 000个细胞,设置3个以上复孔。96孔板分别用不同浓度DDP(0、1、2、3、4、5 μg/mL)、LS(体积分数分别为1%、5%、10%、20%,下同)、2 μg/mL DDP联合不同浓度LS(1%、5%、10%、20%)处理细胞24 h。以DMSO处理的样品作为DDP浓度为0时的对照组(下同),以同浓度MRS处理样品作为LS的对照组。48孔板转染后用2 μg/mL DDP处理细胞24 h。加入处理结束之后,用PBS缓冲液洗1遍,弃PBS,再按CCK-8试剂说明书方法,在DMEM培养基中以10 :1的比例加入CCK-8溶液,而后在96孔板每孔中加入110 μL,在48孔板中加入220 μL,在37 ℃下孵育1~3 h,再用酶标仪测定光密度值[D(450)]。
1.2.6 Western blot检测Piwil2表达MDA-MB-231细胞接种于6孔板,每孔2×105个细胞,培养24 h后,加入处理[不同浓度DDP:0、1、2、3、4、5 μg/mL,转染siRNA,不同浓度LS:0、1%、5%、10%、15%、20%,单用2 μg/mL DDP(加入20% MRS作为LS的阴性对照)以及联合20% LS,处理时间均为24 h]后的细胞,提取细胞总蛋白,Bradford法测蛋白浓度。10% SDS-PAGE,上样量30 μL,半干转PVDF膜(23 V,0.5 h),PVDF膜用5%脱脂奶粉37 ℃封闭1 h,再用兔抗人Piwil2多抗(1 :300)4 ℃孵育过夜,PBST洗膜3次,每次10 min,山羊抗兔抗体(1 :5 000)37 ℃温孵育1 h,PBST洗膜3次,每次10 min。Tubulin作为内参。将PVDF膜置于显影液内,在伯乐成像系统(ChemiDoc Touch)中曝光并进行图像分析。
1.3 统计学分析采用SPSS 13.0统计软件,计量数据以x±s表示,两组比较采用独立样本t检验,多组比较采用单因素方差分析。检验水准:α=0.05。
2 结果 2.1 不同浓度DDP对MDA-MB-231细胞增殖的影响当DDP浓度≤2 μg/mL时,与对照组比较,DDP对细胞增殖的影响差异无统计学意义。当DDP浓度≥3 μg/mL时,与对照组比较,DDP能明显抑制细胞的增殖,差异有统计学意义(P < 0.05,图 1)。提示DDP浓度≤2 μg/mL时,细胞对DDP不敏感。故后续实验以2 μg/mL DPP作为DPP敏感性观察的浓度。

|
| a:P < 0.05,与对照组(0 μg/mL)比较 图 1 CCK-8检测不同浓度DDP对MDA-MB-231细胞增殖的影响 |
2.2 DDP处理对MDA-MB-231细胞Piwil2表达的影响
与对照组比较,不同浓度的DDP处理组Piwil2蛋白表达均显著增高(P < 0.05),并以剂量依赖方式增加Piwil2蛋白的表达(图 2)。结果提示:Piwil2的高表达可能参与DDP对细胞损伤的修复,从而影响DDP的敏感性。
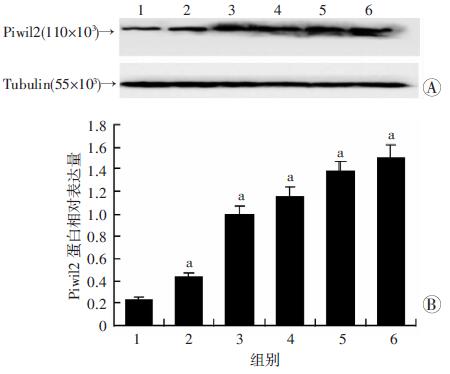
|
| A:Western blot检测结果1:对照组;2~6:不同浓度DDP处理组(1、2、3、4、5 μg/mL);B:半定量分析 a:P < 0.05,与对照组(0 μg/mL)比较 图 2 Western blot检测不同浓度DDP对MDA-MB-231细胞Piwil2蛋白表达的影响 |
2.3 siRNA沉默Piwil2基因的表达对MDA-MB-231细胞DDP敏感性的影响
Piwil2基因的siRNA-1与siRNA-2分别转染细胞后,均能有效沉默细胞中Piwil2基因的表达(图 3A)。该基因沉默前与沉默后,分别用2 μg/mL的DDP处理,采用CCK-8检测DDP对细胞增殖抑制的变化;与对照组比较,沉默Piwil2基因能显著增加细胞对DDP的敏感性,差异有统计学意义(P < 0.05,图 3B)。提示沉默Piwil2基因可恢复乳腺癌细胞对2 μg/mL DDP的敏感性。
|
| 1:对照组;2:siRNA-1组;3:siRNA-2组 A:Western blot检测siRNA对MDA-MB-231细胞Piwil2基因表达的沉默效应;B:CCK-8检测Piwil2基因沉默前与沉默后2 μg/mL DDP对MDA-MB-231细胞增殖的影响 a:P < 0.05,与对照组比较 图 3 siRNA沉默Piwil2基因的表达对MDA-MB-231细胞DDP敏感性的影响 |
2.4 LS处理MDA-MB-231细胞对Piwil2基因表达的影响
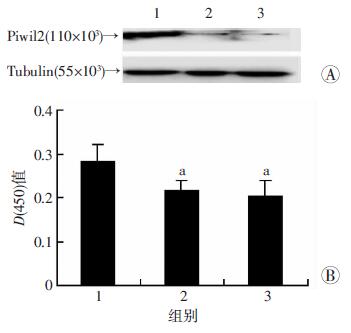
采用Western blot检测不同浓度LS处理细胞后Piwil2蛋白的表达(图 4)。与MRS组比较,5%~20% LS处理后,均可下调细胞中Piwil2基因的表达,且随着LS浓度的增加,Piwil2表达呈现剂量依赖性减少。提示LS可剂量依赖性下调细胞Piwil2蛋白的表达。
|
| 1~4:分别为1%、5%、10%、20% LS处理组;5:20%MRS组; a:P < 0.05,与20%MRS组比较A:Western blot检测Piwil2蛋白的表达;B:半定量分析 图 4 Western blot检测不同浓度LS对Piwil2蛋白表达的影响 |
2.5 LS对MDA-MB-231细胞增殖的影响
不同浓度LS处理细胞,考察LS与MRS是否对乳腺癌细胞增殖有影响。虽然随着浓度增加,pH值不可避免地降低,尤其在高浓度(20%)时,会一定程度影响乳腺癌细胞增殖,但相同浓度MRS与LS比较,差异无统计学意义(P > 0.05,图 5)。提示LS本身并不影响乳腺癌细胞的增殖。
|
| 1~4:分别为1%、5%、10%、20%浓度组 图 5 CCK-8检测不同浓度LS对MDA-MB-231细胞增殖的影响 |
2.6 DDP联合LS对MDA-MB-231细胞Piwil2蛋白表达和增殖抑制的影响
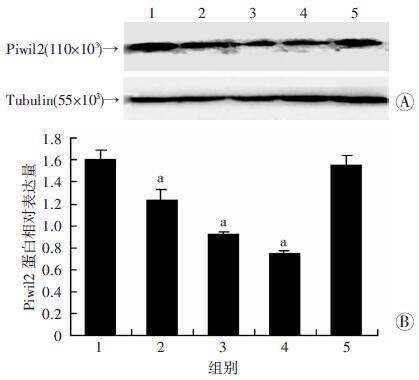
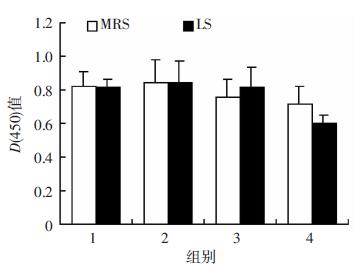
采用2 μg/mL DDP联合不同浓度LS处理细胞。虽然随着LS和MRS浓度增加,pH值逐渐降低,DDP联合不同浓度(1%、5%、10%)LS组和MRS处理组中细胞的增殖受到抑制,但LS组和MRS组间比较差异无统计学意义(P > 0.05)。当LS浓度为20%时,与相同浓度MRS组(pH值相同)比较,LS联合DDP可更有效抑制乳腺癌细胞增殖,差异具有统计学意义(P < 0.05,图 6A)。提示高浓度LS可增强乳腺癌细胞对DDP的敏感性。采用Western blot检测DDP(2 μg/mL)单用以及联合20% LS处理细胞对Piwil2蛋白表达的影响,结果显示:与对照组比较,DDP可以上调Piwil2蛋白表达,LS可以下调Piwil2蛋白表达。而与DDP单药处理组比较,DDP与LS联合处理组可显著下调Piwil2蛋白表达(P < 0.05,图 6B、C)。提示LS处理增强乳腺癌细胞对DDP的敏感性是通过下调Piwil2蛋白表达实现的。

|
| A:CCK-8检测2 μg/mL DDP联合不同浓度LS对MDA-MB-231细胞增殖的影响 1~4:分别为1%、5%、10%、20% LS或MRS+2 μg/mL DDP组;a:P < 0.05,与对应浓度MRS+2 μg/mL DDP组比较;B、C:Western blot检测2 μg/mL DDP单独或联合20% LS处理MDA-MB-231细胞后Piwil2蛋白的表达及半定量分析 1:20%MRS组;2:20%MRS+2 μg/mL DDP组;3:20% LS组;4:2 μg/mL DDP+20% LS组;a:P < 0.05,与对照(20%MRS)组比较;b:P < 0.05,与20%MRS+2 μg/mL DDP组比较 图 6 DDP联合LS对MDA-MB-231细胞Piwil2蛋白表达和增殖抑制的影响 |
3 讨论
化疗对于三阴性乳腺癌患者是不可缺少的治疗手段[7],与其他化疗药物比较,DDP在三阴性乳腺癌治疗中可能更有效,但其耐药性制约其临床疗效。因此,研究并阐明DDP在乳腺癌特别是三阴性乳腺癌中的耐药机制具有重要意义。MDA-MB-231细胞系是经典的三阴性乳腺癌细胞模型,不表达雌激素受体、孕激素受体和HER2,故通常选其作为三阴性乳腺癌细胞体外实验的研究对象[8]。
Piwil2基因是癌睾基因家族的一员,其表达的异常与肿瘤具有密切联系。研究显示Piwil2与干细胞自我更新、RNA沉默、转录调控相关[10-11],在90%的浸润性癌和81%原位癌中可检测到其表达[12]。近年研究发现,Piwil2还与DNA的损伤修复有关[12]。DDP的作用机理是导致肿瘤细胞内DNA链内交链,抑制其DNA复制,从而杀灭肿瘤细胞。为抵抗和逃避DDP的杀伤效应,肿瘤细胞通常适应性地提高其DNA损伤修复能力。已有大量研究显示DNA损伤修复功能的增强是DDP耐药的主要机制之一[13]。因此,DNA损伤修复基因的表达增强常导致DDP抵抗,而下调这些基因在肿瘤细胞的表达可恢复其对DDP的敏感性。研究发现沉默Piwil2基因可增强宫颈癌细胞对DDP的敏感性[14],但Piwil2基因表达与乳腺癌细胞特别是三阴性乳腺癌细胞DDP的敏感性尚不清楚。本研究结果显示:DDP可以剂量依赖性上调MDA-MB-231细胞Piwil2蛋白的表达,而siRNA沉默Piwil2表达可增强DDP对细胞增殖的抑制效应。表明Piwil2表达的增强是影响三阴性乳腺癌细胞对DDP敏感性的重要机制之一。
乳酸菌是一种公认的益生菌,MRS肉汤培养基是乳酸菌半选择性培养基,通常用于乳酸菌作为优势菌时的分离培养。因为培养基本身的pH值较低,又有产酸的乳酸菌进一步降低pH值,由此强烈抑制其他微生物的生长。而市售酸奶通常含有保加利亚乳酸杆菌和嗜热链球菌两种乳酸菌菌种,通过镜下形态的观察易于区分杆菌和球菌,通过多次划线分离、纯化得到较纯的保加利亚乳酸杆菌。本研究结果显示:高浓度DDP(≥3 μg/mL)可以剂量依赖性抑制乳腺癌细胞的增殖,而低浓度时(≤2 μg/mL)不敏感;虽然有报道乳酸菌可抑制多种肿瘤的增殖,但LS(1%~20%)对三阴性乳腺癌细胞的增殖并无明显影响,而高浓度LS联合DDP处理却能增强三阴性乳腺癌细胞对DDP的敏感性。由于Piwil2表达的增强可导致三阴性乳腺癌细胞对DDP敏感性的降低; 且研究发现乳酸菌的代谢产物能够通过表观遗传的修饰,调控Piwil2基因的表达[15]。因此,本研究考察了LS能否通过影响Piwil2基因的表达,进而影响三阴性乳腺癌细胞对DDP敏感性。本研究结果显示:LS以剂量依赖性方式下调Piwil2蛋白的表达;与单用DDP比较,DDP联合LS处理可显著下调Piwil2蛋白的表达并抑制细胞增殖(P < 0.05),表明LS可通过下调Piwil2基因的表达增强三阴性乳腺癌细胞对DDP的敏感性。本研究结果还显示:DDP联合不同浓度LS和MRS处理组中细胞的增殖受到抑制。这可能与培养基pH值逐渐降低对细胞增殖的抑制增强有关。研究证实pH值的降低本身就会影响乳腺癌细胞的增殖[4]。因此,该结果反映的是pH值对细胞增殖的影响,而非对DDP的敏感性的改变。
综上所述,Piwil2的高表达可导致三阴性乳腺癌细胞对DDP敏感性的降低,而LS可通过下调Piwil2基因的表达增强细胞对DDP的敏感性。本研究结果为三阴性乳腺癌细胞DDP耐药提供了一个新的证据,同时,LS处理三阴性乳腺癌细胞可增强DDP的敏感性,可能是一种有效而无毒的、成本也较低廉的生物疗法。进一步研究证实其作用和机制,可为其将来批量生产和临床应用奠定基础,具有广阔而潜在的应用前景。今后的研究将进一步阐明LS降低Piwil2基因表达的分子机制;另外,因LS是其一系列代谢产物的复合物(包括胞外多糖、共轭酸、脂磷壁酸等),故需进一步分离和验证上清液中具体的有效成分。同时,本研究结果仅为体外实验,尚需进行体内实验进一步验证。
| [1] | Siegel R L, Miller K D, Jemal A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1): 7–30. DOI:10.3322/caac.21332 |
| [2] | Jiao Q, Wu A, Shao G, et al. The latest progress in research on triple negative breast cancer (TNBC): risk factors, possible therapeutic targets and prognostic markers[J]. J Thorac Dis, 2014, 6(9): 1329–1335. DOI:10.3978/j.issn.2072-1439.2014.08.13 |
| [3] | Gamallat Y, Meyiah A, Kuugbee E D, et al. Lactobacillus rhamnosus induced epithelial cell apoptosis, ameliorates inflammation and prevents colon cancer development in an animal model[J]. Biomed Pharmacother, 2016, 83: 536–541. DOI:10.1016/j.biopha.2016.07.001 |
| [4] | Nouri Z, Karami F, Neyazi N, et al. Dual anti-metastatic and anti-proliferative activity assessment of two probiotics on heLa and HT-29 cell lines[J]. Cell J, 2016, 18(2): 127–134. |
| [5] | Fukui M, Fujino T, Tsutsui K, et al. The tumor-preventing effect ofamixture of several lactic acid bacteria on 1, 2-dimethylhydrazine-induced colon carcinogenesis in mice[J]. Oncol Rep, 2001, 8(5): 1073–1078. DOI:10.3892/or.8.5.1073 |
| [6] | Azam R, Ghafouri-Fard S, Tabrizi M, et al. Lactobacillus acidophilus and Lactobacillus crispatus culture supernatants downregulate expression of cancer-testis genes in the MDA-MB-231 cell line[J]. Asian Pac J Cancer Prev, 2014, 15(10): 4255–4259. DOI:10.7314/apjcp.2014.15.10.4255 |
| [7] | Chen X, He C, Han D, et al. The predictive value of Ki-67 before neoadjuvant chemotherapy for breast cancer:asystematic review and meta-analysis[J]. Future Oncol, 2017, 13(9): 843–857. DOI:10.2217/fon-2016-0420 |
| [8] | Medina-Aguilar R, Pérez-Plasencia C, Gariglio P, et al. DNA methylation data for identification of epigenetic targets of resveratrol in triple negative breast cancer cells[J]. Data in Brief, 2017, 11: 169–182. DOI:10.1016/j.dib.2017.02.006 |
| [9] | Scanlan M J, Gure A O, Jungbluth A A, et al. Cancer/testis antigens: an expanding family of targets for cancer immunotherapy[J]. Immunol Rev, 2002, 188: 22–32. DOI:10.1034/j.1600-065X.2002.18803.x |
| [10] | Liu J J, Shen R, Chen L, et al. Piwil2 is expressed in various stages of breast cancers and has the potential to be used asanovel biomarker[J]. Int J Clin Exp Pathol, 2010, 3(4): 328–337. |
| [11] | Torkashvand S, Damavandi Z, Mirzaei B, et al. Decreased expression of bioinformatically predicted piwil2-targetting microRNAs, miR-1267 and miR-2276 in breast cancer[J]. Arch Iran Med, 2016, 19(6): 420-425. DOI:0161906/AIM.009. |
| [12] | Manakov S A, Pezic D, Marinov G K, et al. MIWI2 and MILI have differential effects on piRNA biogenesis and DNA methylation[J]. Cell Rep, 2015, 12(8): 1234–1243. DOI:10.1016/j.celrep.2015.07.036 |
| [13] | Amable L. Cisplatin resistance and opportunities for precision medicine[J]. Pharmacol Res, 2016, 106: 27–36. DOI:10.1016/j.phrs.2016.01.001 |
| [14] |
程敏. 沉默Piwil2增强子宫颈癌细胞对顺铂敏感性的机制研究[D]. 合肥: 安徽医科大学, 2013.
Chen M.The mechanisms research of silence Piwil2 enhanced cervical cancer cell sensitivity to cisplatin[D]. Hefei: Anhui Medical Univercity, 2013. |
| [15] | Kim Y, Oh S, Yun H S, et al. Cell-bound exopolysaccharide from probiotic bacteria induces autophagic cell death of tumour cells[J]. Lett Appl Microbiol, 2010, 51(2): 123–130. DOI:10.1111/j.1472-765X.2010.02859.x |



