2. 558022 贵州,黔南民族职业技术学院,计算机科学系;
3. 400042 重庆,第三军医大学大坪医院野战外科研究所第三研究室,创伤与烧伤国家重点实验室;
4. 400010 重庆,超声影像学研究所;
5. 400715 重庆,西南大学医院
2. Faculty of Computer Sscience, Qiannan Polytechnic for Nationalities, Qiannan Buyi and Miao Autonomous Prefecture, Guizhou Province, 558022;
3. State Key Laboratory of Trauma, Burns and Combined Injury, Department 3, Institute of Surgery Research, Daping Hospital, Third Military Medical University, Chongqing, 400042;
4. Institute of Ultrasound Imaging, the Second Affiliated Hospital of Chongqing Medical University, Chongqing, 400010;
5. Southwest University Hospital, Chongqing 400715, China
由于神经胶质抑制作用以及神经元缺乏内在再生潜能,成年哺乳动物脊髓轴索损伤后无法再生。已有研究阐明髓磷脂和蛋白聚糖抑制信号是限制脊髓损伤(spinal cord injury, SCI)轴突出芽和再生的关键分子机制和信号通路[1-4]。近年研究表明,对神经元的特定基因干预可调动其内在潜力以促进SCI轴突再生。MDM4-MDM2/p53限制轴突出芽和再生,其破坏后通过胰岛素样生长因子1(insulin-like growth factor -1, IGF-1) 信号激活p53启动轴突再生程序;利用MDM2/p53拮抗剂Nutlin-3a,显著增加SCI皮质脊髓束和5-羟色胺(5-hydroxytryptamine, 5-HT)下行传导束的轴突再生以及功能恢复。同时,鬼臼苦素抑制IGF-1受体后可阻止残留5-HT传导束的轴突再生和神经功能恢复[5]。表明MDM2/p53-IGF-1是神经和SCI的新再生通路,是创伤性SCI的轴突再生及神经恢复新的分子治疗靶点。但是Nutlin-3a有限的水溶性导致生物利用度差。纳米技术可使其改善药物释放动力学[6];应用纳米微球可包封、稳定和增加药物的生物利用度[7]。本实验运用生物相容性好的有机高分子材料-聚乳酸-羟基乙酸[Poly(lactic-co-glycolic acid), PLGA]为载体,拟制备Nutlin-3a-PLGA微球,探究其对SCI大鼠运动功能恢复的作用。
1 材料与方法 1.1 实验动物分组及模型制备清洁级雌性成年SD大鼠39只,体质量180~200 g,排除肢体残缺和运动异常。由第三军医大学大坪医院野战外科研究所实验动物中心提供,动物生产许可证号SCXK(渝)2012-0005。采用随机数字表法分为3组:单纯损伤组、生理盐水微球治疗组和Nutlin-3a-PLGA微球治疗组,每组12只。① 单纯损伤组:仅行T10脊髓右半横断损伤,局部未用药;② 生理盐水微球治疗组:50 μL生理盐水微球悬液,含微球1.55 mg,先用无菌微量进样器于脊髓断端部位缓慢注射一半生理盐水微球悬液,再用一块明胶海绵(2 mm×2 mm×1 mm)吸附另一半生理盐水微球悬液覆盖损伤背面;③ Nutlin-3a-PLGA微球治疗组:50 μL微球悬液,含微球1.55 mg,Nutlin-3a 117 μg,先用无菌微量进样器于脊髓断端部位缓慢注射一半Nutlin-3a-PLGA微球悬液,再用一块明胶海绵(2 mm×2 mm×1 mm)吸附另一半Nutlin-3a-PLGA微球悬液覆盖损伤背面。
手术器械置于铝制消毒盒内,交替高压蒸汽灭菌后48 h内使用。1%戊巴比妥钠50 mg/kg腹腔注射麻醉大鼠。使用理发器剃毛清洁胸椎所在区域后中线行一纵切口,暴露椎旁肌肉并分离。固定脊柱,使用咬骨钳行T9~T11背部的椎板切除术。脊髓暴露后,利用11号刀片对T10脊髓进行右侧横断,至中央管做一楔形切口,损害背外侧皮质脊髓束、背索、红核脊髓束、背外侧脊柱核以及部分网状脊髓术,见大鼠右下肢及躯体回缩扑动后右下肢瘫痪,表明脊髓右半横断损伤成功。术后常规2次/d挤压膀胱协助排尿,直至恢复排尿反射。2次/d轻揉大鼠腹部及双后肢,预防肠梗阻和压疮的发生。
1.2 主要实验仪器及试剂声振仪(VCY-500型超声波处理器, 美国Heat System)、高速分散均质机(FJ300-SH, 上海标本模型厂)、激光粒径仪(Zeta Sizer 3000HS, 英国马尔文公司)、透射电镜(H-7500, 日立Hitachi)、原子力显微镜(SPM-9700, 日本岛津)、高效液相色谱仪(LC-2010A HT, 日本岛津)、冰冻切片机(Leica CM1900, 德国)、Catwalk步态分析仪(荷兰Noldus)。
Nutlin-3a(美国TargetMol)、聚乳酸-羟基乙酸(PLGA聚合比例50:50, 济南岱罡)、三氯甲烷(重庆川东化工)、聚乙烯醇(重庆川东化工)、异丙醇(重庆川东化工)、铬化青染色液(美国Sigma)、戊巴比妥钠(德国)、多聚甲醛(国产分析纯)、PBS缓冲液(pH 7.4, 北京索莱宝)、0.9%生理盐水(湖北天圣药业)。
1.3 Nutlin-3a-PLGA微球的制备及性质检测采用单乳化法制备Nutlin-3a-PLGA微球。将100 mg PLGA与10 mg Nutlin-3a加入4 mL三氯甲烷中,充分搅拌至其完全溶解,加入适量4%聚乙烯醇(相对分子质量为30 000~70 000) 溶液,利用125 W声振仪振荡2 min,高速分散均质机均质5 min,形成水包油型乳液(O/W微球),再加入40 mL 2%异丙醇,室温下放置搅拌4 h使三氯甲烷充分挥发。经多次双蒸水洗涤、离心、收集,即可得到Nutlin-3a-PLGA微球。将制备好的Nutlin-3a-PLGA微球置于4 ℃冰箱保存备用。Nutlin-3a-PLGA微球的性质检测:① 光学显微镜和原子力显微镜对Nutlin-3a-PLGA微球进行形态学观察;② 透射电镜观察Nutlin-3a-PLGA微球的结构特点;③ 激光粒径仪检测Nutlin-3a-PLGA微球粒径大小、分布。
将制作流程中的Nutlin-3a改为0.9%生理盐水,采用相同的方法制备生理盐水微球。
1.4 Nutlin-3a载药量、包封率及体外释放量的测定 1.4.1 Nutlin-3a载药量和包封率的测定将一份样本称质量后使其溶解于0.5 mL三氯甲烷,超声振荡30 min,加入1 mL乙腈置于摇床(37 ℃,120 r/min)48 h。样本离心(25 ℃,12 000 r/min)10 min提取药物。0.2 μm多孔过滤器去掉多聚物残渣。利用流动相(0.02 mol/L磷酸二氢钾、乙腈和甲醇体积比45:35:20) 高效液相色谱法分析上清液中的药物浓度,流速1 mL/min,30 ℃。Nutlin-3a峰值在260 nm波长处测定,通过标准曲线定量。
1.4.2 载药微球体外释放累积百分率计算取2 mg样本加入1 mL 0.01 mol/L PBS缓冲液与0.1% Tween80溶液密封放入恒温震荡摇床(37 ℃,150 r/min),分别于4 h及1、3、7、10、15、20、25、30 d取0.5 mL溶液离心(25 ℃,12 000 r/min)10 min收集上清液,补充等量新鲜溶液。测出260 nm处的峰面积值,带入所得标准曲线方程后计算累积释放百分率。
1.5 脊髓组织冰冻切片铬化青染色各组分别在脊髓损伤后2、4周行Catwalk分析后各取3只T10节段脊髓,另取3只大鼠进行正常T10节段脊髓灌注取材,蔗糖梯度脱水,包埋后横断面切片,厚度为20 μm,常温下复温1 h;二甲苯Ⅰ、二甲苯Ⅱ透明各5 min;100%乙醇、90%乙醇、70%乙醇、50%乙醇脱水各2 min;双蒸水里放置2 min;铬化青染液染色10 min;双蒸水漂洗2次;0.5% NH3H2O分化10 s;双蒸水漂洗2次;50%乙醇、70%乙醇、90%乙醇、100%乙醇梯度脱水各2 min;二甲苯Ⅰ、二甲苯Ⅱ透明各5 min;中性树胶封片,光学显微镜下观察结果。Image-Pro Plus 6.0图像处理软件分析在损伤4周时右侧脊髓髓鞘密度。
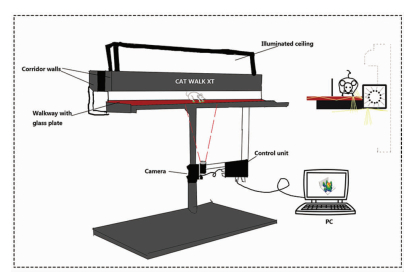
1.6 动物预适应动物干预前2周在步态分析仪玻璃板上进行适应性训练,每天3次。大鼠训练前,需将其置于黑暗环境下排泄干净。确保每只大鼠能够适应环境,连续跑动,在其停止行走或转身情况下,手动将其重新定位,直至完成整个过程。这可使大鼠在后续实验时能以恒速无停顿地通过CatWalk步态分析仪走道。CatWalk工作原理如图 1所示。
|
| 图 1 CatWalk工作原理示意图 |
Catwalk自动定量步态分析系统有封闭的走廊,大鼠可从玻璃板的一边走到另一边。采用足印照明技术?:绿灯进入玻璃板的边缘并能完全内部反射;当大鼠爪与玻璃板接触时光能够逃脱以致光散射。正对走道下方的高速摄像机捕获足印后将其转换成数字图像,并通过转换器连接到计算机。
1.7 步态分析利用CatWalk步态分析系统测量,实际操作和分析评估采用双盲法,由2名受过专业训练的实验人员执行,术前1 d记录基础数据,术后2、3、4周再进行记录分析。选取分析的参数:① 正常步序比:反映大鼠肢体间的协调性。② 站立时间:脚掌与玻璃板接触时间,与肢体功能恢复相关。③ 足印平均强度:描述行走过程中脚掌与玻璃板接触过程中产生的平均压力,在一定程度上反映步行过程中肢体的承重。④ 两后爪脚间距离(base of support,BOS):平行于大鼠运动方向,后肢足印之间的距离。⑤ 相对足印距离:垂直于大鼠运动方向,同侧前后足印之间的距离。
1.8 统计学方法采用SPSS 16.0统计软件,计量资料用x±s表示,采用单因素方差分析、重复测量的方差分析及配对t检验。P < 0.05为差异有统计学意义。
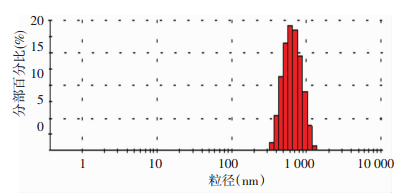
2 结果 2.1 Nutlin-3a-PLGA微球的基本性质以双蒸水溶解后,Nutlin-3a-PLGA微球外观呈乳白色,静置轻度分层。光镜及原子力显微观察显示,Nutlin-3a-PLGA微球呈球形,形态规则,大小尚均匀,分散度较好(图 2A、C、D)。透射电镜观察Nutlin-3a-PLGA微球亦呈球形,Nutlin-3a-PLGA微球直径约为600 nm,与原子力显微镜以及激光粒径仪所测粒径一致(图 2B)。激光粒径仪检测Nutlin-3a-PLGA微球直径为(671.2±187.1) nm,粒径分布窄,分散指数为0.195(图 3)。

|
| A:光学显微镜;B:透射电镜;C:原子力显微镜;D:单个微球三维形貌 图 2 制备的Nutlin-3a-PLGA微球光学显微镜、透射电镜、原子力显微镜及单个微球三维形貌观察 |
|
| 图 3 Nutlin-3a-PLGA微球粒径分布 |
2.2 Nutlin-3a包封率、载药量及体外释放量
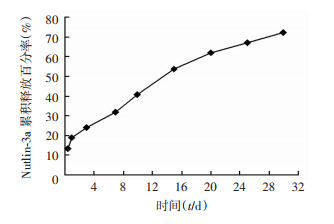
利用高效液相色谱法测得2.2 mg Nutlin-3a-PLGA微球含Nutlin-3a(93.23±3.91)μg,载药量为(7.06±0.30)%,包封率为(58.27±2.44)%,体外释放曲线如图 4所示。
|
| 图 4 体外载药微球持续释放Nutlin-3a |
2.3 铬化青染色观察
铬化青染色显示,正常大鼠髓鞘主要在脊髓白质中表达,分布均匀,排列紧密。单纯损伤组和生理盐水微球治疗组2周时损伤部位白质出现脱髓鞘,损伤周围白质髓鞘排列疏松;4周时脱髓鞘加重,明显空洞形成。Nutlin-3a-PLGA微球治疗组与单纯损伤组和生理盐水微球治疗组脱髓鞘变化趋势相同,但Nutlin-3a-PLGA微球治疗组脱髓鞘病变均较轻,髓鞘排列较为紧密(图 5)。损伤4周时单纯损伤组、生理盐水微球治疗组和Nutlin-3a-PLGA微球治疗组右侧脊髓髓鞘密度分别为1 461.44±123.46、1 347.33±114.42、1 879.46±115.41(P < 0.05)。

|
| 图 5 各组大鼠脊髓铬化青染色结果 |
2.4 Catwalk步态分析 2.4.1 正常步序比
损伤后2周大鼠可行Catwalk步态分析。正常大鼠正常步序比为(98.75±3.42)%。脊髓损伤2周后单纯损伤组、生理盐水微球治疗组和Nutlin-3a-PLGA微球治疗组正常步序比分别为(90.97± 3.42)%、(91.17±4.16)%和(94.58±3.93)%(P < 0.05,图 6A)。

|
| A:各组脊髓损伤前及术后各时间点正常步序比的变化;B:各组脊髓损伤前及术后各时间点左后肢站立时间的变化; C、D:各组脊髓损伤前及术后各时间点左、右前肢足印平均强度的变化;E、F:各组脊髓损伤前及术后各时间点左、右相对足印距离的变化; C:各组脊髓损伤前及术后各时间点后肢BOS的变化a:P < 0.05,b:p < 0.01, Nutlin-3a-PLGA微球治疗组分别与单纯损伤组、生理盐水微球治疗组进行比较;1:术前1 d; 2:损伤第2周;3:损伤第3周;4:损伤第4周 图 6 各组大鼠脊髓损伤前1 d及术后2、3、4周时间-空间参数的变化 |
2.4.2 左后肢站立时间
正常大鼠左后肢站立时间为(0.162±0.033) s,术后2周单纯损伤组、生理盐水微球治疗组和Nutlin-3a-PLGA微球治疗组分别增加为(0.189±0.014)、(0.187±0.022)、(0.170±0.017) s (P < 0.05,图 6B)。
2.4.3 足印平均强度正常大鼠左右前肢足印平均强度分别为70.99±6.05、69.18±5.53,术后2周3组均增加,但Nutlin-3a-PLGA微球治疗组与其比较均增加得较少(P < 0.05,图 6C、D);3组各时点,左、右前肢足印平均强度差异无统计学意义。
2.4.4 相对足印距离正常大鼠步行中后爪非常接近前爪,左右相对足印距离没有差异[左侧为(-1.00± 0.73) cm,右侧为(-0.84±0.80) cm, P > 0.05]。负值表明后爪位于同侧前爪的前面。术后2周两侧相对足印距离开始增加为正值,表明后爪位于相应前爪后面。术后4周单纯损伤组、生理盐水微球治疗组和Nutlin-3a-PLGA微球治疗组左侧相对足印距离分别为(10.17±6.40)、(9.75±6.92) cm和(2.85± 1.72) cm;右侧分别为(7.63±4.78)、(8.21±4.82) cm和(3.00±2.07) cm。单纯损伤组,术后2周左、右相对足印距离差异有统计学意义(P < 0.05),其他时点差异无统计学意义;其余两组各时点,左、右相对足印距离差异无统计学意义(图 6E、F)。
2.4.5 后肢BOS正常大鼠后肢BOS为(2.46±0.38) cm,术后2周单纯损伤组、生理盐水微球治疗组和Nutlin-3a-PLGA微球治疗组后肢BOS显著增加,分别为(3.68±0.99)、(3.77±0.85) cm和(3.69±0.86) cm;术后4周Nutlin-3a-PLGA微球治疗组后肢BOS降低,接近正常(图 6G)。
3 讨论有机高分子材料PLGA是由乳酸和羟基乙酸两种单体以50:50的比例聚合而成,具有良好的生物相容性和生物降解性,通过表面修饰使药物吸附、包裹或与其化学性连接作为药物输送载体,广泛应用于治疗脊髓损伤[8]。既往研究表明聚合物的相对分子质量在一定范围内和微球包封率和载药量成反比[9, 10],同时亲脂性药物容易进入分散相[11],相对分子质量为12×103的PLGA制备的Nutlin-3a微球的载药量和包封率较高,与既往研究结果[12]一致, 是理想的药物载体。另外,本实验制备的微球具有较大的表面积-体积比,可促进药物扩散;同时低分子微球溶解度较大,固化变慢,具有较多空隙,缓慢释放特性显著,对于脊髓损伤治疗尤为重要。制备的Nutlin-3a-PLGA微球在4 h的释放量约为13%,30 d时可释放70%的Nutlin-3a,释放缓慢,对脊髓损伤治疗中保持稳定药物浓度极其重要。
脱髓鞘是脊髓损伤的一个重要特点[13],是导致上行和下行轴突的感觉和运动冲动传导障碍的重要原因。脱髓鞘发生于损伤后的24 h内,并逐渐进展。3周时,许多纤维发生Wallerian变性。有证据显示在实验性脊髓损伤的晚期会发生髓鞘再生,尽管这些再生髓鞘轴突的结间体通常较短,而且髓鞘也比较细。研究证实少突胶质细胞和Schwann细胞可能参与了髓鞘再生的过程[14-15]。本实验铬化青染色结果显示,大鼠脊髓损伤后出现脱髓鞘,且髓鞘排列疏松;随病程延长,损伤程度加重。Nutlin-3a-PLGA微球治疗可缓解脱髓鞘状态,髓鞘排列较紧密。
本实验采用Catwalk步态分析,阐述了低胸髓半横断损伤大鼠术后1个月的运动恢复过程。研究发现,脊髓损伤将立即丧失后肢运动功能,仅能使用前肢移动;随后,大鼠逐渐恢复[16]。其中,正常步序比能较好地反映大鼠的运动协调性,曾较早用于评估脊髓损伤和帕金森病导致的肢体协调性下降程度[17]。脊髓右半横断损伤的大鼠,在行走过程中的脚掌先后顺序发生了变化,平常较少见模式出现的比例增多;Nutlin-3a-PLGA微球治疗后这种趋势相对有所减少,正常步序比也呈显著提高。为维持整个躯体的平衡, 术侧后肢肌力降低,导致健侧后肢代偿性的站立时间延长和前肢足印平均强度的增加;Nutlin-3a-PLGA微球治疗后这种代偿相对有所减少。
Catwalk步态分析研究结果证实半切大鼠运动功能障碍并不能恢复正常,两后爪脚间距离,左右两侧相对足印距离仍然异常。半切术后永久性运动障碍与既往观察[18-22]一致。大量脊髓后外侧半切研究将BOS作为特异性运动参数,均观察到后肢BOS增加[18, 23-27];我们的实验结果表明后肢BOS 2周后增加约40%,接着3周和4周时后肢BOS均下降,4周时较低,但Nutlin-3a-PLGA微球治疗组与单纯损伤、生理盐水微球治疗组比较显著降低。术后2周后肢BOS开始增加在于脊髓上传导信号降低所致后肢运动平衡性下降,这可能是脊髓损伤后平衡性差的反应策略。脊髓右半横断损伤也影响大鼠相对足印距离。中等速度正常大鼠通常将后脚靠近同侧前脚,这可能在于缺乏视觉控制下定位后肢更安全。正常大鼠两侧相对足印距离接近0,脊髓右半横断损伤后左右两侧相对足印距离均增加,即后脚放在前脚后面;且左右两侧相对足印距离没有差异。上述前后肢运动的分离可能为肌肉力量降低所致,这与下行脊髓束损害所致脊髓上传导信号的下降以及前后肢脊髓网络之间的联系降低相关。Nutlin-3a-PLGA微球治疗后1个月BOS和两侧相对足印距离均显著下降,表明运动功能显著恢复。
综上所述,本实验证实自制的Nutlin-3a-PLGA微球能够促进雌性SD大鼠T10脊髓右半横断损伤的运动功能恢复,但仍需要大量研究完善其药物作用的具体机制,以期为临床应用提供充分的基础实验数据。
| [1] | DI G S. Molecular targets for axon regeneration: focus on the intrinsic pathways[J]. Expert Opin Ther Targets, 2009, 13(12): 1387–1398. DOI:10.1517/14728220903307517 |
| [2] | BRADKE F, FAWCETT J W, SPIRA M E. Assembly of a new growth cone after axotomy: the precursor to axon regeneration[J]. Nat Rev Neurosci, 2012, 13(3): 183–193. DOI:10.1038/nrn3176 |
| [3] | YIU G, HE Z. Glial inhibition of CNS axon regeneration[J]. Nat Rev Neurosci, 2006, 7(8): 617–627. DOI:10.1038/nrn1956 |
| [4] | SANDVIG A, BERRY M, BARRETT L B, et al. Myelin-, reactive glia-, and scar-derived CNS axon growth inhibitors: expression, receptor signaling, and correlation with axon regeneration[J]. Glia, 2004, 46(3): 225–251. DOI:10.1002/glia.10315 |
| [5] | JOSHI Y, SóRIA M G, QUADRATO G, et al. The MDM4/MDM2-p53-IGF1 axis controls axonal regeneration, sprouting and functional recovery after CNS injury[J]. Brain, 2015, 138(Pt 7): 1843–1862. DOI:10.1093/brain/awv125 |
| [6] | FAROKHZAD O C, LANGER R. Impact of nanotechnology on drug delivery[J]. ACS Nano, 2009, 3(1): 16–20. DOI:10.1021/nn900002m |
| [7] | FAHR A, LIU X. Drug delivery strategies for poorly water-soluble drugs[J]. Expert Opin Drug Deliv, 2007, 4(4): 403–416. DOI:10.1517/17425247.4.4.403 |
| [8] | SOPPIMATH K S, AMINABHAVI T M, KULKARNI A R, et al. Biodegradable polymeric nanoparticles as drug delivery devices[J]. J Control Release, 2001, 70(1-2): 1–20. DOI:10.1016/S0168-3659(00)00339-4 |
| [9] | HAMISHEHKAR H, EMAMI J, NAJAFABADI A R, et al. The effect of formulation variables on the characteristics of insulin-loaded poly(lactic-co-glycolic acid) microspheres prepared by a single phase oil in oil solvent evaporation method[J]. Colloids Surf B Biointerfaces, 2009, 74(1): 340–349. DOI:10.1016/j.colsurfb.2009.08.003 |
| [10] | MAKINO K, NAKAJIMA T, SHIKAMURA M, et al. Efficient intracellular delivery of rifampicin to alveolar macrophages using rifampicin-loaded PLGA microspheres: effects of molecular weight and composition of PLGA on release of rifampicin[J]. Colloids Surf B Biointerfaces, 2004, 36(1): 35–42. DOI:10.1016/j.colsurfb.2004.03.018 |
| [11] | SRINIVASAN C, KATARE Y K, MUTHUKUMARAN T, et al. Effect of additives on encapsulation efficiency, stability and bioactivity of entrapped lysozyme from biodegradable polymer particles[J]. J Microencapsul, 2005, 22(2): 127–138. DOI:10.1080/02652040400026400 |
| [12] | VOLTAN R, SECCHIERO P, RUOZI B, et al. Nanoparticles engineered with rituximab and loaded with Nutlin-3 show promising therapeutic activity in B-leukemic xenografts[J]. Clin Cancer Res, 2013, 19(14): 3871–3880. DOI:10.1158/1078-0432.CCR-13-0015 |
| [13] | PAPADOPOULOS D, PHAM-DINH D, REYNOLDS R. Axon loss is responsible for chronic neurological deficit following inflammatory demyelination in the rat[J]. Exp Neurol, 2006, 197(2): 373–385. DOI:10.1016/j.expneurol.2005.10.033 |
| [14] | CHURCH J S, MILICH L M, LERCH J K, et al. E6020, a synthetic TLR4 agonist, accelerates myelin debris clearance, Schwann cell infiltration, and remyelination in the rat spinal cord[J]. Glia, 2017, 65(6): 883–899. DOI:10.1002/glia.23132 |
| [15] | ZAWADZKA M, RIVERS L E, FANCY S P, et al. CNS-resident glial progenitor/stem cells produce Schwann cells as well as oligodendrocytes during repair of CNS demyelination[J]. Cell Stem Cell, 2010, 6(6): 578–590. DOI:10.1016/j.stem.2010.04.002 |
| [16] |
李敬花, 张涛, 张红军, 等. 硫酸软骨素酶ABC联合骨髓间充质干细胞移植对脊髓损伤后神经功能的恢复作用[J].
第三军医大学学报, 2015, 37(2): 122–127.
LI J H, ZHANG T, ZHANG H J, et al. Effect of bone mesenchymal stem cell transplantation combined with chondroitinase ABC on nerve function recovery in rats after spinal cord injury[J]. J Third Mil Med Univ, 2015, 37(2): 122–127. DOI:10.16016/j.1000-5404.201407181 |
| [17] | HAMERS F P, KOOPMANS G C, JOOSTEN E A. CatWalk-assisted gait analysis in the assessment of spinal cord injury[J]. J Neurotrauma, 2006, 23(3-4): 537–548. DOI:10.1089/neu.2006.23.537 |
| [18] | REDONDO-CASTRO E, TORRES-ESPíN A, GARCíA-ALíAS G, et al. Quantitative assessment of locomotion and interlimb coordination in rats after different spinal cord injuries[J]. J Neurosci Methods, 2013, 213(2): 165–178. DOI:10.1016/j.jneumeth.2012.12.024 |
| [19] | ARVANIAN V L, SCHNELL L, LOU L, et al. Chronic spinal hemisection in rats induces a progressive decline in transmission in uninjured fibers to motoneurons[J]. Exp Neurol, 2009, 216(2): 471–480. DOI:10.1016/j.expneurol.2009.01.004 |
| [20] | CLOUD B A, BALL B G, CHEN B K, et al. Hemisection spinal cord injury in rat: the value of intraoperative somatosensory evoked potential monitoring[J]. J Neurosci Methods, 2012, 211(2): 179–184. DOI:10.1016/j.jneumeth.2012.08.024 |
| [21] | GULINO R, DIMARTINO M, CASABONA A, et al. Synaptic plasticity modulates the spontaneous recovery of locomotion after spinal cord hemisection[J]. Neurosci Res, 2007, 57(1): 148–156. DOI:10.1016/j.neures.2006.10.001 |
| [22] | WEBB A A, MUIR G D. Compensatory locomotor adjustments of rats with cervical or thoracic spinal cord hemisections[J]. J Neurotrauma, 2002, 19(2): 239–256. DOI:10.1089/08977150252806983 |
| [23] | HAMERS F P, LANKHORST A J, VAN LAAR T J, et al. Automated quantitative gait analysis during overground locomotion in the rat: its application to spinal cord contusion and transection injuries[J]. J Neurotrauma, 2001, 18(2): 187–201. DOI:10.1089/08977150150502613 |
| [24] | GARCíA-ALíAS G, PETROSYAN H A, SCHNELL L, et al. Chondroitinase ABC combined with neurotrophin NT-3 secretion and NR2D expression promotes axonal plasticity and functional recovery in rats with lateral hemisection of the spinal cord[J]. J Neurosci, 2011, 31(49): 17788–17799. DOI:10.1523/JNEUROSCI.4308-11.2011 |
| [25] | PETROSYAN H A, HUNANYAN A S, ALESSI V, et al. Neutralization of inhibitory molecule NG2 improves synaptic transmission, retrograde transport, and locomotor function after spinal cord injury in adult rats[J]. J Neurosci, 2013, 33(9): 4032–4043. DOI:10.1523/JNEUROSCI.4702-12.2013 |
| [26] | HUNANYAN A S, ALESSI V, PATEL S, et al. Alterations of action potentials and the localization of Nav1.6 sodium channels in spared axons after hemisection injury of the spinal cord in adult rats[J]. J Neurophysiol, 2011, 105(3): 1033–1044. DOI:10.1152/jn.00810.2010 |
| [27] | DEUMENS R, VAN GORP S F, BOZKURT A, et al. Motor outcome and allodynia are largely unaffected by novel olfactory ensheathing cell grafts to repair low-thoracic lesion gaps in the adult rat spinal cord[J]. Behav Brain Res, 2013, 237: 185–189. DOI:10.1016/j.bbr.2012.09.036 |



