2.400023 重庆,中国人民解放军第三二四医院检验科
2. Department of Medical Laboratory, No. 324 Hospital of PLA, Chongqing, 400023, China
芽孢杆菌是一种临床常见的条件致病菌,因病原体检出率低,所致疾病诊断困难,使其在疾病初期常常被忽略,从而导致较高的发病率和病死率[1]。目前主流的临床微生物学检验技术仍然依赖于传统的细菌培养与鉴定方法,即根据细菌培养后的酶学和生化反应特性鉴定细菌的种属。这种经典方法虽然准确但是往往所需时间较长,通常在细菌分离培养后还需要1~7 d来进行复杂的生化反应实验才能准确获取病原菌的类型[2]。而近20年来出现的包括实时荧光PCR、数字PCR、基因芯片和细菌质谱在内的分子生物学检验技术与方法虽然可以部分克服上述弊端,但仍然存在检测种类有限、设备昂贵和维护成本高等问题。因此,建立一种快速、无标记鉴定细菌的方法对于病原菌的快速诊断具有非常重要的意义。
太赫兹(Terahertz, THz)波是指频率在0.1~10 THz,波长在30~3 000 μm之间的电磁波,由于其波段位于微波和红外之间,早些年也被称为远红外射线(far-infrared rays)[3-4]。在过去很长一段时间内,由于缺乏有效辐射源和检测灵敏度较低等技术瓶颈限制,这一波段未能得到充分应用和开发,被称为“THz空隙”。近年来,得益于物理学技术的飞快发展,稳定、可靠的激发光源的出现和检测能力的大幅提高,太赫兹技术在生物、航天和通讯等领域广泛应用开来,在生物医学检测领域的研究也越发受到重视[5]。由于细菌具有体积小、吸收系数较低的特性,THz辐射可穿透整个菌体,不同细菌具有的特定结构在THz辐射下具有不同的响应,所以可通过激发细菌特有的遗传物质和蛋白质低频振动模式,获得菌体本身的THz振动光谱指纹,最终根据特有的THz振动光谱指纹得到不同细菌的太赫兹波谱表征规律[6-7]。基于此原理,可通过太赫兹技术建立一种快速高效、无需标记、无需试剂且无破坏性的探测方法,在菌株水平实现细菌的检测和鉴别。但由于目前THz生物检测技术的灵敏度较低,不能有效检测微量的生物大分子,因此,发展一种操作简便、可进行高灵敏THz生物检测的通用手段逐渐成为大家研究的焦点。
本研究旨在使用太赫兹时域光谱技术检测不同致病芽孢杆菌的太赫兹吸收光谱,来探索将太赫兹时域光谱技术应用于微生物病原学诊断的可能性。
1 材料与方法 1.1 材料与设备 1.1.1 菌株与培养基枯草芽孢杆菌ATCC6633,苏云金芽孢杆菌ATCC10792,蜡状芽孢杆菌ATCC11778,均购于中国微生物菌种查询网。
培养基配置:蛋白胨5.0 g、牛肉膏3.0 g、NaCl 5.0 g、蒸馏水1 000 mL,调至pH7.0,固体培养基添加琼脂15.0 g/L, 121.3 ℃灭菌20 min备用。
1.1.2 仪器与设备TAS7500SP太赫兹时域光谱仪购自日本Advantest公司;5424R台式离心机购自德国Eppendorf公司;PET双面胶带购自美国3M公司;ZHJH-C1112B超净工作台及ZWY-2102C恒温培养振荡器均购自上海智诚分析仪器制造有限公司;DRP-9052电热恒温培养箱购自上海森信实验仪器有限公司;生物安全1级机柜购自美国Nuaire公司;冷冻干燥器(CoolSafe110-4) 购自丹麦Lynge公司。
1.2 方法 1.2.1 样品制备芽孢杆菌冻干压片制备:标准菌株37 ℃液体培养过夜后,8 000 r/min离心5 min,弃上清, 再用PBS漂洗3次,收集细菌。-80 ℃预冷冻2 h,冷冻真空干燥18 h, 收集细菌冻干粉。随后将细菌粉与聚乙烯(PE)粉末以一定质量比例混合而成,包括1 :1混合和1 :3混合, 并在5 MPa的压力下压制5 min做成压片。压片为圆盘状,直径为13 mm,厚度为0.7~1.0 mm。对照:PE粉压片。
芽孢杆菌菌落压片的制备:将标准菌株接种于固体培养基上37 ℃培养过夜,随后将菌落从平板上刮下直接用于样品制备。检测装置为边长2.5 cm的聚乙烯垫片上贴一张中间镂空的3M双面胶纸,中间镂空部分直径15 mm,厚度0.1 mm,挑取过量菌落均匀涂抹于中间镂空圆形部分,再盖上一层聚乙烯垫片,压平,保证菌落均匀且厚度为0.1 mm。垫片均通过消毒处理。对照:不加菌落的垫片。
细菌含水量测试:分别记录细菌干燥前后的重量,计算出各自的含水量。为了获得正确的细菌含水量,每种细菌在相同的培养条件下测量10次。3种芽孢杆菌的含水量测量结果如下:枯草芽孢杆菌(82.29±0.47)%,苏云金芽孢杆菌(75.81±0.51)%,蜡状芽孢杆菌(74.56±0.55)%。以上所有涉及微生物操作均在生物安全Ⅰ级机柜进行安全处理。
1.2.2 太赫兹光谱仪检测太赫兹波本研究使用TAS7500SP太赫兹时域光谱仪进行检测。图 1演示了透射型太赫兹时域光谱(THz-TDS)系统的工作原理[8]:飞秒激光(beam laser)脉冲经过偏光分束镜分为两束。一束作为泵浦光入射到太赫兹发射器上,产生太赫兹脉冲,此脉冲被抛物面镜聚焦到要测量的样品上。另一束为探测光,它和从样品透射后载有样品信息的太赫兹电磁脉冲共线经过探测器。调整时间延迟装置,利用不同的探测光到达时间,测量太赫兹电场强度的变化量,再通过傅里叶变换,获得频域上幅度和相位的变化量; 最后信号经电流前置放大器、数字信号处理器后输入计算机,进行图像还原,最后获得THz脉冲的时域波形。
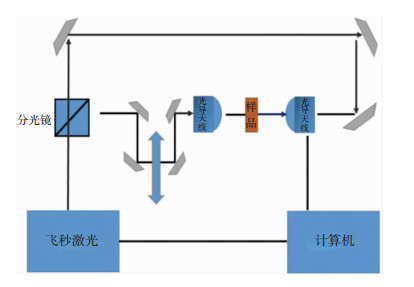
|
| 图 1 太赫兹时域光谱仪工作原理示意图 |
1.3 数据处理
3种芽孢杆菌经过THz-TDS系统测试后,获得各自的时域光谱信号,通过傅里叶变换得到频域谱,并根据样品的不同状态,进一步计算其光学参数。本研究采用Dorney和Duvillaret等人提出样品光学参数物理模型,提取三种芽孢杆菌的THz光学参数来处理测得的实验数据。
首先分别对参考信号和样品信号进行傅里叶变换,得到参考频谱信号Mr=Ar(ω)exp[-jφr(ω)]和样品频谱信号Ms=As(ω)exp[-jφs(ω)]。根据Ms/Mr=As(ω)exp[-jφs(ω)]/Ar(ω)exp[-jφr(ω)]=ρ(ω)exp[-jφ(ω)]得到ρ(ω)和φ(ω)。随后根据菲涅尔方程和光的传播方程,得到复透射函数如下:
透射系数
实验中,当样品厚度d较厚时,忽略FP(Fabry-Perot)效应,并且样品在弱吸收的情况下,样品的折射率n(ω)和吸收系数α(ω)分别表示为:
折射率
吸收系数
考虑到电介质的常数通常由吸收系数和折射率来计算,在本研究中我们直接选择吸收系数来作为太赫兹光谱鉴定细菌菌种的标准单位。采用太赫兹时域光谱系统(THz-TDS)TAS7500SP,在透射模式下进行实验。在测量过程中,为减少空气中水对太赫兹波的吸收干扰,将样品检测台密闭并通入氮气。在湿度低于2%,温度为(21.02±0.01)℃的环境下进行实验测试。
将检测获得的数据经过归一化处理后获得的结果如图 2所示: 3种芽孢杆菌在THz波段的吸收系数随着频率增加而增加,且具有不同的吸收趋势,但未发现明显的特征吸收峰。这意味着3种芽孢杆菌的分子及官能团的构成和存在状态是不同的,并随着细菌含量的增加其吸收系数增加,THz能很好地区分芽孢杆菌的不同含量。
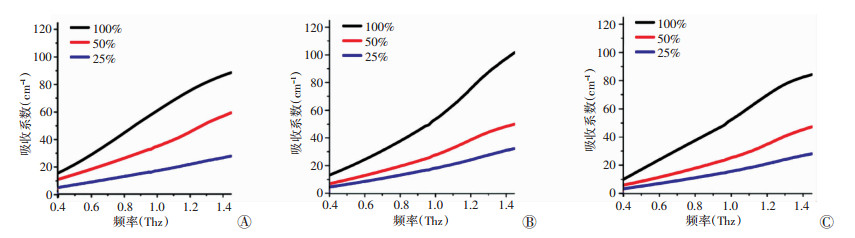
|
| A:枯草芽孢杆菌; B:蜡状芽孢杆菌; C:苏云金芽孢杆菌 图 2 3种常见致病芽孢杆菌不同含量冻干粉的吸收光谱 |
2.2 不同种类芽孢杆菌冻干粉在THz频段的吸收
此外,不同芽孢杆菌其吸收系数也存在差异。在细菌冻干粉中三种细菌的吸收系数从大到小则依次为:枯草芽孢杆菌>蜡状芽孢杆菌>苏云金芽孢杆菌(图 3)。并且在细菌冻干粉中,不同菌种之间的吸收系数均差异较小,枯草芽孢杆菌、苏云金芽孢杆菌及蜡状芽孢杆菌冻干粉之间的吸收系数区分度较小。
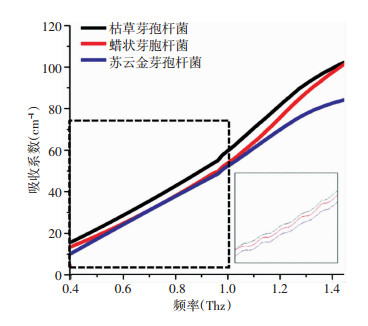
|
| 图 3 3种常见致病芽孢杆菌冻干粉的吸收光谱 |
为进一步研究样品之间的差别,我们挑选了6个不同频率,对样品在这些频率下的吸收系数做了具体比较和分析。图 4为0.4、0.6、0.8、1.0、1.2 THz和1.4 THz的吸收统计结果。统计结果为10次重复实验的平均值±标准偏差。本文采用One-way ANOVA统计分析方法,当P < 0.05时,认为有显著性差异。从图 4中我们可以看出,随着太赫兹频率的增加,3种芽孢杆菌的吸收系数也逐渐增加,不同太赫兹频率之间芽孢杆菌的吸收系数具有统计学意义(P < 0.05)。
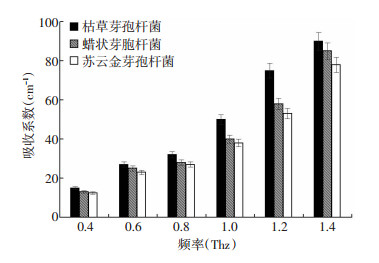
|
| 图 4 3种常见致病芽孢杆菌冻干粉的吸收光谱的统计柱状图 |
2.3 不同种类活芽孢杆菌在THz频段的吸收
图 5显示的是3种菌落在0.2~2.0 THz范围内的吸收系数。而对于菌落,吸收系数从大到小依次为:枯草芽孢杆菌>苏云金芽孢杆菌>蜡状芽孢杆菌。也即枯草芽孢杆菌无论是在菌落状态还是冻干粉状态其吸收系数均最高,而蜡状芽孢杆菌的活细胞状态下吸收系数最低。此外,将3种芽孢杆菌的冻干粉和菌落进行比较,我们进一步发现菌落的在1THz的吸收系数约为80~130 cm-1,而细菌冻干粉在此处的吸收系数则约为50 cm-1,两者相比差异十分显著。由于细菌类微生物细胞内含有大量液态水,加之THz对水非常敏感,因此我们推测菌落内所含的水对THz的检测结果有较大影响。上述不同种类细菌的检测结果也表明,与细菌干粉相比,菌落的检测结果受水含量的影响更大。由此可见,太赫兹波时域光谱技术对不同种类以及不同状态下的芽孢杆菌的差异具有较高的灵敏度,可以作为一种新型快速、高效的检测方法。
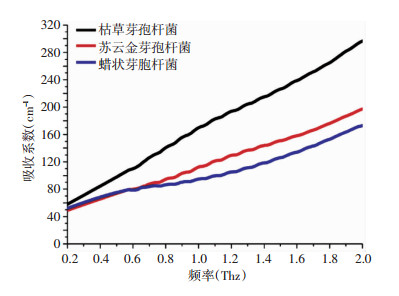
|
| 图 5 3种常见致病芽孢杆菌菌落的吸收光谱 |
为进一步研究样品之间的差别,我们挑选了10个不同频率,对样品在这些频率下的吸收系数做了具体比较和分析。图 6为0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0THz的吸收统计结果。统计结果为10次重复实验的平均值±标准偏差。本文采用One-way ANOVA统计分析方法,当P < 0.05时,认为有显著性差异。从图 4中我们可以看出,随着太赫兹频率的增加,3种芽孢杆菌的菌落吸收系数也逐渐增加,其中以枯草芽孢杆菌菌落的吸收系数增加最明显,并且不同太赫兹频率之间芽孢杆菌的吸收系数具有统计学意义(P < 0.05)。
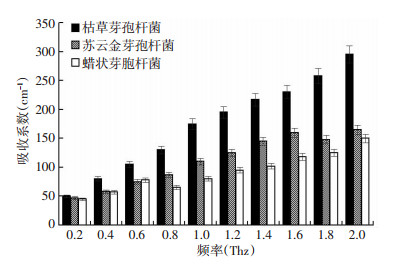
|
| 图 6 3种常见致病芽孢杆菌菌落的吸收光谱的统计柱状图 |
3 讨论
快速准确检测病原菌的类型及耐药性分析,对于战创伤感染性疾病的诊断和后续治疗至关重要。及早合理使用抗生素、救治病员、控制疫情发展、减少灾后损失、保卫国土安全等具有重要意义,是国家和军队的重大需求。由于缺乏快速和准确的诊断病原微生物的方法,具有感染性疾病的患者必须首先接受经验性抗菌治疗而不是靶向抗生素治疗。随之而来的广谱抗生素过度使用可能导致抗生素耐药以及惊人的死亡率,并限制对有效抗生素治疗的选择[9]。相反,如果能够快速检测到特定的致病原,并在患者的初始治疗当中选择针对性的抗生素治疗,其结果大相径庭。因此开发快速、可靠的病原菌检测方法是一直以来都是临床微生物学的研究热点。
我们现有的临床微生物检测方法对芽孢杆菌的检测仍然存在诸多制约因素:如无法摒除细菌培养、周期长、特异性差等问题。近年来出现的THz技术为细菌检测理论与技术的发展提供了一个良好的契机。太赫兹波由于其特殊的频率范围,THz具有在其他部分的频谱中没有的特性,使其更加适用于细菌的检测:(1) 指纹特征:THz辐射与振动、旋转、平移等低频振动模式有关。不同的细菌细胞的光谱振动模式是独特的,可以利用它们获取细菌特异的光谱指纹。获得未知的“太赫兹光谱指纹”的光谱数据,补充在红外和拉曼光谱数据库中,联合运用于细菌检测。(2) 水敏感性:极性分子如水,在整个太赫兹频率范围具有强烈的吸收。水蒸气也表现出对THz辐射有强烈的吸收,所以THz系统通常是在光路的封闭室内用氮气吹扫,使得相对湿度降低降到5%或更低后再进行测量。而液态水的吸收系数表现出依赖于频率的增加,在0.1~1 THz范围内的吸收系数大约为100 cm-1到200 cm-1,这是显着高于普通的生物大分子[10-11]。(3) 对包装材料的穿透性:由非极性分子组成的材料如纸和塑料,通常在可见光和近红外波段不透明,却很大程度上在THz波段可穿透。这个特点使安全检查更加方便,因为THz波可以穿透如信封的包装材料,无需开包即可检查。更为重要的是,THz波会是一个理想的光源[12],用于烟雾或尘埃等极端恶劣环境下的细菌检测。(4) 数据分析的方便性:不同于红外光谱,THz光谱直接提供了电场的振幅和相位。近些年来,国内外学者开始关注太赫兹波在细菌检测中的应用。最早为2004年时,约翰霍普金斯大学的MICHAEL等[13]利用傅里叶变换光谱仪测量了0.5~4 THz范围内苏云金芽孢杆菌和球芽孢杆菌两种芽孢的透射光谱,观察到芽孢内水分子吸收位置并发现两者有所区别且均与芽孢外衣成分吡啶二羧酸的特征吸收存在部分重合。弗吉尼亚大学的GLOBUS等在2004年的国际光学工程学会军事及安全领域太赫兹运用分会上首次报道了3~10 cm-1范围内草生欧文氏菌和枯草芽孢杆菌冻干细胞的透射光谱,但未对其光谱特征进行分析[14]。2012年,他们采用分辨率为0.25 cm-1的傅里叶变换光谱分析仪测量了厚度为12 μm的聚四氟乙烯垫片上的细菌悬浮液及其成分的光谱特征[15],对枯草芽孢杆菌的热处理细胞和未处理细胞进行比较,发现两者吸收曲线相似,经过热处理的细胞在10.5 cm-1具有吸收峰,而未处理细胞的吸收峰则在11.7 cm-1和13 cm-1。大肠杆菌中也出现了相似的实验结果,这可能是热变形过程中蛋白质和核酸等菌体成分发生了变性导致结构变化。热处理细胞和非处理细胞光谱差异提示未来太赫兹技术可用于检测活菌及死菌的可能。以上研究结果表明,太赫兹时域光谱技术在细菌芽孢的检测方面具有十分重要的前景。
本研究结合THz波的快速、无标记以及高灵敏度检测的优势,利用THz-TDS时域光谱技术检测并得到了几种常见致病芽孢杆菌在菌落状态下和细菌冻干粉状态下的吸收系数。我们研究发现随着频率增加3种芽孢杆菌的THz波段的吸收系数是增加的,并且有不同的吸收趋势,根据吸收系数的不同,可以区分不同的细菌。3种芽孢杆菌明显不同的平均吸收率说明太赫兹辐射波通过细菌时所产生的色散和吸收是不同的,这更有力地揭示3种样品的确具有不同的生物成分组成和结构。以后我们通过提高仪器检测灵敏度及特异性,并降低信噪比,有望对不同芽孢杆菌进行精确定性。可见,THz时域光谱技术可作为一种高灵敏度检测方法应用于芽孢杆菌的检测。
尽管THz技术显示出巨大潜在价值,但目前也存在其局限性:尚未突破THz对水敏感性的限制。生物医学样本中液态水和检测环境中的水蒸气会导致严重的THz波水吸收干扰,结果通常是在干燥状态下进行测量。然而,许多生物大分子只有在水溶液环境中才有生物活性,导致THz波段下超材料生物传感器在生物医学上实际应用遇到了瓶颈,这促使我们应着重加强研究THz技术在水相环境中的应用。随着THz光谱解析技术不断完善与成熟,进一步深入探寻生物分子间或内部与THz光谱的相互作用独特能力,结合低成本的THz系统,在不久的将来,必将广泛开展基于THz技术的细菌检测。借助THz技术独特的优势,其将在微生物检测领域发挥重要作用,并逐步走出实验室,应用到临床快速检测中,成为本世纪细菌快速无损检测的未来发展趋势。
| [1] | POUDEL P, TASHIRO Y, SAKAI K. New application of bacillus strains for optically pure L-lactic acid production: general overview and future prospects[J]. Biosci Biotechnol Biochem, 2016, 80(4): 642–654. DOI:10.1080/09168451.2015.1095069 |
| [2] | VAN BELKUM A, DURAND G, PEYRET M, et al. Rapid clinical bacteriology and its future impact[J]. Ann Lab Med, 2013, 33(1): 14–27. DOI:10.3343/alm.2013.33.1.14 |
| [3] | DABOUIS V, CHANCERELLE Y, CROUZIER D, et al. What's new in biomedical applications for Terahertz (THz) technology[J]. Med Sci (Paris), 2009, 25(8-9): 739–743. DOI:10.1051/medsci/2009258-9739 |
| [4] | SHUMYATSKY P, ALFANO R R. Terahertz sources[J]. J Biomed Opt, 2011, 16(3): 033001. DOI:10.1117/1.3554742 |
| [5] | QI N, ZHANG Z Y, XIANG Y H. Application of terahertz technology in medical testing and diagnosis[J]. Guang pu, 2013, 33(8): 2064–2070. |
| [6] | YANG X, WEI D, YAN S, et al. Rapid and label-free detection and assessment of bacteria by terahertz time-domain spectroscopy[J]. J Biophotonics, 2016, 9(10): 1050–1058. DOI:10.1002/jbio.201500270 |
| [7] | YANG X, YANG K, LUO Y, et al. Terahertz spectroscopy for bacterial detection: opportunities and challenges[J]. Appl Microbiol Biotechnol, 2016, 100(12): 5289–5299. DOI:10.1007/s00253-016-7569-6 |
| [8] | UENO Y, AJITO K. Analytical terahertz spectroscopy[J]. Anal Sci, 2008, 24(2): 185–192. DOI:10.2116/analsci.24.185 |
| [9] | VICK A, ESTRADA C A, RODRIGUEZ J M. Clinical reasoning for the infectious disease specialist: a primer to recognize cognitive biases[J]. Clin Infect Dis, 2013, 57(4): 573–578. DOI:10.1093/cid/cit248 |
| [10] | HEUGEN U, SCHWAAB G, BRÜNDERMANN E, et al. Solute-induced retardation of water dynamics probed directly by terahertz spectroscopy[J]. Proc Natl Acad Sci USA, 2006, 103(33): 12301–12306. DOI:10.1073/pnas.0604897103 |
| [11] | LAJEVARDIPOUR A, WOOD A W, MCINTOSH R L, et al. Estimation of dielectric values for tissue water in the Terahertz range[J]. Bioelectromagnetics, 2016, 37(8): 563–567. DOI:10.1002/bem.v37.8 |
| [12] | GE H, JIANG Y, LIAN F, et al. Quantitative determination of aflatoxin B1 concentration in acetonitrile by chemometric methods using terahertz spectroscopy[J]. Food Chem, 2016, 209: 286–292. DOI:10.1016/j.foodchem.2016.04.070 |
| [13] | DENG X H, LIU J T, YUAN J, et al. Tunable THz absorption in graphene-based heterostructures[J]. Opt Express, 2014, 22(24): 30177–30183. DOI:10.1364/oe.22.030177 |
| [14] | RUGGIERO M T, KORTER T M. Uncovering the terahertz spectrum of copper sulfate pentahydrate[J]. J Phys Chem A, 2016, 120(2): 227–232. DOI:10.1021/acs.jpca.5b10063 |
| [15] | WALLAUER J, BITZER A, WASELIKOWSKI S, et al. Near-field signature of electromagnetic coupling in metamaterial arrays: a terahertz microscopy study[J]. Opt Express, 2011, 19(18): 17283–17292. DOI:10.1364/OE.19.017283 |


