2. 450003 郑州, 郑州儿童医院神经内科
2. Department of Neurology, Zhengzhou Children's Hospital, Zhengzhou, Henan Province, 450003, China
事件相关电位(event-related potentials,ERPs)是检测认知功能的一种重要神经电生理手段,具有检测结果客观、无创、价廉、并可根据病情需要随时重复检测等优点[1]。经典的ERPs成分主要包括P1、N1、P2和N2外源性电位和内源性电位P300。外源性电位是刺激信息通过原始听觉皮层传递产生的动作电位,其反应电位的潜伏期与波幅均取决于刺激的物理特性,不受被测试人注意力高低影响,因而又称强制性反应电位。P300只有在受试者对某种刺激或事件给予足够的注意时才能诱发出来,反映被测试人对感觉刺激分辨和分析抉择能力,与皮层认知过程密切关联,故又有认知电位之称。由于小儿时期存在诸多导致认知功能异常的高危因素,包括围生期异常、遗传疾患、脑发育畸形和各种原因脑损伤等[2]。同时,由于婴幼儿,尤其智能障碍儿童,常因检查中不合作无法完成各种认知行为量表的临床检测。由此,如何更好地采用ERPs等电生理学手段去客观评定这些患者的认知功能与发育水平,一直是小儿神经电生理研究领域内一个热点课题。近年来人们对ERPs中P1、N1、P2和N2所谓外源性系列电位的临床意义给予积极关注,因为它们代表感觉性刺激传入大脑后在皮层对应功能区神经元的一种责任性应答,同样能反映相关皮层对信息的接收和传递功能,在神经系统疾病定位诊断中有重要指导意义[3]。本研究遵循2009年国际指南技术要求[4],对156名3~29岁健康儿童与成人,采用经典的奇特性纯音靶刺激,获取靶刺激和非靶刺激下ERPs外源性反应电位,按年龄分组进行对照分析,以获得ERPs外源性反应电位在我国儿童及青少年人群中发育规律及年龄特征,旨在为ERPs在国内儿童疾患中广泛应用与深入研究奠定良好基础。
1 资料与方法 1.1 研究对象选取156名儿童与青年(儿童来自2008-2010年在重庆医科大学附属儿童医院儿童保健科门诊例行体检者,或住院部骨科、普外科、呼吸及消化科呼吸道感染及消化道感染恢复期患儿;青年为重庆医科大学健康在读大学生),年龄3~29岁。分为3~5、>5~7、>7~9岁和>9~17岁4个年龄组与22~29岁青年成人组。本次住院病程中无任何神经系统或明显感染中毒症状,并排除使用镇静药物或神经毒性药物史。围生期和生长发育史正常。学龄期儿童学习成绩平均在85分以上,且韦氏智力量表智力筛查测定智商≥85分。所有被试者视力或矫正视力正常。无精神及神经系统疾病史。入组前均获得受试者家长或本人知情同意,且经过本院伦理委员会批准(2008)。其年龄分组人数与性别构成如下:3~5岁组,男性16人,女性14人;>5~7岁组,男性17人,女性14人;>7~9岁组,男性16人,女性14人;>9~17岁组,男性23人,女性21人;成人组,男性11人,女性10人。
1.2 仪器及参数设置 1.2.1 主要仪器设备及材料Key-point.net多功能诱发电位仪(丹麦丹迪公司), 耳机TDP-39(丹麦丹迪公司), 导电膏(重庆医科大学附属儿童医院制剂科), 记录电极(华佗牌,中国苏州医疗用品厂有限公司), 75%酒精(重庆东方试剂厂), 棉签(重庆东方试剂厂)。
1.2.2 测试参数设置采用丹麦丹迪公司Key-point.net多功能诱发电位仪进行听觉事件相关电位检测,仪器参数设置参照国际临床神经生理学会指南[4]。参数见表 1。
| 相关参数 | 内容 |
| 刺激因素 | |
| 听觉刺激 | 纯音 |
| 刺激频率 | 靶刺激(2 000 Hz),非靶刺激(1 000 Hz) |
| 持续时间 | 50~150 ms,5 ms上升/下降 |
| 刺激强度 | 70 dB SPL |
| 刺激间期(ISI) | 1~2 s |
| 受试者状态及任务 | |
| 姿势 | 坐位或舒适卧位 |
| 眼睛状态 | 睁眼/闭眼状态 |
| 应答任务 | 按键反应 |
| 电极安装及测量条件 | |
| 记录电极 | 记录位置在中央区中线 |
| 参考电极 | 鼻根或耳垂 |
| 接地电极 | 前额正中 |
| 放大器带通 | 0.01~100 Hz |
| 最低叠加次数 | 20次及以上无干扰信号图形 |
1.3 测试方法
按照欧洲神经电生理学会推荐的操作指南[4-5],测试在屏蔽室内进行。检查时确保受试者精神状态及体力状态良好,检测在安静、舒适、温度23~25 ℃的环境中进行。检测中要求被检测者保持安静,尽量避免眨眼。参照国际脑电图学标准,按10/20系统法放置导联电极收集电位信号。记录电极位于中央区中线(Cz),参考电极置于双侧乳突,前额正中接地(FPz)。电阻抗<5 kΩ,滤波频宽为0.01~100 Hz,采样速度为1次/5 ms。
检测前一律先进行脑干听觉诱发电位测试,以确认受试者可引出正常BAEP图形因而具有正常周围性听觉传导功能。通过耳机给声刺激,采用经典“Oddball”纯音声刺激模式,进行事件相关电位外源性及内源性成分检测。靶刺激与非靶刺激之比为1 :4,非靶刺激频率1 000 Hz,随机出现率占80%,靶刺激频率2 000 Hz,随机出现率占20%。靶刺激反应电位叠加20~40次。靶刺激和非靶刺激诱发的图形各自在两个导联自动呈现。刺激强度70 dB SPL。对每例受试者均反复进行两次以上测试,以确定波形的稳定性。受试者按要求进行按键、计数等主动任务。检测前就该试验要求对受试者作出详尽解释与说明,以得到受试者尤其家长理解,从而取得最佳配合与支持。
1.4 ERP波形测量与分析电位仪分别显示靶刺激和非靶刺激下ERPs叠加后图形,对ERPs各成分P1、N1、P2和N2波形测量,包括:波潜伏期:由刺激起始点至各波顶点间传导时间,以ms表示;波幅:以刺激开始前100 ms的平均电压为基础,测量从基线到各波顶点的电压大小,以微伏(μV)表示。
1.5 统计学分析采用SPSS 16.0统计软件进行处理。计量资料数据以x±s表示,两组间均数比较用独立样本t检验,多组间均数比较用单因素方差分析,Levene检验进行方差齐性检验,LSD-t检验作均值间两两比较,相关性分析采用Pearson法计算相关系数,并进行相关系数的假设检验。采用双侧显著性检验,检验水准:α=0.05。
2 结果 2.1 外源性电位潜伏期发育规律 2.1.1 靶刺激下外源性电位潜伏期靶刺激下ERPs各外源性电位潜伏期同样随年龄增加而缩短,但其快速成熟过程主要发生在学龄期与成人期(表 2)。具体表现在:①>7~9岁年龄组的P1、N1、P2和N2波潜伏期分别较>5~7岁组急剧缩短20.3%、19.0%、18.1%和9.3%,两组间差异有统计学意义(P<0.05);② 成人组与>9~17岁组间的P1、N1和N2波潜伏期比较,差异均有统计学意义(P<0.01)。其他年龄组间差异无统计学意义(P>0.05)。这表明靶刺激下外源性各波潜伏期的成熟化也非均衡过程,学龄期和成人期是人类听皮层功能发育的快速时期(图 1)。
| 组别 | P1 | N1 | P2 | N2 |
| 3~5岁组 | 80.63±10.30 | 151.96±19.11 | 200.11±25.73 | 253.07±30.20 |
| >5~7岁组 | 79.04±16.52 | 142.56±21.09 | 193.18±27.12 | 258.81±32.05 |
| >7~9岁组 | 63.41±11.82a | 115.04±21.55a | 158.05±29.50a | 234.82±28.21a |
| >9~17岁组 | 61.18±16.14 | 104.86±15.60 | 165.65±16.96 | 234.02±27.69 |
| 成人组 | 36.97±6.50b | 87.45±16.19b | 162.74±21.77 | 195.50±17.76b |
| a:P<0.05, 与>5~7岁组比较;b:P<0.01, 与>9~17岁组比较 | ||||
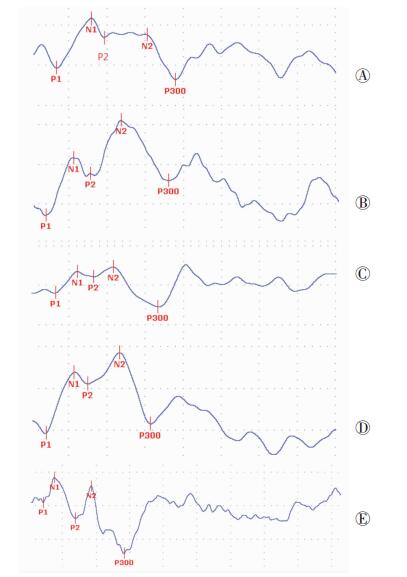
|
| A:3~5岁组;B:>5~7岁组;C:>7~9岁组;D:>9~17岁组;E:成人组 图 1 不同年龄组研究对象靶刺激所诱发的ERPs图形变化 |
2.1.2 非靶刺激下(外源性)电位潜伏期
将表 3与表 2比较可以发现,由非靶刺激诱发的(外源性)系列电位,与前述靶刺激诱发下的波潜伏期和发育规律大同小异, 成人组与>9~17岁及>7~9岁组与>5~7岁组比较差异均有统计学意义(P<0.05,P<0.01,图 2)。
| 组别 | P1 | N1 | P2 | N2 |
| 3~5岁组 | 85.28±21.95 | 129.08±36.48 | 169.20±12.40 | 271.62±42.54 |
| >5~7岁组 | 83.61±16.70 | 131.21±25.07 | 164.50±15.50 | 234.46±13.63d |
| >7~9岁组 | 70.22±11.61a | 117.77±17.94 | 160.29±12.64 | 236.03±28.77 |
| >9~17岁组 | 62.24±12.66 | 102.41±15.6c | 160.57±11.57 | 233.07±20.01 |
| 成人组 | 40.33±6.51b | 87.88±6.49 | 151.29±9.80 | - |
| a:P<0.05, 与>5~7岁组比较; b:P<0.01,与>9~17岁组比较,c:P<0.01, 与>7~9岁组比较; d:P<0.05, 与>3~5岁组比较 | ||||
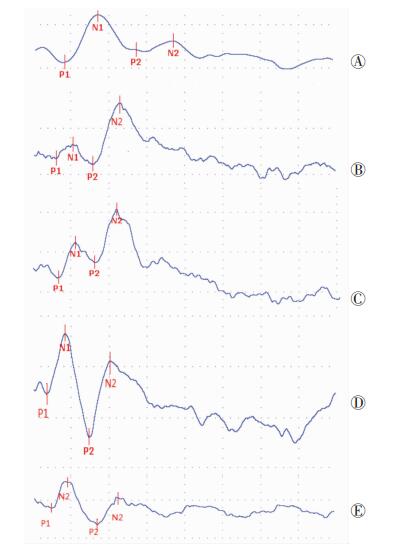
|
| A:3~5岁组;B:>5~7岁组;C:>7~9岁组;D:>9~17岁组;E:成人组 图 2 不同年龄组研究对象非靶刺激所诱发的ERPs图形变化 |
2.1.2.1 相似之处
① 从幼儿到青年漫长发育进程中,各波潜伏期非等速地随年龄增长而缩短;② 除学龄前期儿童非靶刺激诱发的P2及N2潜伏期、3~5岁幼儿P2潜伏期较同龄靶刺激相应电位明显短以外,其他年龄组的各波潜伏期未因两种不同刺激而显示明显差异。
2.1.2.2 不同之处① 虽然两者均显示各波潜伏期随年龄非匀速地成熟性缩短。但靶刺激诱发的所有4个外源性电位分别集中在7~9岁的学龄期,而P2和N1还在成人期呈现加速成熟化进程;而非靶刺激诱发的各波则在不同年龄期出现快速缩短,即>7~9岁的学龄期(P1)、>9~17岁的青少年期(N1) 和>5~7岁的学龄前期(N2),P2潜伏期呈相对均匀地短缩;② 与靶刺激相反,非靶刺激下成年组仅5%检测到明确的N2波形。
2.2 靶刺激下外源性电位波幅发育规律除N1波外,靶刺激下P1、P2、N2电位波幅随年龄增加呈先增高后降低趋势,成人和青少年期波幅反有偏低趋势(P<0.05,P<0.01)。与各外源性电位潜伏期相比较,均显示各外源性电位波幅在所有年龄组显示明显的个体差异性和不稳定性,可能因此限制其临床判断价值(表 4)。
| 组别 | P1 | N1 | P2 | N2 |
| 3~5岁组 | 5.47±5.86 | 8.39±3.54 | 3.57±2.31 | 5.86±3.78 |
| >5~7岁组 | 5.64±3.40 | 7.24±5.08 | 5.55±3.26 | 9.89±6.06 |
| >7~9岁组 | 6.35±3.14 | 6.06±5.05 | 4.83±3.24 | 8.73±4.87 |
| >9~17岁组 | 3.92±2.88a | 6.74±4.40 | 8.01±6.28 | 8.71±5.45 |
| 成人组 | 2.52±2.20 | 7.86±4.43 | 4.15±2.40b | 4.30±2.27c |
| a:P<0.05,与>7~9岁组比较; b:P<0.05,c:P<0.01, 与>9~17岁组比较 | ||||
与前述靶刺激诱发的外源性系列电位相似,P1和N2(成人大多未引出)波幅也显示青少年期后波幅逐渐降低的发育倾向。但N1和P2未遵循此规律,P2在各年龄段差异无统计学意义(P>0.05),而N1随年龄增加而增高,成人期较>9~17岁年龄组差异有统计学意义(P<0.05,表 5)。
| 组别 | P1 | N1 | P2 | N2 |
| 3~5岁组 | 4.65±1.76 | 2.64±1.37 | 3.64±2.44 | 8.26±4.13 |
| >5~7岁组 | 3.39±1.86 | 3.42±1.68 | 2.66±1.96 | 9.96±2.82 |
| >7~9岁组 | 3.61±3.01 | 4.79±2.87 | 2.36±1.63 | 11.51±4.10 |
| >9~17岁组 | 2.49±2.04 | 4.83±2.74 | 2.77±2.17 | 7.62±2.63b |
| 成人组 | 1.92±1.13 | 6.66±1.71a | 3.72±2.01 | - |
| a:P<0.05,与>9~17岁组比较; b:P<0.01, 与>7~9岁组比较 | ||||
然而,与靶刺激下各外源性波波幅相似的是,与各自潜伏期值相比,非靶刺激下所有反应电位波幅均显示明显个体差异性和不稳定性。
2.3 靶刺激和非靶刺激ERPs电位与年龄相关性分析各波的年龄相关直线方程式显示,除非靶刺激的P2波外,所有反应电位与年龄呈密切负相关(表 6)。非靶刺激下P2潜伏期值早在学龄前早期(3~5岁组)即已接近成人值,在整个非靶刺激ERP电位潜伏期成熟化进程中无太大变异,因而缺少与年龄的密切相关性。
| ERPs成分 | R | P | 直线方程 |
| 靶刺激相关成分 | |||
| P1 | -0.472 | <0.01 | Y=-3.118X+94.13 |
| N1 | -0.608 | <0.01 | Y=-5.680X+169.40 |
| P2 | -0.406 | <0.01 | Y=-3.289X+200.66 |
| N2 | -0.362 | <0.01 | Y=-3.902X+274.75 |
| 非靶刺激相关成分 | |||
| N1 | -0.539 | <0.01 | Y=-4.574X+155.20 |
| P2 | -0.106 | >0.05 | Y=-0.716X+168.20 |
| N2 | -0.325 | <0.01 | Y=-3.654X+271.12 |
3 讨论
ERPs于1965年由SUTTON等[6]首先提出来,是通过平均叠加技术在头颅表面记录大脑诱发电位来反映认知过程中大脑的神经电生理改变。经典的ERPs主要成分包括P1、N1、P2、N2、P3,另外还有N4(N400)、失匹配负波(mismatch negativity,MMN)、伴随负反应(contigent negative variaeion,CNV)等。
长期以来,人们总是将ERPs检测焦聚焦在P300的研究和临床应用上。然而,近年来围绕听觉ERPs外源性位的报道有所增多[7-8],主要因为其有以下潜在临床应用价值:① 本质上这些外源性电位属于皮层听觉诱发电位, 研究表明这些电位产生与皮层下区和听觉皮层有关[9]。通过深部电极研究证明,ERPs外源性电位的起源就是听觉刺激信息从脑干进入脑内的初级皮层中枢,具体部位在颞叶听觉中枢及其相邻部位。同时已证明,这些电位在出生前后同样要经历漫长成熟化过程,主要与脑内相关区域神经元突触数量及相互链接的发育进程相关,因而能从电生理角度观测相关部位的发育状况;② 这些电位属于相关部位神经元传输听刺激信息的自然性功能电位,无需被测试人集中注意力或应答,因而检测不受年龄或智能水平限制[9-11]。然而,与P300一样,它们存在脑内多起源易致反应电位重叠变形,以及因不同听觉刺激类型而有不同波形等问题。更重要的是,迄今仍缺乏不同年龄期小儿ERPs外源性电位的系统性研究。
本研究采用国际最常用的经典“Oddball”纯音靶刺激方式[4],获取靶与非靶纯音刺激下,不同年龄组外源性电位的年龄特征和发育规律,为相关测试在儿科临床广泛应用奠定基础。本研究发现:① 从幼儿到成人漫长发育进程中,无论靶刺激或非靶刺激诱发的外源性电位潜伏期,均随年龄增长非匀速地成熟性缩短。但靶刺激诱发的所有4个外源性电位较集中地在>7~9岁学龄期,P2和N1还在成人期呈现加速成熟化进程。非靶刺激诱发的各波各自在不同年龄期出现快速性缩短;② 无论靶刺激或非靶刺激,各年龄组的所有外源性电位波潜伏期有较高的测试稳定性;③ 除N1波外,靶刺激下P1、P2、N2波幅随年龄增加呈先增高后降低趋势,成人和青少年期波幅反较儿童期低。非靶刺激下,P1和N2也在成人与青少年期较低。外源性电位波幅在青少年和成人期反而降低的发育倾向,至少部分与年长儿头皮和脑内电位起源的距离较婴幼儿更远有关。但是,随年龄增长脑内神经元突触及突触连接日益成熟,也可能导致相邻电位相互重叠及融合,甚至“消失”[12-14]。④ 所有外源性电位波幅均值皆伴有较大标准差,提示存在明显个体差异性。同时除N1外,非靶刺激波幅普遍低于靶刺激诱发的电位。由此表明,ERPs外源性电位反映初级听觉皮层功能[15-16],不受患者合作程度影响,从学龄前到成年各波潜伏期随年龄规律性缩短,各年龄期具有较恒定正常均值与标准差,靶刺激较非靶刺激有更恒定检测结果,更具有良好临床应用前景[17-19]。
听觉外源性电位主要产生于原始听觉皮层和颞叶听觉中枢[20]。ERPs起源的多灶与重叠性质,实验参数设置如刺激间隔时间不同,记录电极的位置均会影响测试中ERPs波形、潜伏期和波幅。临床检测中通常将记录电极置于国际脑电图 10-20记录电极置放系统的额区中线、Cz和顶区中线部位,本研究则统一在Cz部位放置记录电极。因此,临床工作中,在对ERPs进行测量判断时,需注意实验条件及参数设置的一致性。另需要指出的是,与其他诱发电位相似,儿童和青少年期波幅存在明显不稳定性,个体差异较大。临床上不宜列入异常ERPs判断标准。
ERPs的外源性电位不受年龄及合作程度限制,虽不能检测认知功能,但作为听觉诱发的皮层晚发电位,能在一定程度反映颞叶原始听觉皮层功能或完整性,值得在广泛性脑发育障碍、皮层性失听或颞叶病变患儿中进行深入临床探索。
| [1] | GALAS-ZGORZALEWICZ B. Applicability of P300 potential in evaluation of cognitive processes in children and adolescents[J]. Prz Lek, 2006, 63(Suppl 1): 1–3. |
| [2] | DEREGNIER R A. Neurophysiologic evaluation of early cognitive development in high-risk infants and toddlers[J]. Ment Retard Dev Disabil Res Rev, 2005, 11(4): 317–324. DOI:10.1002/mrdd.20085 |
| [3] | RUHNAU P, HERRMANN B, MAESS B, et al. Maturation of obligatory auditory responses and their neural sources: evidence from EEG and MEG[J]. Neuroimage, 2011, 58(2): 630–639. DOI:10.1016/j.neuroimage.2011.06.050 |
| [4] | DUNCAN C C, BARRY R J, CONNOLLY J F, et al. Event-related potentials in clinical research: guidelines for eliciting, recording, and quantifying mismatch negativity, P300, and N400[J]. Clin Neurophysiol, 2009, 120(11): 1883–1908. DOI:10.1016/j.clinph.2009.07.045 |
| [5] | PICTON T W, BENTIN S, BERG P, et al. Guidelines for using human event-related potentials to study cognition: recording standards and publication criteria[J]. Psychophysiology, 2000, 37(2): 127–152. DOI:10.1017/s0048577200000305 |
| [6] | SUTTON S, BRAREN M, ZUBIN J, et al. Evoked-potential correlates of stimulus uncertainty[J]. Science, 1965, 150(3700): 1187–1188. DOI:10.1126/science.150.3700.1187 |
| [7] | WUNDERLICH J L, CONE-WESSON B K. Maturation of CAEP in infants and children: a review[J]. Hear Res, 2006, 212(1/2): 212–223. DOI:10.1016/j.heares.2005.11.008 |
| [8] | PAUS T, COLLINS D L, EVANS A C, et al. Maturation of white matter in the human brain: a review of magnetic resonance studies[J]. Brain Res Bull, 2001, 54(3): 255–266. DOI:10.1016/s0361-9230(00)00434-2 |
| [9] | LUO J J, KHURANA D S, KOTHARE S V. Brainstem auditory evoked potentials and middle latency auditory evoked potentials in young children[J]. J Clin Neurosci, 2013, 20(3): 383–388. DOI:10.1016/j.jocn.2012.02.038 |
| [10] | PURDY S C, SHARMA M, MUNRO K J, et al. Stimulus level effects on speech-evoked obligatory cortical auditory evoked potentials in infants with normal hearing[J]. Clin Neurophysiol, 2013, 124(3): 474–480. DOI:10.1016/j.clinph.2012.09.011 |
| [11] | MAI X, XU L, LI M, et al. Auditory recognition memory in 2-month-old infants as assessed by event-related potentials[J]. Dev Neuropsychol, 2012, 37(5): 400–414. DOI:10.1080/87565641.2011.650807 |
| [12] | PICTON T W, TAYLOR M J. Electrophysiological evaluation of human brain development[J]. Dev Neuropsychol, 2007, 31(3): 249–278. DOI:10.1080/87565640701228732 |
| [13] | PUJOL J, LóPEZ-SALA A, SEBASTIáN-GALLéS N, et al. Delayed myelination in children with developmental delay detected by volumetric MRI[J]. Neuroimage, 2004, 22(2): 897–903. DOI:10.1016/j.neuroimage.2004.01.029 |
| [14] | PONTON C W, EGGERMONT J J, KWONG B, et al. Maturation of human central auditory system activity: evidence from multi-channel evoked potentials[J]. Clin Neurophysiol, 2000, 111(2): 220–236. DOI:10.1016/s1388-2457(99)00236-9 |
| [15] | RANCE G, TOMLIN D. Maturation of the central auditory nervous system in children with auditory processing disorder[J]. Semin Hear, 2016, 37(1): 74–83. DOI:10.1055/s-0035-1570328 |
| [16] | SHARMA A, CARDON G. Cortical development and neuroplasticity in auditory neuropathy spectrum disorder[J]. Hear Res, 2015, 330(Pt B): 221–232. DOI:10.1016/j.heares.2015.06.001 |
| [17] | LIGHTFOOT G. Summary of the N1-P2 cortical auditory evoked potential to estimate the auditory threshold in adults[J]. Semin Hear, 2016, 37(1): 1–8. DOI:10.1055/s-0035-1570334 |
| [18] | SILVA L A, COUTO M I, MAGLIARO F C, et al. Cortical maturation in children with cochlear implants: correlation between electrophysiological and behavioral measurement[J]. PLoS One, 2017, 12(2): e0171177. DOI:10.1371/journal.pone.0171177 |
| [19] | LOPEZ-SOTO T, POSTIGO-MADUENO A, NUNEZ-ABADES P. Evaluating long-latency auditory evoked potentials in the diagnosis of cortical hearing loss in children[J]. Oxford Medical Case Reports, 2016, 2016(3): 51–4. DOI:10.1093/omcr/omw011 |
| [20] | WERNER K, FOSI T, BOYD S G, et al. Temporal lobe impairment in west syndrome: event-related potentialevidence[J]. Ann Neurol, 2015, 77(1): 47–57. DOI:10.1002/ana.24297 |



