2. 710032 西安,第四军医大学口腔医院牙周病黏膜病科;
3. 400037 重庆,第三军医大学新桥医院口腔科;
4. 400016 重庆,重庆医科大学附属第一医院口腔科
2. Department of Mucosal Disease, Stomatological Hospital, Fourth Military Medical University, Xi'an, Shaanxi Province, 710032;
3. Department of Stomatology, Xinqiao Hospital, Third Military Medical University, Chongqing, 400037;
4. Department of Stomatology, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
骨缺损为临床常见的骨性疾病,目前临床上最佳的治疗手段即为自体骨移植[1],但自体骨移植却不可避免地带来了身体其他部位的骨缺损,增加了患者的创伤。因此,随着临床医学的进步和组织工程的发展,运用组织工程的理论和方法对骨缺损性疾病进行治疗被视为将来一种更为理想的治疗方法。
骨组织在人一生中不断地进行改建与重塑,这一过程是在成骨细胞与破骨细胞的共同作用下完成的,并且需要多种细胞因子参与和调控。因此任何环节的异常,都有可能引起骨质骨量的改变,从而影响骨骼的健康。研究显示:骨骼受大量周围神经纤维支配,它们密集分布于骨膜与骨骺端[2],提示神经系统可能与骨组织的代谢相关,因而其分泌的生长因子及其受体可能在骨骼的矿化发育及重塑中起一定调控作用。
p75NTR为神经营养因子低亲和力受体,现已知肿瘤坏死因子受体超家族成员16(tumor necrosis factor receptor superfamily member 16,TNFRSF16)、神经生长因子受体(nerve growth factor receptor, NGFR)或CD271参与多重生物学效应的调控,如细胞存活、增殖[3-5]、凋亡、分化[6]。研究发现p75NTR表达于人骨髓组织中[7], 但其与骨矿化发育的关系目前只有离体细胞实验的研究,尚未有对模式动物研究的报道。本研究基于美国Jackson实验室提供的p75NTR基因敲除小鼠[8],通过对比研究p75NTR-/-与p75NTR+/+小鼠的股骨矿化发育差异,旨在探讨p75NTR敲除对股骨矿化发育的影响,并进一步明确其在骨的矿化发育、代谢中的调控作用,为骨缺损等创伤性骨病的组织工程修复技术提供理论依据及实验基础。
1 材料与方法 1.1 实验动物、主要试剂和仪器实验动物为引进自美国Jackson实验室的p75NTR-/+雌性、雄性小鼠各10只,7~8周龄,体质量约20 g,饲养于第三军医大学大坪医院野战外科研究所实验动物中心SPF级动物室,常规配笼饲养。试剂包括QIAGEN Master Mix试剂盒(QIAGEN公司,德国);溴化乙锭(Amresco公司,美国);琼脂糖(Biowest公司, 西班牙);Tris、HCl、NaOH、多聚甲醛、50X TAE(上海生工生物工程有限公司);钙黄绿素(calcein, Sigma公司,美国);组织总RNA提取试剂盒、一步法RT-PCR试剂盒(TaKaRa公司,日本),BCA(bicinchonininc acid,BCA二喹啉甲酸)蛋白浓度测定试剂盒(碧云天生物技术有限公司);Runx2(runt-related transcription factor 2,Runx相关因子受体)兔多克隆抗体(Immunoway公司, 美国);ALP鼠单克隆抗体(Abcam公司,美国);GAPDH(Bioworld公司, 美国);山羊抗兔IgG、山羊抗小鼠IgG(北京中杉金桥公司)。主要仪器包括正置荧光显微镜(Olympus公司, 日本);Micro-CT viva ct40(Scanco Mdeical AG,瑞士);硬组织切片机(EXAKT Verteriebs公司, 德国);荧光定量PCR仪、荧光化学发光成像系统(Bio-Rad公司,美国)。
1.2 p75NTR基因敲除小鼠的鉴定将p75NTR-/+雌性和p75NTR-/+雄性小鼠进行配笼,待新生鼠出生10 d时剪取约2 mm尾巴,利用Tris-HCl方法提取小鼠尾巴基因组DNA,采用引物oIMR0710、oIMR0711(扩增野生型小鼠基因序列);oIMR0713、oIMR0714(扩增敲除小鼠基因序列)鉴定p75NTR敲除小鼠(引物基因序列见表 1)。使用QIAGEN Master Mix试剂盒进行PCR扩增,反应体系总体积为25 μL。
| 基因 | 引物序列 | 产物大 小(bp) |
|
| p75NTR | |||
| oIMR0710 | 5′-TGTTACGTTCTCTGACGTGGTGAG-3′ | 280 | |
| oIMR0711 | 5′-TCAGCCCAGGGTGTGCACTC-3′ | ||
| oIMR0713 | 5′-VTTGGGTGGAGAGGCTATTC-3′ | 345 | |
| oIMR0714 | 5′-AGGTGAGATGACAGGAGATC-3′ | ||
| Runx2 | 上游 | 5′-GCCGGGAATGATGAGAACTA-3′ | 123 |
| 下游 | 5′-GGTGAAACTCTTGCCTCGTC-3′ | ||
| ALP | 上游 | 5′-AACCCAGACACAAGCATTCC-3′ | 146 |
| 下游 | 5′-CGAAGGGTCAGTCAGGTTGT-3′ | ||
1.3 股骨的Micro-CT扫描及图像分析
选取同窝p75NTR-/-、p75NTR+/+雄性小鼠,常规饲养至8周时,以50 mg/kg的2%戊巴比妥钠腹腔注射麻醉后,脱颈处死。解剖分离出小鼠左侧股骨,于4%多聚甲醛中固定,后行Micro-CT扫描,并利用其配套软件进行三维重建及数据分析,具体分析指标:松质骨的骨量(BV)、骨体积分数(BV/TV)、骨小梁数(Tb.N)、骨小梁厚度(Tb.Th)、骨表面积/骨量(BS/BV)、骨小梁分离度(Tb.Sp)和皮质骨的骨量(Ct.BV)、骨皮质厚度(Ct.TbTh)、骨皮质的骨表面积/骨量(Ct.BS/BV)。
1.4 钙黄绿素荧光双标检测矿化沉积速率选取同窝p75NTR-/-、p75NTR+/+雄性小鼠,常规饲养40 d时每间隔5 d注射钙黄绿素溶液(25 mg/kg), 共4次,最后一次腹腔注射2 d后处死小鼠,解剖分离出小鼠左侧股骨,60%、70%、80%、90%、100%梯度乙醇各脱水1 d,7 :3、5 :5(无水乙醇:7200VCL树脂)各浸透1 d,100% 7200VCL树脂浸透3 d,光固化树脂包埋,至完全凝固。对左侧股骨距股骨头约2 mm处开始行8 μm冠状方向连续切片,正置荧光显微镜下观察、拍片。激发波长为485 nm,发射波长为510 nm。采用专业图像分析软件(Image-Pro Plus 6.0,IPP)计量分析两条荧光带之间的平均距离,所得数值除以标记间隔日数,即为矿化沉积速率(mineral apposition rate, MAR),单位为μm/d。
1.5 股骨总RNA的提取及RT-PCR检测ALP、Runx2 mRNA的表达利用TRIzol法提取4周龄时p75NTR-/-、p75NTR+/+雄性小鼠股骨总RNA,按试剂盒说明反转录合成cDNA后行RT-PCR,检测ALP、Runx2的表达,β-actin基因作为内参对照。反应体系为:Sybr 10 μL、DEPC水6.4 μL、上游引物0.8 μL、下游引物0.8 μL、样本模板2 μL,引物基因序列见表 1。
1.6 股骨总蛋白的提取及Western blot检测ALP、Runx2的表达分别提取4周龄大p75NTR-/-、p75NTR+/+雄性小鼠股骨总蛋白并定量,以20 μg/孔上样,采用Western blot检测ALP、Runx2蛋白表达,GAPDH作为内参。
1.7 统计学分析采用SPSS 13.0统计软件。计量资料以x±s表示,两组间比较采用t检验,检验水准:α=0.05。
2 结果 2.1 小鼠基因型的鉴定杂合子小鼠配笼后所得子代小鼠基因型鉴定结果如图 1所示:1号小鼠电泳条带位于280 bp处为p75NTR-/-;2号小鼠电泳条带位于345 bp处为p75NTR+/+;3号小鼠电泳条带位于280 bp和345 bp为p75NTR-/+。
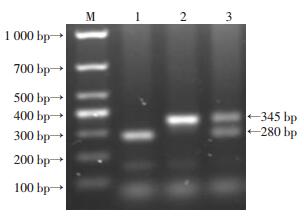
|
| M: DL 1 000标准;1:p75NTR-/-;2:p75NTR+/+;3:p75NTR-/+ 图 1 子代小鼠p75NTR基因鉴定电泳结果 |
2.2 p75NTR-/-小鼠股骨的骨质、骨量较p75NTR+/+小鼠降低
股骨远端干骺端生长板下1 mm位置开始行Micro-CT扫描,扫描区域约1 mm,三维重建发现p75NTR-/-小鼠股骨的骨量较同窝p75NTR+/+小鼠明显减少,数据分析发现其BV、BV/TV、Tb.N、Tb.Th、Ct.BV、Ct.TbTh均较p75NTR+/+小鼠低(P < 0.05),BS/BV、Tb.Sp、Ct.BS/BV则较p75NTR+/+小鼠升高,表明p75NTR-/-小鼠股骨的骨质、骨量均较野生型降低(P < 0.01,表 2、图 2)。
小鼠 |
BV (mg/cm3) |
BV/TV (%) |
BS/BV (/mm) |
Tb.Th (μm) |
Tb.N (cm-1) |
Tb.Sp (μm) |
Ct.Tb.Th (μm) |
Ct.BV (mg/cm3) |
Ct.BS/BV (mm-1) |
| p75NTR-/- | 12.26±0.78b | 0.170 0±0.002 5b | 50.82±1.70b | 39.40±3.11b | 4.40±0.25a | 187.50±6.98b | 163.00±14.60b | 29.03±1.60b | 12.26±0.47b |
| p75NTR+/+ | 32.80±1.20 | 0.250 0±0.005 0 | 38.23±2.30 | 52.30±1.90 | 4.87±0.13 | 150.00±10.10 | 233.50±13.00 | 45.43±2.10 | 8.56±0.75 |
| a: P < 0.05,b:P < 0.01,与p75NTR+/+比较 | |||||||||
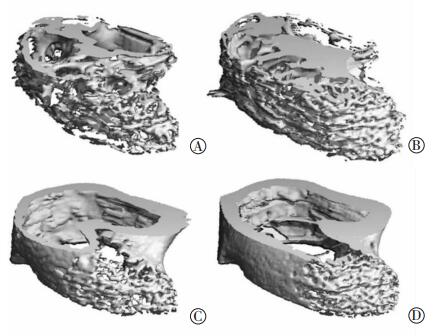
|
| A:p75NTR-/-小鼠松质骨;B: p75NTR+/+小鼠松质骨;C: p75NTR-/-小鼠皮质骨;D:p75NTR+/+小鼠皮质骨 图 2 两种基因型小鼠股骨松质骨和皮质骨的三维重建图 |
2.3 p75NTR-/-小鼠股骨MAR低于p75NTR+/+小鼠
钙黄绿素双标检测结果显示:p75NTR-/-小鼠股骨MAR明显低于p75NTR+/+小鼠[(5.18±0.81) vs (7.91±0.75)μm/d, P < 0.01,图 3]。
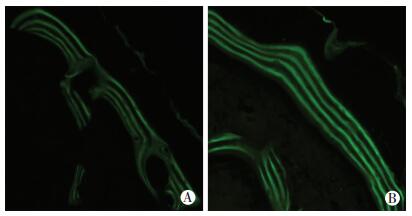
|
| A:p75NTR-/-;B:p75NTR+/+ 图 3 钙黄绿素荧光标记观察2月龄小鼠股骨矿化速率(×40) |
2.4 p75NTR-/-小鼠股骨ALP、Runx2的mRNA及蛋白表达低于p75NTR+/+小鼠
RT-PCR检测结果显示:p75NTR-/-小鼠组股骨组织中的矿化相关基因ALP、Runx2 mRNA的表达均较p75NTR+/+组低(P < 0.01,图 4A、B)。从基因水平上验证了p75NTR敲除对小鼠股骨的矿化有抑制作用。Western blot检测结果显示:p75NTR-/-小鼠ALP、Runx2的蛋白表达明显低于p75NTR+/+组(0.57±0.02 vs 0.64±0.00、0.66±0.02 vs 0.96±0.01,P < 0.01,图 4)。
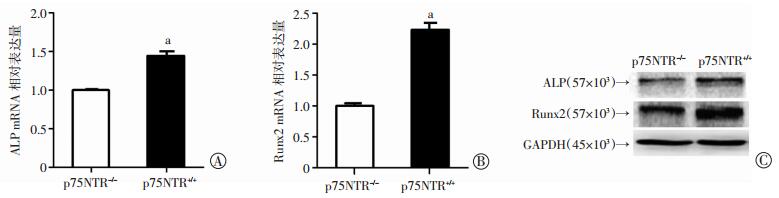
|
| A、B:分别为RT-PCR检测ALP、Runx2 mRNA表达 a: P < 0.01, 与p75NTR-/-比较;C:Western blot检测ALP、Runx2蛋白表达 图 4 4周龄小鼠股骨组织中矿化相关基因ALP、Runx2的mRNA及蛋白表达 |
3 讨论
骨组织的重塑是在诸多细胞因子的共同调控作用下完成的。以往研究证实神经营养因子低亲和力受体p75NTR可以参与多重生物学效应,并被认为是纯化人骨髓间充质干细胞最具有代表性的标记物之一[9],揭示其在骨髓间充质干细胞中的高表达性。体外实验研究表明:p75NTR可能参与大鼠神经嵴源性EMSCs的体外矿化过程[10-11],并发现p75NTR可作为人下颌骨骨膜源性细胞早期矿化的标志物[12],但其与骨矿化发育的关系却仍有争议。将动物的某一个基因敲除,并观察动物的表型被认为是研究该基因功能最有效的方法[13],所以,研究者们常常将和人类基因组具有较高同源性的小鼠[14]用作实验的模式动物。本研究利用p75NTR基因敲除小鼠,重点检测p75NTR-/-小鼠较同窝野生型小鼠股骨矿化发育的差异,发现p75NTR基因敲除后对小鼠股骨矿化发育有明显的负向调控作用,为创伤性骨病的组织工程修复技术提供理论依据及实验基础。
本研究通过Micro-CT扫描图像及数据分析,探讨p75NTR基因敲除后对小鼠股骨骨重塑结果的影响:股骨松质骨的BV、BV/TV、TRI-Tb.N、Tb.Th结果显示p75NTR-/-组小鼠均较p75NTR+/+小鼠低,这表明p75NTR-/-小鼠骨小梁的发育受到阻碍;而BS/BV、Tb.Sp表现为p75NTR-/-小鼠高于p75NTR+/+小鼠,同样表明p75NTR-/-小鼠骨小梁之间的间隔增大。同段股骨的皮质骨的分析中Ct.BV和Ct.TBTh均为p75NTR-/-小鼠较p75NTR+/+小鼠低,而Ct.BS/BV在p75NTR-/-小鼠中较高,表明p75NTR-/-小鼠的骨皮质骨形成受到影响。由此可见,p75NTR基因敲除后会使小鼠股骨的骨量减少,骨质减弱。有研究报道:在小鼠胚胎间充质干细胞系C3H10T1/2中过表达p75NTR后,会抑制其成骨矿化潜能[15]。而在小鼠成骨细胞系MC3T3-E1中过表达p75NTR后,细胞的增殖、矿化成骨潜能都增强[16]。可见p75NTR在不同细胞系的体外矿化过程中起到不同的调控作用。这可能和体外实验中不同的培养微环境引起不同的细胞生物学效应有关。本研究通过在体模式动物验证了p75NTR参与小鼠股骨的矿化发育调控,并且发现p75NTR基因敲除对小鼠股骨的骨重塑起到负性调控作用。模式动物更能体现机体完善微环境作用下某基因改变后的影响,因此,对于明确p75NTR参与骨矿化能力的调控作用、排除争议具有重要意义。
钙黄绿素作为一种稳定的体内荧光标记染料,其体内注射可以标记牙齿、骨组织等的MAR,并且不会对组织的矿化沉积产生影响[17]。而MAR的检测常常被视为检测动物硬组织矿化沉积能力的重要方法。本研究中股骨钙黄绿素荧光双标检测结果显示:p75NTR-/-组的股骨MAR低于p75NTR+/+组,说明p75NTR基因敲除小鼠的股骨平均每天矿化沉积量较野生型降低,提示p75NTR基因敲除后小鼠股骨矿化能力存在一定程度的降低。这一结果与本课题组前期研究发现(p75NTR促进大鼠EMSCs的体外矿化能力)相类似[18]。ALP和Runx2为早期骨形成的标志物,在间充质干细胞的矿化分化过程中,Runx2作为上游基因激活成骨相关基因osterix的表达[19]。本研究RT-PCR及Western blot结果显示:p75NTR-/-小鼠股骨中矿化成骨相关基因ALP、Runx2的mRNA及蛋白表达均明显较p75NTR+/+小鼠,进一步验证p75NTR基因敲除后会对小鼠股骨的矿化发育起到负向调节作用。由此我们推测:p75NTR基因敲除小鼠股骨骨量的减少及骨质的降低和其矿化成骨能力的减弱有关。
p75NTR基因包含6个外显子,其启动子序列在鼠和人有高度的相似性[20]。P75NTR蛋白属于Ⅰ型跨膜蛋白,其胞外域为NGF的结合部位。本研究中所采用的基因小鼠敲除了编码P75NTR胞外域的外显子Ⅲ,即该基因小鼠不表达具有结合NGF能力的p75NTR[8]。因此,通过检测p75NTR基因敲除小鼠股骨矿化形成能力的降低,我们认为p75NTR调控小鼠股骨矿化成骨的能力可能与其和NGF结合的能力有关。在以往的研究中,Mikami等[16]发现在过表达p75NTR的小鼠成骨细胞中,其促进矿化成骨的能力和Trk信号通路密切相关。本课题组的前期研究结果发现p75NTR对矿化的影响可能是通过以Smad4为核心的TGF-β/Smad4信号通路介导的[21],并通过免疫共沉淀实验发现:在大鼠神经嵴源性EMSCs的体外矿化过程中p75NTR可能通过结合Mage-D1,影响矿化相关基因表达,进而促进EMSCs的矿化能力[18]。
综上所述,本研究着重探讨了p75NTR基因敲除对小鼠股骨的骨量和骨质存在负性调节作用,发现p75NTR基因敲除会使小鼠股骨矿化形成能力降低,并初步推测p75NTR参与调控小鼠股骨矿化成骨的能力可能与NGF的结合有关。本课题组今后将进一步探讨以下问题:p75NTR基因敲除是否影响小鼠股骨的破骨吸收能力;检测小鼠的血钙水平,以明确p75NTR敲除小鼠骨质骨量的改变是否与小鼠体内钙磷稳态有关,以进一步明确p75NTR这一神经营养因子受体对于矿化发育的调控能力及可能机制。
| [1] | Rohner D, Bucher P, Hammer B. Prefabricated fibular flaps for reconstruction of defects of the maxillofacial skeleton: planning, technique, and long-term experience[J]. Int J Oral Maxillofac Implants, 2013, 28(5): e221–e229. DOI:10.11607/jomi.te01 |
| [2] | Imai S, Tokunaga Y, Maeda T, et al. Calcitonin gene-related peptide, substance P, and tyrosine hydroxylase-immunoreactive innervation of rat bone marrows: an immunohistochemical and ultrastructural investigation on possible efferent and afferent mechanisms[J]. J Orthop Res, 1997, 15(1): 133–140. DOI:10.1002/jor.1100150120 |
| [3] | Akiyama Y, Mikami Y, Watanabe E, et al. The P75 neurotrophin receptor regulates proliferation of the human MG63 osteoblast cell line[J]. Differentiation, 2014, 87(3/4): 111–118. DOI:10.1016/j.diff.2014.01.002 |
| [4] | Kuci Z, Seiberth J, Latifi-Pupovci H, et al. Clonal analysis of multipotent stromal cells derived from CD271+ bone marrow mononuclear cells: functional heterogeneity and different mechanisms of allosuppression[J]. Haematologica, 2013, 98(10): 1609–1616. DOI:10.3324/haematol.2013.092700 |
| [5] | Moscatelli I, Pierantozzi E, Camaioni A, et al. p75 neurotrophin receptor is involved in proliferation of undifferentiated mouse embryonic stem cells[J]. Exp Cell Res, 2009, 315(18): 3220–3232. DOI:10.1016/j.yexcr.2009.08.014 |
| [6] | Tomellini E, Lagadec C, Polakowska R, et al. Role of p75 neurotrophin receptor in stem cell biology: more than just a marker[J]. Cell Mol Life Sci, 2014, 71(13): 2467–2481. DOI:10.1007/s00018-014-1564-9 |
| [7] | Cattoretti G, Schiró R, Orazi A, et al. Bone marrow stroma in humans: anti-nerve growth factor receptor antibodies selectively stain reticular cells in vivo and in vitro[J]. Blood, 1993, 81(7): 1726–1738. |
| [8] | Lee K F, Li E, Huber L J, et al. Targeted mutation of the gene encoding the low affinity NGF receptor p75 leads to deficits in the peripheral sensory nervous system[J]. Cell, 1992, 69(5): 737–749. DOI:10.1016/0092-8674(92)90286-L |
| [9] | Quirici N, Soligo D, Bossolasco P, et al. Isolation of bone marrow mesenchymal stem cells by anti-nerve growth factor receptor antibodies[J]. Exp Hematol, 2002, 30(7): 783–791. DOI:10.1016/S0301-472X(02)00812-3 |
| [10] |
鞠迎新, 温秀杰, 杨琨, 等. p75神经营养受体在胎鼠颌突外胚间充质干细胞体外矿化过程中表达变化的研究[J].
中华口腔医学杂志, 2016, 51(7): 426–431.
Ju Y X, Wen X J, Yang K, et al. Expression of p75 neurotrophin receptor during the mineralization of ectomesenchymal stem cells in vitro[J]. Chin J Stomatol, 2016, 51(7): 426–431. DOI:10.3760/cma.j.issn.1002-0098.2016.07.010 |
| [11] | Wen X, Liu L, Deng M, et al. Characterization of p75(+) ectomesenchymal stem cells from rat embryonic facial process tissue[J]. Biochem Biophys Res Commun, 2012, 427(1): 5–10. DOI:10.1016/j.bbrc.2012.08.109 |
| [12] | Alexander D, Schfer F, Munz A, et al. LNGFR induction during osteogenesis of human jaw periosteum-derived cells[J]. Cell Physiol Biochem, 2009, 24(3/4): 283–290. DOI:10.1159/000233253 |
| [13] | Austin C P, Battey J F, Bradley A, et al. The knockout mouse project[J]. Nat Genet, 2004, 36(9): 921–924. DOI:10.1038/ng0904-921 |
| [14] | Gregory S G, Sekhon M, Schein J, et al. A physical map of the mouse genome[J]. Nature, 2002, 418(6899): 743–750. DOI:10.1038/nature00957 |
| [15] | Mikami Y, Ishii Y, Watanabe N, et al. CD271/p75(NTR) inhibits the differentiation of mesenchymal stem cells into osteogenic, adipogenic, chondrogenic, and myogenic lineages[J]. Stem Cells Dev, 2011, 20(5): 901–913. DOI:10.1089/scd.2010.0299 |
| [16] | Mikami Y, Suzuki S, Ishii Y, et al. The p75 neurotrophin receptor regulates MC3T3-E1 osteoblastic differentiation[J]. Differentiation, 2012, 84(5): 392–399. DOI:10.1016/j.diff.2012.07.001 |
| [17] | Smith T M. Experimental determination of the periodicity of incremental features in enamel[J]. J Anat, 2006, 208(1): 99–113. DOI:10.1111/j.1469-7580.2006.00499.x |
| [18] | Yang K, Wang Y, Ju Y, et al. p75 neurotrophin receptor regulates differential mineralization of rat ectomesenchymal stem cells[J]. Cell Prolif, 2017, 50(1): e12290. DOI:10.1111/cpr.12290 |
| [19] | Komori T. Regulation of osteoblast differentiation by transcription factors[J]. J Cell Biochem, 2006, 99(5): 1233–1239. DOI:10.1002/jcb.20958 |
| [20] | Metsis M. Genes for neurotrophic factors and their receptors: structure and regulation[J]. Cell Mol Life Sci, 2001, 58(8): 1014–1020. DOI:10.1007/PL00000916 |
| [21] | Xing Y, Nie X, Chen G, et al. Comparison of P75 NTR-positive and -negative etcomesenchymal stem cell odontogenic differentiation through epithelial-mesenchymal interaction[J]. Cell Prolif, 2016, 49(2): 185–194. DOI:10.1111/cpr.12248 |



