心肌致密化不全(non-compaction cardiomyopathy,NCC)是一种目前受到广泛关注的以心室腔内出现粗大的肌小梁及交错的深隐窝为主要特征的先天性心肌病[1]。心肌致密化不全的发病机制尚不明确,多认为系心室肌发育过程中心肌致密化过程受阻而引起[2]。流行病学调查结果显示,该病有明显的家族遗传倾向[3]。目前已发现多个基因的突变跟心肌致密化不全的发生有关[4]。然而,我们对重庆医科大学附属儿童医院2007-2015年间32例诊断“心肌致密化不全”的患儿进行电话随访发现:(1) 只有2例患儿直系亲属患心肌病;(2) 散发病例中有3例患儿的母亲曾在孕期酗酒。孕期酒精暴露已知是先天性心脏病致病因素之一[5-6]。多个研究数据表明,超半数心肌致密化不全患儿合并有其他先天性心脏病[3]。这些现象提示:基因突变可能不是心肌致密化不全的唯一病因,母亲孕期酒精暴露可能是该病的致病因素之一。基于以上假设,我们以小鼠为实验对象,严密设计实验,开展前瞻性的动物实验研究。
1 材料与方法 1.1 动物准备和干预所有实验小鼠(C57BL/6J小鼠,3月龄;雄性15只,雌性60只)购自重庆医科大学实验动物中心(许可证号:SYXK2007-0016),其中雌鼠体质量20~22 g,雄鼠体质量21~25 g。将其饲养在重庆医科大学附属儿童医院SPF级动物实验室(每日7:00-19:00为白天,19:00-次日7:00为黑夜,温度23~24 ℃,湿度50%~ 60%)。按配对随机设计的原则将体质量、年龄相近的小鼠分为两组(对照组、实验组),耳标标记,按雌雄比2 :1合笼,并定期检查阴栓。处理:在孕期3.5~18.5 d对实验组的C57母鼠行56%酒精(无水乙醇加双蒸水兑换)灌胃,另在相同时间段用等量生理盐水给对照组的孕鼠灌胃。本实验所涉及动物伦理问题,已通过重庆医科大学伦理委员会审查。
1.2 体内酒精代谢实验 1.2.1 不同剂量酒精暴露后血清中浓度检测取20只雌鼠用随机抽签法等分成4组,然后分别按0.0、2.5、5.0、10.0 mL/kg的剂量用56%酒精灌胃处理,30 min后摘除眼球取血,通过比色法(BioAssay Systems, ECET-100) 定量分析小鼠血液中酒精浓度。本实验中灌胃所用56%酒精系无水乙醇(重庆川东化工)加入DDH2O兑制。
1.2.2 同一剂量酒精暴露后不同时间点血清中酒精浓度取30只雌鼠随机等分成6个组,用56%酒精灌胃后,分别在0.0、0.5、1.0、1.5、3.0、6.0 h后用以上方法检测血清中酒精浓度。
1.3 摸索最佳干预剂量及时间段目前文献[7]报道孕期酒精暴露致先天性心脏病的最低剂量是:3.6 mL(30%酒精)/kg(体质量);最迟的开始暴露时间为:胚胎期天数(embryo day,ED)6.5。由于心肌致密化不全的心肌结构畸形通常比先天性心脏病复杂,因此酒精致畸的剂量可能更大,时间更早。因此,设定干预剂量为0.0、2.5、5.0、10.0 mL/kg;干预开始时间为ED0.5、ED3.5、ED5.5。
1.4 心脏组织观察在孕期19.5 d,取两组子代小鼠心脏作为观察对象,分别通过电子透射显微镜(日本电子1400PLUS)、石蜡切片后HE染色观察心肌结构变化情况。在两组子1代小鼠成年后,通过小鼠心脏超声多普勒(GEvividE9) 检测其心脏功能及结构改变情况。
临床上,诊断心肌致密化不全的标准多选用[7]:在心脏多普勒超声检查中,非致密心肌层与致密心肌层厚度的比值(the ratio of non-compacted myocardium to compact myocardium at the end of systole,N/C)>2.0。也有人认为[8]:儿童心肌致密化不全的诊断只需符合N/C>1.4即可。但目前尚无小鼠“心肌致密化不全”模型的诊断标准,现以N/C>1.4作为ED19.5小鼠心肌致密化不全的诊断标准。
1.5 统计学分析Adobe Photoshop CS6软件测量两组切片N/C值,Excel 2010整理心脏超声数据,采用SPSS 20.0软件进行统计分析,两组数据差异性选用比较均值的独立样本t检验,检验水准:α=0.05;GraphPad Prism 5软件制图。
2 结果 2.1 体内酒精代谢对C57小鼠体内不同剂量酒精代谢情况观察结果显示:C57小鼠在相同时刻(30 min)随着灌胃酒精剂量0、2.5、5.0、10.0 mL/kg增高,体内酒精浓度呈线性增高趋势(图 1A)。对C57小鼠体内不同时间点的酒精浓度(5.0 mL/kg)时序性观察结果显示:酒精灌胃后,小鼠体内酒精浓度迅速增高,在30 min左右达高峰值,然后维持近1h的高水平后,在1.5~3.0 h期间快速回落,3.0 h后回落至一个较低水平(图 1B)。因此,雌鼠饮酒后,体内酒精代谢需时较长(3 h,图 1)。

|
| 图 1 小鼠体内不同剂量(A)与不同时间(B)酒精代谢情况 |
2.2 最佳干预剂量及时间确定
当干预剂量为0.0、2.5、5.0、10.0 mL/kg时(干预时间为ED3.5~ED19.5),雌鼠干预后存活率(死亡病例皆因酒精不耐受引起肠道胀气从而进食困难或因过量酒精摄入中毒而死亡)分别为100%(13/13)、80%(8/10)、63.3%(19/30)、30.0%(3/10);怀孕率(以ED19.5有活胚胎为准)分别为84.6%(11/13)、62.5%(5/8)、57.9%(11/19)、33.3%(1/3)。当干预时间为ED0.5、ED3.5、ED5.5时(干预浓度为5.0 mL/kg),雌鼠干预后存活率分别为40%(2/5)63.3%(19/30)、80%(4/5);怀孕率分别为0.0%(0/2)、57.9%(11/19)、50.0%(2/4)。
2.3 新生鼠体质量比较实验组新生鼠的体质量明显比对照组低,[对照组新生鼠(ED19.5) 的体质量:(1.31±0.12) g,实验组:(1.01±0.43) g,t=-2.378,P=0.034],两组数据的差异有统计学意义(P < 0.05)。
2.4 新生鼠心室肌超微结构通过电子透射显微镜对心肌细胞内部超微结构进行观察后发现:实验组与正常组相比,心脏组织肌丝排列较紊乱,甚至出现断裂、溶解;线粒体肿胀、溶解;大量的肌浆网扩大(图 2)。
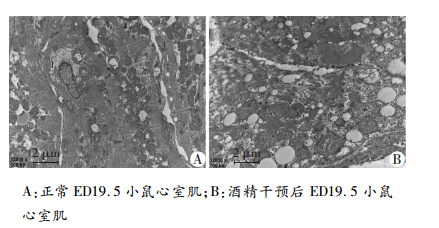
|
| A:正常ED19.5小鼠心室肌;B:酒精干预后ED19.5小鼠心室肌 图 2 电子透射显微镜下的小鼠心室肌结构(×12 000) |
2.5 新生鼠心室肌层结构
对两组心脏组织进行石蜡切片、HE染色后显示:孕期母体经大量酒精暴露后,31.25%子代小鼠(5/16) 的左心室肌呈海绵状改变,且心脏体积较小,病变室腔明显扩大(图 3)。将病变部位的肌小梁放大后可观察到:肌小梁间隙较深、较宽,内侧有血液填充;心内膜上内皮细胞排列仍较规整;心肌细胞密度较低。实验组中有5例心尖处心肌出现明显海绵状改变(N/C>1.4),其他11例有不同程度的心肌缺压实的表现,但未达到N/C>1.4这一诊断标准;对照组(20例)几乎无明显心肌压实缺乏改变。分别测量病变组(5例)和对照组心尖处N/C值大小,结果如下:病变组(5例)N/C值为(2.49±0.68);对照组N/C值为(0.62±0.23), 两组数据差异有统计学意义(t=10.397,P < 0.01)。

|
| A~C:分别为对照组心脏的横、纵切面及心室肌小梁部位;D~F:分别为实验组心脏的横、纵切面及心室肌小梁部位,其中横切面为心室腔所在部位;C、F:分别是图B、E红线框放大后图像 图 3 光学显微镜下的小鼠心室腔结构 |
2.6 子代成年鼠的心功能及肌层改变
实验组的后代小鼠在成年过程中超过一半(5/9) 出现不明原因的死亡,其中绝大部分发生在1月龄内(4/5)。两组子代小鼠在成年后(4月龄)通过心脏多普勒超声对心脏结构及功能的分析结果显示(图 4):孕期母体经大量酒精暴露的子代小鼠室间隔、左室后壁舒张期的心肌层明显增厚;舒张功能明显下降,但收缩功能无明显改变(表 1)。对临床诊断“心肌致密化不全”患儿(71例)的超声数据进行统计分析发现:41例患儿(39例左室,2例右室)呈室间隔/室后壁肌层增厚。动物模型在成年后的超声检查数据基本符合临床观测结果。
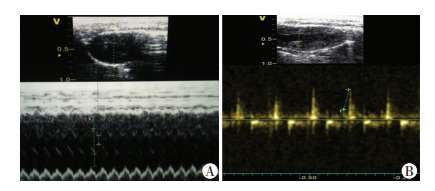
|
| 图 4 成年小鼠左室收缩(A)、舒张(B)功能超声表现 |
| 组别 | n | IVSd(mm) | LVIDd(mm) | LVPWd(mm) | LVIDS(mm) | EDV(μL) | ESV(μL) | n | EF(%) | FS(%) | SV(μL) | E峰(m/s) | A峰(m/s) | E/A比值 |
| 实验组 | 4 | 98.00±5.35 | 213.50±30.47 | 108.25±19.60 | 71.00±5.29 | 27.50±12.58 | 0 | 4 | 95.44±3.48 | 66.38±8.26 | 25.00±12.91 | 0.173±0.049 | 0.380±0.122 | 0.473±0.168 |
| 对照组 | 6 | 79.00±15.91 | 247.50±45.62 | 76.17±13.57 | 96.67±34.34 | 43.33±20.66 | 0.067±0.005 | 6 | 92.71±5.08 | 61.22±10.60 | 40.00±19.00 | 0.615±0.179 | 0.265±0.100 | 2.345±0.689 |
| t值 | -2.704 | 1.297 | -3.087 | 1.799 | 1.358 | 1.581 | -0.929 | -0.817 | 1.370 | 4.768 | -1.880 | 5.284 | ||
| P值 | 0.033 | 0.231 | 0.015 | 0.128 | 0.211 | 0.175 | 0.380 | 0.438 | 0.208 | 0.003 | 0.155 | 0.010 |
3 讨论
ROSS等[9]研究发现,孕期酒精暴露可致大鼠胚胎心脏发育延迟。多个研究中心发现:孕期酒精暴露可致子代先天性心脏畸形,包括先天性心脏病[10]及瓣膜发育不良[6]。本课题组前期研究[11]也发现:小鼠孕期(ED7.5~ED17.5) 酒精暴露(56%白酒, 5 mL/kg)可致心室压实肌层变薄,心肌缺压实明显。孕期酒精暴露致心脏畸形与心肌致密化不全的发病有共同的作用机制:Notch1、Nkx2.5等的蛋白表达水平下调[12-14]。这些结果均提示:孕期酒精暴露可能导致心肌致密化不全的发生。
酒精中的主要成分(乙醇)是脂溶性小分子,其及代谢物乙醛可以自由穿透胎盘屏障作用于胚胎鼠的各个靶器官[15],导致心脏的发育异常[6, 10]。酒精暴露在小鼠体内代谢的结果提示:暴露的酒精剂量越大,其体内的浓度越高;每次饮酒后需较长时间(3 h)代谢。分析不同剂量及干预时间段的雌鼠存活率后发现:当选取干预剂量为5.0 mL/kg,干预时间为ED3.5~ED19.5时可获得较好的存活率(均>50%),且可获得理想的怀孕率,从而保证实验组子代小鼠的数目,同时该干预剂量及时间段满足心脏致畸的最低浓度。在该动物模型构建过程中发现:孕期大量酒精暴露可致后代小鼠出生体质量明显减轻。回顾性分析重庆医科大学附属儿童医院2007-2015年期间诊断“心肌致密化不全”71例患儿的病历资料发现:低出生体质量儿(<2 500 g)占患儿人数的30.8%(20/65)。临床资料及动物模型均提示:心脏的心肌致密化不全样改变常合并生长发育不良,具体原因尚不明确。
线粒体是提供肌丝收缩、主动舒张所需能量的重要器官。肌浆网通过调控细胞内钙离子浓度来影响肌丝的活动能力。肌丝是心肌细胞实现舒缩功能的最基本的单位。线粒体溶解、肌浆网扩大及肌丝排列紊乱、溶解均可能引起心脏舒缩功能的减弱,甚至引起心肌细胞的活性下降而快速凋亡。心肌细胞的凋亡可能引起心肌层结构的改变。另外,目前研究已明确心肌致密化不全的发生与心肌细胞以下结构蛋白的异常表达有关[16]:(1) 肌小节相关基因:ACTC1/MYBPC3/MYH7/TNNI3/TNNT2/TPMI;(2) 肌浆网相关基因:CASQ2;(3) 钠钾离子通道相关基因:SCN5A;(4) Z盘相关基因:LDB3;(5) 细胞桥粒相关基因:DSP;(6) 细胞核相关基因:LMNA/NKX2.5;(7) 细胞质相关基因:MIB1/YWHAE等。孕期酒精暴露可能通过调控以上与心肌致密化不全发病相关基因的异常表达致病。光学显微镜下可观察到只有部分干预组的子代小鼠有心肌致密化不全样改变,且心脏变小,病变室腔明显扩大,与心肌致密化不全患者的解剖特点相符[7]。结合实验过程中观察到的现象:部分母鼠在灌酒后较早呈现出醉酒样步态等表现,且持续较久;另外部分母鼠醉酒样表现不明显或延迟,且症状消失较快。我们考虑:母鼠酒精代谢的能力可能影响子代心肌致密化不全的发病率及病变程度;可能少量饮酒并不会导致子代心肌致密化不全[17]。大量研究认为:心肌过度肌小梁化、心肌压实不足可能原因是心肌细胞的凋亡增加[18]。本课题组前期实验同样证实,酒精通过表观遗传可致与心脏发育相关基因(GATA4/D-hand/E-hand等)的异常表达[19]。其中,GATA4是心脏发育过程中的核心转录子[20], 该基因的异常表达可致心肌细胞发育异常。D-hang、E-hand基因分别是右、左心室肌正常发育的关键基因,其异常表达可致心室的结构异常[20]。此类基因的异常表达可引起心肌的发育异常,最终可能导致心肌致密化不全。因此,孕期酒精暴露也可能通过表观遗传的途径影响心脏发育过程核心转录子的正常表达从而导致心肌致密化不全的发生。另外,本动物模型成年发现室间隔/室后壁肌层增厚符合临床观测结果。室间隔/室后壁肌层增厚的原因目前尚不明确,部分尸体解剖的结果认为:系成年后非致密心肌间纤维组织增生所致[7]。在临床上,大部分心肌致密化不全的患者(尤其是年长儿)常伴有心脏舒缩功能的下降,且以收缩功能下降为主。在本模型的超声数据中,可观察到舒张功能的明显下降,但无收缩功能的改变。原因可能是:心肌致密化不全致收缩功能下降的小鼠病情可能较重,多数在成年过程中可能已经死亡,而只有舒张功能下降的小鼠因病情较轻而得以存活并成年[21]。且实验过程中也发现:实验组后代小鼠在成年过程中有55.6%(5/9) 出现不明原因的死亡。临床上,心肌致密化不全合并有严重心功能衰竭的患儿常在成年过程中死亡[22], 与本实验中动物模型所观察到的现象相符。
本研究从多角度探讨孕期酒精暴露可致心肌致密化不全样改变的可能性。目前心肌致密化不全缺乏特征性的治疗手段,发病机制尚不明确。部分有明确家族史病例的发病机制多考虑系心肌发育相关的基因突变所致。散发病例的致病危险因素缺乏临床流行病学调查资料,也尚少见孕期毒物暴露致心肌致密化不全的报道。本研究目的在于揭示孕期酒精暴露致心肌致密化不全样改变的可能性,从而为该病的预防提供全新的临床思路,也为该病散发病例的机制研究提供可能动物模型构建方法。该研究成果可能有利于降低心肌致密化不全的发病率。
实验过程中应注意:酒精灌胃容易因肺部误吸引起小鼠窒息而死,故干预前应多加练习避免该不当操作影响实验结果。本研究不足:(1) 缺乏大规模、设计严密的临床流行病学调查资料;(2) 样本量较小,结果未经大样本重复验证;(3) 实验结果尚未在其他物种重复验证。
志谢: 衷心感谢我的联合培养导师美国佛罗里达州大西洋大学黄旭培教授,以及美国俄亥俄州立大学刘振国教授、印第安纳州立大学寿伟年教授在我课题过程所给予的指导和帮助| [1] | MARON B J, TOWBIN J A, THIENE G, et al. Contemporary definitions and classification of the cardiomyopathies[J]. Circulation, 2006, 113(14): 1807–1816. DOI:10.1161/CIRCULATIONAHA.106.174287 |
| [2] | ZHANG W, CHEN H, QU X, et al. Molecular mechanism of ventricular trabeculation/compaction and the pathogenesis of the left ventricular noncompaction cardiomyopathy(LVNC)[J]. Am J Med Genet C Semin Med Genet, 2013, 163C(3): 144–156. DOI:10.1002/ajmg.c.31369 |
| [3] | LIU X, LIU W L. Research progress of the left ventricular non-compaction cardiomyopathy[J]. Chinese Circulation Journal, 2016, 31(2): 198–200. DOI:10.3969/j.issn.1000-3614.2016.02.023 |
| [4] | SCHWEIZER P A, SCHROTER J, GREINER S, et al. The symptom complex of familial sinus node dysfunction and myocardial noncompaction is associated with mutations in the HCN4 channel[J]. J Am Coll Cardiol, 2014, 64(8): 757–767. DOI:10.1016/j.jacc.2014.06.1155 |
| [5] | KARUNAMUNI G, GU S, DOUGHMAN Y Q, et al. Using optical coherence tomography to rapidly phenotype and quantify congenital heart defects associated with prenatal alcohol exposure[J]. Dev Dyn, 2015, 244(4): 607–618. DOI:10.1002/dvdy.24246 |
| [6] | SARMAH S, MARRS J A. Complex cardiac defects after ethanol exposure during discrete cardiogenic events in zebrafish: prevention with folic acid[J]. Dev Dyn, 2013, 242(10): 1184–1201. DOI:10.1002/dvdy.24015 |
| [7] | JENNI R, OECHSLIN E, SCHNEIDER J, et al. Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction: a step towards classification as a distinct cardiomyopathy[J]. Heart, 2001, 86(6): 666–671. DOI:10.1136/heart.86.6.666 |
| [8] | PIGNATELLI R H, MCMAHON C J, DREYER W J, et al. Clinical characterization of left ventricular noncompaction in children: a relatively common form of cardiomyopathy[J]. Circulation, 2003, 108(21): 2672–2678. DOI:10.1161/01.CIR.0000100664.10777.B8 |
| [9] | ROSS C P, PERSAUD T V. Cardiovascular primordium of the rat embryo following in utero exposure to alcohol and caffeine[J]. Can J Cardiol, 1986, 2(3): 160–163. |
| [10] | SERRANO M, HAN M, BRINEZ P, et al. Fetal alcohol syndrome: cardiac birth defects in mice and prevention with folate[J]. Am J Obstet Gynecol, 2010, 203(1): 75–77. DOI:10.1016/j.ajog.2010.03.017 |
| [11] | PAN B, ZHU J, LV T, et al. Alcohol consumption during gestation causes histone3 lysine9 hyperacetylation and an alternation of expression of heart development-related genes in mice[J]. Alcohol Clin Exp Res, 2014, 38(9): 2396–2402. DOI:10.1111/acer.12518 |
| [12] | SAMSA L A, YANG B, LIU J. Embryonic cardiac chamber maturation: trabeculation, conduction, and cardiomyocyte proliferation[J]. Am J Med Genet C Semin Med Genet, 2013, 163C(3): 157–168. DOI:10.1002/ajmg.c.31366 |
| [13] | GUNDOGAN F, GILLIGAN J, QI W, et al. Dose effect of gestational ethanol exposure on placentation and fetal growth[J]. Placenta, 2015, 36(5): 523–530. DOI:10.1016/j.placenta.2015.02.010 |
| [14] | PENG C, ZHANG W, ZHAO W, et al. Alcohol-induced histone H3K9 hyperacetylation and cardiac hypertrophy are reversed by a histone acetylases inhibitor anacardic acid in developing murine hearts[J]. Biochimie, 2015, 113: 1–9. DOI:10.1016/j.biochi.2015.03.012 |
| [15] | HAGHIGHI POODEH S, SALONURMI T, NAGY I, et al. Alcohol-induced premature permeability in mouse placenta-yolk sac barriers in vivo[J]. Placenta, 2012, 33(10): 866–873. DOI:10.1016/j.placenta.2012.07.008 |
| [16] | FATKIN D, SEIDMAN C E, SEIDMAN J G. Genetics and disease of ventricular muscle[J]. Cold Spring Harb Perspect Med, 2014, 4(1): a021063.. DOI:10.1101/cshperspect.a021063 |
| [17] | NGUYEN V B, PROBYN M E, CAMPBELL F, et al. Low-dose maternal alcohol consumption: effects in the hearts of offspring in early life and adulthood[J]. Physiol Rep, 2014, 2(7): e12087. DOI:10.14814/phy2.12087 |
| [18] | SEDMERA D, PEXIEDER T, VUILLEMIN M, et al. Developmental patterning of the myocardium[J]. Anat Rec, 2000, 258(4): 319–337. DOI:10.1002/(ISSN)1097-0185 |
| [19] | ZHANG W, PENG C, ZHENG M, et al. Prenatal alcohol exposure causes the over-expression of DHAND and EHAND by increasing histone H3K14 acetylation in C57 BL/6 mice[J]. Toxicol Lett, 2014, 228(3): 140–146. DOI:10.1016/j.toxlet.2014.05.011 |
| [20] | NEILL C A. Genetics of congenital heart disease[J]. Annu Rev Med, 1973, 24: 61–66. DOI:10.1146/annurev.me.24.020173.000425 |
| [21] | BRESCIA S T, ROSSANO J W, PIGNATELLI R, et al. Mortality and sudden death in pediatric left ventricular noncompaction in a tertiary referral center[J]. Circulation, 2013, 127(22): 2202–2208. DOI:10.1161/CIRCULATIONAHA.113.002511 |
| [22] | XU Y M. Clinical features of 123 cases children with non-compaction cardiomyopathy[J]. Chinese Journal of Practical Pediatrics, 2010, 25(6): 472–77. |



