在临床工作中常有肝癌患者在治疗过程中或治疗后发生肿瘤的肝内或远处器官转移。虽然目前临床上可采用化疗栓塞、生物治疗等综合治疗措施进行干预,但肝癌患者的预后并未得到明显改善。一个重要的原因是肝癌复发转移的分子机制及调控网络仍未阐明。随着肝癌研究的逐步深入,学者发现肝癌是由一群功能异质性的突变细胞组成,其中小部分肝癌细胞具有自我更新和分化成为不同肝癌细胞的能力,即“肝癌干细胞(liver cancer stem cells,LCSCs)”[1]。LCSCs因高增殖、高成瘤力、低分化,以及有效地启动DNA应急反应和高表达耐药相关蛋白,能抵抗放、化疗,使其逃脱现有治疗的打击而存活,导致肝癌复发、转移、耐药,是导致肝癌侵袭转移的重要因素。COMMD7是一个可能在人肝脏肿瘤中发挥重要作用的基因,其在LCSCS侵袭转移中的作用少见报道。本研究拟在LCSCs中抑制COMMD7的表达水平,检测其对LCSCs侵袭转移能力的影响,探究其可能的分子机制。
1 材料与方法 1.1 细胞与试剂达氏修正依氏培养基(dulbecco’s modified eagle medium,DMEM)、胰蛋白酶、胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司,Lipofectamine 2000 reagent购自美国Invitrogen公司,青霉素-链霉素溶液购自碧云天公司,Transwell小室及Matrigel基质胶购自美国Corning公司,鬼笔环肽染色液购自美国Sigma公司,Western blot实验所需抗体:抗COMMD7(自备),抗E-cadherin、抗N-cadherin、抗Vimentin购自美国Abcam公司,抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)及二抗购自中杉金桥公司。
1.2 方法 1.2.1 LCSCs分选按照课题组成员先前报道的方法[2]完成,细胞已鉴定具有LCSCs的特性。
1.2.2 细胞培养与shRNA慢病毒转染胰酶消化对数生长期的LCSCs,制成2×105/mL细胞悬液,取1 mL接种于6孔板中。37 ℃、5% CO2培养箱培养待细胞融合度达到50%~70%后,利用shRNA慢病毒质粒进行转染,按课题组先前报道方法进行[3]。加入病毒悬液(10 μL/孔,37 ℃孵育过夜。孵育12 h,更换完全培养基代替含有病毒的培养基,过夜。细胞按1:3传代,完全培养基培养48 h后,加入含10 μg/mL嘌呤霉素的完全培养基进行筛选稳定克隆,每隔3 d换液(使用含10 μg/mL嘌呤霉素的完全培养基)直至挑选出抗性克隆,再进行扩增备用。按是否加入慢病毒进行转染,将实验细胞分为转染组和对照组。
1.2.3 LCSCs中COMMD7抑制效果分析弃原有培养基,裂解液和蛋白酶抑制剂混合溶液裂解细胞后收集细胞碎片及悬液,离心后取上清,沸水煮5 min使蛋白变性,10%十二烷基硫酸钠(dodecyl sulfate, sodium salt, SDS)-聚丙烯酰胺凝胶电泳分离分子量不同的蛋白质,通过半干法电转将蛋白印迹转移至聚偏氟乙烯(polyvinylidene fluoride, PVDF)膜,脱脂奶粉溶液封闭,一抗孵育过夜、二抗孵育,化学显色后曝光。抗COMMD7一抗稀释浓度为1:500,抗GAPDH一抗稀释比例为1:400。为进一步研究COMMD7抑制对LCSCs恶性生物学行为的影响,本研究拟分别采用粘附实验、Transwell侵袭转移实验以对比观察转染/未转染LCSCs侵袭转移能力的变化。
1.2.4 细胞粘附实验收集细胞,用1.5 mL含1% FBS DMEM培养基重悬1×105个细胞,接种至铺好胶原的12孔板表面让细胞贴壁,孵育2 h。磷酸缓冲液(phosphate buffer solution,PBS)冲洗去除未粘附的细胞,200倍倒置显微镜下计数贴壁细胞数目,每个孔随机取10个视野。
1.2.5 Transwell侵袭转移实验检测LCSCs侵袭转移能力Matrigel基质胶稀释后包被于Transwell小室上室面,放入37 ℃培养箱中30 min使其聚合为凝胶。收集细胞并计数,向已被覆Matrigel的Transwell上室加入含2×104个细胞的0.5 mL DMEM无血清培养基,下室中加入完全培养基,置入37 ℃,5% CO2培养箱中培养12 h,培养结束后吸净培养液,用棉签轻轻擦去上室内细胞和凝胶,-20 ℃预冷的甲醇固定20 min,0.1%结晶紫染色液于37 ℃染色30 min,PBS缓冲液轻洗2次后,100倍显微镜下随机取6个视野计数。体外迁移能力测定方法步骤与体外侵袭力测定相同,区别在于侵袭小室的滤膜不用Matrigel覆盖。
1.2.6 鬼笔环肽染色微丝是存在于真核细胞中的丝状结构,在细胞的粘附、运动、分裂等过程中扮演重要角色,不仅参与形成细胞的蛋白纤维网状体系,还能在多种微丝结合蛋白的组织下形成包括丝状伪足在内的多种结构[4]。将适量细胞接种于细胞爬片,培养12 h,预温的PBS缓冲液漂洗细胞,4%多聚甲醛固定5 min,1% BSA溶液封闭30 min,5 μg/mL鬼笔环肽染色50 min,PBS缓冲液洗涤后置于荧光显微镜下观察。
1.2.7 Western blot检测MET相关分子表达Western blot检测MET相关分子E-cadherin(抗体稀释比例1:100)、N-cadherin(抗体稀释比例1:500) 及Vimentin(抗体稀释比例1:500) 在细胞中的表达。
1.3 统计学处理计量资料数据以x±s表示,采用SPSS 14.0统计软件,对计量资料采用两样本t检验进行比较,检验水准:α=0.05。
2 结果 2.1 shRNA慢病毒转染可成功抑制LCSCs中COMMD7表达Western blot检测细胞中COMMD7的表达,结果显示,shRNA慢病毒转染后,转染组细胞内COMMD7的表达明显低于对照组(图 1),两组条带灰度值比较差异具有统计学意义[对照组与转染组为(1.51±0.08) vs (0.72±0.05),P < 0.05]。干扰效果满意。

|
| 1:对照组;2:转染组 图 1 Western blot检测两组细胞内COMMD7蛋白表达 |
2.2 抑制COMMD7可降低LCSCs侵袭转移能力
为检测COMMD7对LCSCs侵袭转移能力的影响,在COMMD7抑制的情况下进行粘附实验,结果显示,与对照组相比,转染组细胞中COMMD7的表达抑制能显著提高细胞粘附能力[(1.00±0.12),(2.35±0.20),P < 0.05];进而利用Transwell迁移与侵袭实验评估COMMD7抑制情况下LCSCs的迁移与侵袭能力,结果同样显示,抑制COMMD7的表达可显著减弱转染组细胞的迁移[(1.00±0.04),(0.24±0.03),P < 0.05]与侵袭能力[(1.00±0.05),(0.24±0.04),P < 0.05]。
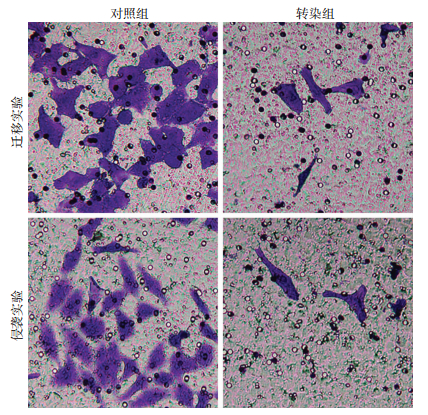
|
| 图 2 Transwell实验检测两组细胞迁移与侵袭能力(结晶紫×100) |
2.3 抑制COMMD7可诱导LCSCs形态学改变
通过鬼笔环肽染色发现,对照组细胞表面形成了大量的丝状伪足,而转染组表面未形成明显的伪足(图 3),说明转染组细胞的运动能力较对照组减弱,进而表明抑制COMMD7的表达可以减弱LCSCs的运动能力。
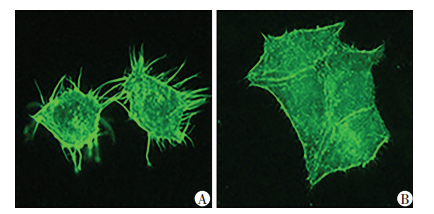
|
| A:对照组;B:转染组 图 3 异硫氰酸荧光素-鬼笔环肽染色检测两组细胞表面伪足变化(×200) |
2.4 抑制COMMD7可导致MET相关分子表达变化
EMT过程是恶性肿瘤细胞获得侵袭与转移能力的重要过程,利用Western blot检测EMT相关分子蛋白表达量,结果显示,同对照组进行比较,抑制COMMD7表达的转染组细胞内E-cadherin表达明显升高,而N-cadherin和Vimentin表达明显下降(P < 0.05,图 4),表明抑制COMMD7的表达可以抑制LCSCs的EMT过程,从而影响其获得侵袭与转移能力。
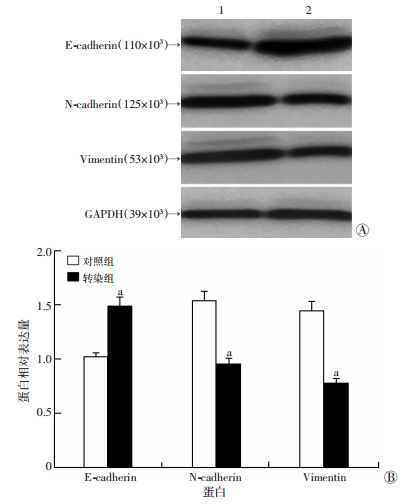
|
| 1:对照组;2:转染组A:Western blot检测结果;B:半定量分析a:P < 0.05, 与对照组比较 图 4 Western blot检测两组细胞内MET相关蛋白表达量 |
3 讨论
肝癌是我国最常见且恶性程度最高的恶性肿瘤之一,由于肝癌较高的转移及复发率,患者的预后普遍较差。近年对于肿瘤干细胞(cancer stem cells,CSCs)的研究提示,肿瘤干细胞因具有高成瘤、高转移能力及较强的放化疗抗性,极有可能是导致术后肿瘤复发的“元凶”[5]。再者,CSCs还可通过定向及多向分化,形成完整的实体肿瘤组织,因此,CSCs理应成为包括肝癌在内的多种肿瘤治疗的关键环节[6]。但就目前所知,针对CSCs并无有效的治疗方法。本研究拟探究促癌因子COMMD7能否对LCSCs的迁移侵袭能力产生影响,进而判断其是否具有成为LCSCs治疗靶点的潜能。
虽然COMMD蛋白家族已被发现十余年,但除了COMMD1被证实在胆汁铜排泄过程中起到重要作用[7],对其余COMMD蛋白的功能尚未有清晰认识。COMMD7是课题组在前期研究中通过抑制消减杂交技术,从肝癌临床标本中分离出的1条cDNA序列,相较于癌旁正常组织,该序列在肝癌组织中的表达量明显升高。近年来,课题组围绕COMMD7在肝癌中的作用展开了一系列研究,证明其是一个肝脏肿瘤的致癌因子,参与调控肝癌细胞的增殖、分化,与肝癌的侵袭性、转移性及患者预后有着紧密联系[8-10]。另一方面,利用基因芯片技术,对LCSCs和非干细胞特征肝癌细胞的差异基因进行筛选后,同样发现COMMD7基因在LCSCs中的表达量也显著上调,而在抑制LCSCs中COMMD7表达后发现其向成熟细胞分化并且成瘤性明显下降[3, 9]。因此推测,COMMD7有可能是一个在LCSCs也具有抑制侵袭转移作用的重要分子。
本研究通过shRNA抑制LCSCs中COMMD7的表达,在确认抑制效果后,分别进行细胞粘附实验及Transwell迁移侵袭实验,结果表明,COMMD7表达抑制能够显著提高LCSCs的粘附能力,并降低细胞的迁移侵袭能力,差异均具有统计学意义。同时,利用鬼笔环肽能够与微丝特异性结合的特性标记细胞伪足,染色结果显示对照组细胞表面可见大量伪足,而转染组细胞表面则未有明显伪足形成,细胞表面伪足数量的差异即可反映出转染组细胞运动能力随COMMD7表达抑制而显著下降。本研究结果表明,在LCSCs中抑制COMMD7的表达后,LCSCs的粘附能力得到明显增强,而迁移侵袭能力则显著降低。作为能够引起肝癌复发的重要细胞,LCSCs迁移侵袭能力的减弱将直接减小其离开原发病灶的机会,使肿瘤被局限后清除的可能性得以增加。
上皮细胞间充质转化(epithelial to mesenchymal transition,EMT)在胚胎发育,肿瘤发生、发展及侵袭转移中起到非常重要的作用,EMT不仅赋予肿瘤细胞以更强的侵袭和迁移能力[11],还可使肿瘤细胞具有干细胞的特性,并调控CSCs的转移能力[12],在肿瘤的发生、侵袭和转移中扮演重要角色。本研究在抑制COMMD7表达后,采用Western blot检测EMT相关分子表达量的变化,结果显示,转染组细胞中E-cadherin表达显著上升,而N-cadherin和Vimentin表达明显下调,差异均具有统计学意义,与转染组细胞迁移侵袭能力明显减弱相一致。对于EMT的研究相对较为广泛,而MET过程促使间质细胞在表型上向上皮细胞转化的研究仅仅在新近几年才开始引起人们关注,EMT产生的细胞表型可塑性说明了其相反过程MET的存在,EMT和MET呈动态转换过程,MET过程能否将LCSCs转化为侵袭转移能力较弱的细胞呢?E-cadherin的高表达能够拮抗肿瘤细胞侵袭和转移行为,而表达下调后可使肿瘤细胞与组织间的粘附能力降低,运动能力增加[13];N-cadherin和Vimentin都是正常表达于间叶组织中的重要分子,较高的表达量被认为具有促进肿瘤细胞转移的功能[14-15]。在本实验中,LCSCs迁移侵袭能力被显著抑制的同时,EMT分子标志物表达量也发生部分程度的逆向改变,共同表明COMMD7表达抑制能够调节EMT/MET平衡,促使EMT过程向MET发生转化,进而有效减弱LCSCs的侵袭转移特性。
本研究结果表明,抑制COMMD7表达可能通过MET过程减弱LCSCs侵袭与转移能力,并导致细胞出现低侵袭迁移能力的形态学变化。但是,诸如COMMD7还能与其他哪些影响侵袭转移的因子相互作用等问题还需要进一步探究。对LCSCs转移特性进行深入研究将有助于阐明肝癌的侵袭转移机制,为肝癌侵袭转移的防治提供实验基础,提升CSCs在肝癌治疗中的地位和作用。
| [1] | SUN J H, LUO Q, LIU L L, et al. Liver cancer stem cell markers: progression and therapeutic implications[J]. World J Gastroenterol, 2016, 22(13): 3547–3557. DOI:10.3748/wjg.v22.i13.3547. |
| [2] | LIU W H, WANG X, YOU N, et al. Efficient enrichment of hepatic cancer stem like cells from a primary rat HCC model via a density gradient centrifugation centered method[J]. PLoS One, 2012, 7(4): e35720. DOI:10.1371/journal.pone.0035720. |
| [3] | YOU N, ZHENG L, LIU W, et al. Proliferation inhibition and differentiation induction of hepatic cancer stem cells by knockdown of BC047440: a potential therapeutic target of stem cell treatment for hepatocellular carcinoma[J]. Oncol Rep, 2014, 31(4): 1911–1920. DOI:10.3892/or.2014.3043. |
| [4] | FIFE C M, MCCARROLL J A, KAVALLARIS M. Movers and shakers: cell cytoskeleton in cancer metastasis[J]. Br J Pharmacol, 2014, 171(24): 5507–5523. DOI:10.1111/bph.12704. |
| [5] | MAGEE J A, PISKOUNOVA E, MORRISON S J. Cancer stem cells: impact, heterogeneity, and uncertainty[J]. Cancer Cell, 2012, 21(3): 283–296. DOI:10.1016/j.ccr.2012.03.003. |
| [6] | YAMASHITA T, WANG X W. Cancer stem cells in the development of liver cancer[J]. J Clin Invest, 2013, 123(5): 1911–1918. DOI:10.1172/JCI66024. |
| [7] | ZHENG L, LIANG P, LI J, et al. ShRNA targeted COMMD7 suppresses hepatocellular carcinoma growth[J]. PLoS One, 2012, 7(9): e45412. DOI:10.1371/journal.pone.0045412. |
| [8] |
王峥, 郑璐, 黄小兵, 等. 慢病毒介导BC047440基因沉默逆转HepG2/ADM细胞化疗耐药性机制的探讨[J].
第三军医大学学报, 2012, 34(8): 705–709.
WANG Z, ZHENG L, HUANG X B, et al. Mechanism underlying drug resistance of HepG2/ADM cells silently reversed by lentivirus mediated BC047440 gene during chemotherapy[J]. J Third Mil Med Univ, 2012, 34(8): 705–709. |
| [9] | ZHENG L, LIANG P, ZHOU J, et al. BC047440 antisense eukaryotic expression vectors inhibited HepG2 cell proliferation and suppressed xenograft tumorigenicity[J]. Braz J Med Biol Res, 2012, 45(2): 97–103. DOI:10.1590/S0100-879X2012007500001 |
| [10] | YOU N, LI J, HUANG X, et al. COMMD7 promotes hepatocellular carcinoma through regulating CXCL10[J]. Biomed Pharmacother, 2017, 88: 653–657. DOI:10.1016/j.biopha.2017.01.046. |
| [11] | SMITH B N, BHOWMICK N A. Role of EMT in metastasis and therapy resistance[J]. J Clin Med, 2016, 5(2): E17. DOI:10.3390/jcm5020017. |
| [12] | OTA I, MASUI T, KURIHARA M, et al. Snail induced EMT promotes cancer stem cell like properties in head and neck cancer cells[J]. Oncol Rep, 2016, 35(1): 261–266. DOI:10.3892/or.2015.4348. |
| [13] | CANEL M, SERRELS A, FRAME M C, et al. E cadherin integrin crosstalk in cancer invasion and metastasis[J]. J Cell Sci, 2013, 126(Pt 2): 393–401. DOI:10.1242/jcs.100115. |
| [14] | NGUYEN T, MEGE R M. N Cadherin and fibroblast growth factor receptors crosstalk in the control of developmental and cancer cell migrations[J]. Eur J Cell Biol, 2016, 95(11): 415–426. DOI:10.1016/j.ejcb.2016.05.002. |
| [15] | BRZOZOWA M, WYROBIEC G, KOLODIEJ I, et al. The aberrant overexpression of vimentin is linked to a more aggressive status in tumours of the gastrointestinal tract[J]. Prz Gastroenterol, 2015, 10(1): 7–11. DOI:10.5114/pg.2014.47502. |



