乙型肝炎病毒(hepatitis B virus,HBV)简称乙肝病毒,属于嗜肝双链DNA病毒,HBV基因组含4个开放阅读框,编码HBV的全部已知蛋白,包括HbsAg、HbcAg、病毒聚合酶和HBx蛋白。HBV基因组在宿主细胞中可合成共价闭合环状DNA(covalently closed circular, cccDNA), 作为病毒复制的模板稳定存在, 是HBV持续感染的关键因素。肝细胞感染HBV后,可向外分泌含HBV DNA分子的Dane颗粒。Dane颗粒是42nm的具有感染性的完整HBV颗粒,由外模和核衣壳组成,HBsAg为核衣壳包膜成分,HBcAg为其核衣壳内核组成部分。与HBsAg、HBcAg不同,HBeAg是可检测的可溶性蛋白[1]。HBV感染在世界范围内广泛流行,严重危害人民健康,也是全球严重的健康问题之一[2-3]。据估计,全球有3.5亿~4亿人慢性感染HBV,每年有50万~120万人死于肝硬化、原发性肝癌等HBV感染引起的肝脏疾病[4-5]。目前,HBV的致病机制尚不完全清楚,现有抗病毒治疗方法不能根除HBV生活周期中的cccDNA,存在用药时间长、副作用多、花费大等问题[6-7]。因此,认识HBV的致病机制,寻找新的治疗方法迫在眉睫。
越来越多的研究表明微小RNA(microRNAs,miRNAs)不仅是机体固有免疫应答的重要组成部分,也是病毒抵抗宿主免疫应答的重要组成部分[8-9]。它们可与靶基因mRNA 3′非翻译区(3′UTR)或者5′端非翻译区(5′UTR)不完全互补配对结合,促进靶基因mRNA降解或者抑制其翻译,从而调控靶基因的表达,miRNA形成复杂的转录后调控网络调节多种细胞进程[10]。miR-146a是一种与炎症密切相关的miRNA,主要起负性调节固有免疫应答、炎症反应及抗病毒的作用[8-9, 11-12]。已有研究证实,miR-146a可通过TRAF6和IRAK1负性调节免疫细胞的激活[13]。目前关于miR-146a与HBV相互作用鲜有报道。本研究通过芯片和RT-PCR检测发现miR-146a在HBV存在状态HepG2.2.15细胞和亲本细胞HepG2中的表达差异,利用过表达和干预技术研究miR-146a对HBV生活周期的影响,双荧光素酶报告实验研究miR-146a与靶基因HS3ST3B1的相互作用,探讨miR-146a影响HBV生活周期的可能机制。
1 材料与方法 1.1 主要试剂和仪器 1.1.1 实验细胞HepG2.2.15细胞是由HepG2细胞以头尾相连的方式转染HBV二倍体得到,该细胞支持HBV复制,能分泌Dane颗粒至上清液中,是研究HBV复制和生活周期较为理想的细胞模型[14]。
1.1.2 主要试剂DMEM培养基、胎牛血清购自美国HyClone公司;miR-146a mimic及其对照miR-146a NC mimic、miR-146a inhibitor和对照miR-146a NC inhibitor由广州锐博生物科技有限公司合成。miR-146a引物、U6引物、miRNA特异性逆转录试剂盒及RT-PCR试剂购自广州易锦生物技术有限公司;TRIzol Reagent购自美国Ambion公司;逆转录试剂盒、Dual-Glo Luciferase Assay System购自美国Promega公司;SYBR Green试剂盒购自日本TaKaRa公司;HBsAg和HBeAg ELISA检测试剂盒购自上海科华生物工程有限公司;细胞总蛋白提取试剂盒购自江苏凯基生物技术股份有限公司;小鼠抗人HBcAg抗体购自英国Abcam公司;羊抗-HS3ST3B1多克隆抗体购自美国Santa Cruz公司;鼠抗GAPDH单抗、二抗兔抗羊IgG、二抗羊抗鼠IgG和二抗马抗小鼠IgG抗体二抗购自北京中杉金桥生物公司;LipofectamineTM 2000购自美国Invitrogen公司。蛋白胨、酵母提取物购自英国OXOID公司。限制性内切酶、Phusion DNA聚合酶、连接反应液、普通DNA聚合酶购自美国Thermo公司。TIANprep Mini Plasmid Kit质粒小提试剂盒、Universal DNA Purification Kit DNA纯化回收。试剂盒、DH5α感受态细胞购自天根生化科技(北京)有限公司。氨苄青霉素Amplicillin购自美国Sigma公司。
1.2 方法 1.2.1 细胞培养HepG2、293T细胞培养于含10%胎牛血清的DMEM培养基中。HepG2.2.15细胞培养基中另外加入筛选抗生素G418。
1.2.2 miRNA芯片采用博奥公司晶芯哺乳动物miRNA芯片(Version 3.0) 比较HepG2.2.15和HepG2中miRNA表达水平。
1.2.3 RT-PCR检测TRIzol提取细胞总RNA,逆转录成cDNA,以cDNA或DNA为模板按SYBR Green试剂盒说明书进行操作。miR-146a及内参U6引物由易锦基因设计合成,引物序列号分别为HmiRQP0196和HmiRQP9001,反应程序为95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸10 s,重复45个循环,25 ℃降温30 s。HBV DNA引物序列为上游:5′-ACCGACCTTGAGGCATACTT-3′, 下游: 5′-GCCTACAGCCTCCTAGTACA-3′;β-actin引物序列为上游:5′-CACACCCGCCACCAGTTCG-3′,下游: 5′-GTCCTTCTGACCCATTCCCACC-3′;HS3ST3B1引物序列上游:5′-AGTTCTACCGGCCTTTCAACCTCAAGT-3′,下游:5′-AGCTCAGCGTTCCTACGAGGTACACAG-3′。反应条件:95 ℃预变性10 min, 95 ℃变性20 s,60 ℃退火30 s,循环40次。每组设置3个复孔。
1.2.4 ELISA检测收集培养基上清液,按上海科华ELISA试剂盒说明书检测细胞HBsAg、HBeAg水平。
1.2.5 Western blot检测采用凯基总蛋白提取试剂盒提取细胞总蛋白,BCA法测蛋白浓度,每孔蛋白上样量为50 μg,12% SDS-PAGE电泳,电转至PVDF膜,5%脱脂牛奶封闭1 h,分别加入小鼠抗人HBcAg(1:10 000)、羊抗HS3ST3B1多抗(1:500) 和鼠抗GAPDH单抗(1:1000),4 ℃过夜,TBST洗膜,再分别加入马抗小鼠IgG抗体(1:7 000)、兔抗羊IgG(1:10 000) 及羊抗鼠IgG(1:10 000),TBST洗膜后ECL试剂盒化学发光,凝胶成像系统显影。
1.2.6 质粒构建对基因HS3ST3B1及载体pmiR-RB-REPORTTM双荧光素酶报告基因进行序列分析,利用XhoⅠ、NotⅠ两个限制性内切酶将目的基因片段克隆到载体中。所用载体的报告荧光素酶基因为hRluc,校正荧光素酶基因为hluc (做内参校正)。将HS3ST3B1基因的序列克隆至hRluc基因下游作为hRluc的3′UTR,制备成HS3ST3B1 3′UTR双报告基因野生型载体质粒。HS3ST3B1 3′UTR双报告基因突变型载体质粒在野生型载体基础上将HS3ST3B1基因中序列AGTTCTC突变为TCAAGAG。将构建的质粒送广州市锐博生物科技有限公司测序鉴定。
1.2.7 双荧光素酶报告系统接种对数期293T细胞于96孔板中,采用LipofectamineTM2000分别共转染miR-146a mimic和HS3ST3B1 3′UTR双报告基因野生型载体质粒或者突变型载体质粒,每组设3个复孔,转染后48 h按Dual-Glo Luciferase Assay System说明书测定培养基荧光值。结果以报告基因荧光值与内参基因荧光值比值计算。
1.3 统计学分析统计学处理采用SPSS 17.0统计软件,每组实验至少重复3次,实验数据以x±s表示。两组间比较采用两个独立样本t检验。检验水准:α=0.05。
2 结果 2.1 miRNAs在HepG2.2.15中的表达差异分析利用miRNA芯片比较HBV稳定整合细胞系HepG2.2.15与亲本细胞HepG2之间表达差异,发现72条miRNAs表达有差异,包括Let-7家族、miR-29a、miR-146a等, 其中27条上调,45条miRNAs下调(表 1)。3次独立重复RT-PCR实验显示:miR-146a在HepG2.2.15细胞(1.55±0.13) 中表达水平明显高于HepG2细胞(1.00±0.01),差异具有统计学意义(P < 0.05),提示miR-146a可能与HBV感染有关。
| miRNAs名称 | 变化倍数 | miRNAs名称 | 变化倍数 |
| hsa-miR-21 | 2.036352041 | hsa-miR-130a | -2.04421801 |
| hsa-miR-518d | 2.102040816 | hsa-miR-663 | -2.06121096 |
| hsa-miR-146a | 2.388682746 | hsa-miR-500 | -2.15985671 |
| hsa-miR-29a | 2.452380952 | hsa-miR-662 | -2.17807246 |
| hsa-miR-16 | 2.596638655 | hsa-miR-486 | -2.18042071 |
| hsa-miR-596 | 2.62755102 | hsa-miR-107 | -2.22006472 |
| hsa-miR-191 | 2.702623907 | hsa-miR-188 | -2.25970874 |
| hsa-miR-497 | 2.835486713 | hsa-miR-520f-520c | -2.25970874 |
| hsa-miR-549 | 3.153061224 | hsa-miR-583 | -2.32117026 |
| hsa-miR-200b | 3.191987906 | hsa-miR-423 | -2.34692556 |
| hsa-miR-195 | 3.214613719 | hsa-miR-518f*-526a | -2.39027830 |
| hsa-miR-15a | 3.396682964 | hsa-miR-769-3p | -2.41272481 |
| hsa-miR-23a | 3.415816327 | hsa-miR-484 | -2.51856082 |
| hsa-miR-329 | 3.457004964 | hsa-miR-630 | -2.54370587 |
| hsa-let-7c | 3.473297819 | hsa-miR-23b | -2.64293420 |
| hsa-miR-652 | 3.678571429 | hsa-miR-184 | -2.75409290 |
| hsa-miR-15b | 3.801203879 | hsa-miR-519d | -2.82038835 |
| hsa-let-7i | 4.204081633 | hsa-miR-409-5p | -2.85436893 |
| hsa-miR-377 | 5.255102041 | hsa-miR-126 | -2.85436893 |
| hsa-miR-330 | 6.130577284 | hsa-miR-565 | -2.85436893 |
| hsa-miR-603 | 6.494161537 | hsa-let-7d | -2.85436893 |
| hsa-miR-574 | 6.510257646 | hsa-miR-324-5p | -2.93762136 |
| hsa-miR-26a | 8.408163265 | hsa-miR-492 | -2.93762136 |
| let-7a-e | 8.408163265 | hsa-miR-370 | -3.15404021 |
| hsa-miR-222 | 9.459183673 | hsa-miR-433 | -3.23495146 |
| hsa-miR-299-3p | 10.51020408 | hsa-miR-17-5p-106a | -3.30744336 |
| hsa-miR-96 | 12.06395716 | hsa-miR-455 | -3.33009709 |
| hsa-miR-629 | -3.46133244 | ||
| hsa-miR-20a | -3.72970874 | ||
| hsa-miR-365 | -5.70873786 | ||
| hsa-miR-203 | -5.70873786 | ||
| hsa-miR-527 | -5.80030059 | ||
| hsa-miR-657 | -6.15275081 | ||
| hsa-miR-122a | -6.60422617 | ||
| hsa-miR-520a | -7.29449841 | ||
| hsa-miR-193b | -8.56310682 | ||
| hsa-miR-421 | -10.70388352 | ||
| hsa-miR-608 | -10.91003231 | ||
| hsa-miR-34a | -11.41747572 | ||
| hsa-miR-142-5p | -11.41747572 | ||
| hsa-miR-18a | -14.16612727 | ||
| hsa-miR-215 | -19.029126362 | ||
| hsa-miR-138 | -20.29773447 | ||
| hsa-miR-299-5p | -24.73786398 | ||
| hsa-miR-194 | -748.32039487 |
2.2 高表达miR-146a后促进HBV复制与蛋白表达
在HepG2.2.15细胞中转染miR-146a mimic后,HBV DNA拷贝数及蛋白水平较对照组明显增高,差异有统计学意义(P < 0.05,图 1)。这一结果证实,miR-146a对HBV复制及蛋白表达具有促进作用,提示HBV可能通过上调miR-146a实现对宿主细胞的感染。

|
| A:RT-PCR检测HepG2.2.15细胞中转染miR-146a mimic后HBV复制水平;B:Western blot检测HepG2.2.15细胞中转染miR-146a mimic后HBc水平;C:ELISA检测HepG2.2.15细胞中转染miR-146a mimic后HBsAg水平;D:ELISA检测HepG2.2.15细胞中转染miR-146a mimic后HBeAg水平;1:转染miR-146a mimic组;2:对照组a:P < 0.05,与对照组比较 图 1 HepG2.2.15细胞过表达miR-146a后HBV复制水平和蛋白水平 |
2.3 抑制miR-146a的作用下调HBV复制水平和蛋白水平
在HepG2.2.15细胞中转入miR-146a inhibitor后,相应地,HBV DNA拷贝数和蛋白水平均明显下调,差异有统计学意义(P < 0.05,图 2)。进一步提示miR-146a对HBV复制和蛋白表达具有促进作用。

|
| A:RT-PCR检测HepG2.2.15细胞中干扰miR-146a水平后HBV DNA拷贝数;B:ELISA检测HepG2.2.15细胞中干扰miR-146a水平后HBeAg水平;C: ELISA法检测HepG2.2.15干扰miR-146a后HBsAg水平1:转染miR-146a mimic组,2:转染miR-146a inhibitor组,3:对照组a:P < 0.05,与对照组比较 图 2 HepG2.2.15细胞中干扰miR-146a水平后HBV复制和蛋白水平 |
2.4 miR-146a可能通过作用于HBV抑制因子HS3ST3B1促进HBV表达
利用MiRnada分析软件发现HS3ST3B1基因是miR-146a的潜在靶点之一。在前期研究中,课题组通过研究证实,HS3ST3B1是HBV抑制因子,其过表达可抑制HBV复制及蛋白表达[15]。在本研究中,HepG2.2.15细胞中miR-146a表达水平明显上调。因此,课题组推测miR-146a可能通过下调HS3ST3B1基因实现对HBV复制和蛋白表达的调控作用。构建含HS3ST3B1 3′UTR的报告质粒,利用双荧光素酶报告系统,进一步对miR-146a靶点进行验证。结果显示,双荧光素酶报告系统显示,过表达miR-146a组HS3ST3B1野生型载体报告基因荧光值较对照组明显下调(P < 0.05),突变预测靶位点后,过表达miR-146a组HS3ST3B1突变型载体报告基因荧光值与对照组无明显差异(P > 0.05,图 3)。这提示miR-146a可下调HS3ST3B1报告基因荧光值,当突变3′UTR种子序列时,该抑制作用消失, miR-146a可能与HS3ST3B1 3′UTR相互作用。
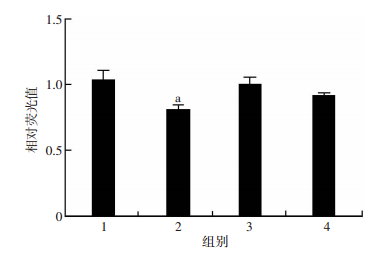
|
| 1:共转染HS3ST3B1野生型载体质粒和miR-146a NC mimic组(对照组),2:共转染HS3ST3B1野生型载体质粒和miR-146a mimic组,3:共转染HS3ST3B1突变型载体质粒和miR-146a NC mimic组(对照组),4:共转染HS3ST3B1突变型载体质粒和miR-146a mimic组a:P < 0.05,与共转染HS3ST3B1野生型载体质粒组和miR-146a NC mimic组比较 图 3 293T细胞中miR-146a对荧光素酶表达的影响 |
2.5 miR-146a促进HS3ST3B1蛋白表达, 对HS3ST3B1 mRNA水平无明显影响
在HepG2.2.15细胞中转入miR-146a mimic后,RT-PCR检测显示,与对照组相比,实验组HS3ST3B1 mRNA水平无明显变化,差异无统计学意义(P > 0.05,图 4A);Western blot检测结果显示,实验组HS3ST3B1蛋白表达水平较对照组明显下调(图 4B)。提示miR-146a可能在翻译水平调控HS3ST3B1基因表达。
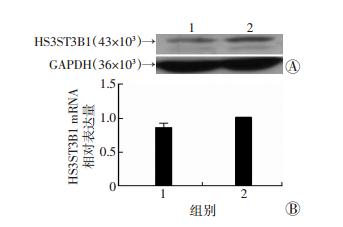
|
| A:Western blot检测结果;B:RT-PCR检测结果1:转染miR-146a mimic组,2:对照组 图 4 HepG2.2.15中转入miR-146a mimic后HS3ST3B1 mRNA和蛋白水平 |
3 讨论
本研究发现,在HBV稳定表达细胞模型HepG2.2.15中miR-146a表达水平较对照组明显上调,这与HOU等[16]的研究结果一致,说明HBV感染时慢性炎症或(和)病毒复制促进miR-146a转录,HBV上调miR-146a水平,使宿主内环境更适合HBV生存。进一步研究发现,miR-146a对HBV复制及蛋白表达具有促进作用,既往研究表明,miRNA可抑制机体抗病毒应答[17],在HBV感染中,miR-146a可能通过抑制机体抗病毒反应,促进HBV复制和蛋白表达。miRNA通过与靶基因mRNA 3′非翻译区(3′UTR)或者5′端非翻译区(5′UTR)不完全互补配对结合,促进靶基因mRNA降解或者抑制其翻译调控靶基因的表达[10]。通过生物信息学分析发现,HBV抑制因子HS3ST3B1为miR-146a的潜在靶点,构建含HS3ST3B1 3′UTR的双荧光素酶报告系统,发现miR-146a可下调HS3ST3B1报告基因荧光值,当突变3′UTR种子序列时,该抑制作用消失,提示HS3ST3B1是miR-146a靶点之一。进一步研究miR-146a对HS3ST3B1转录和翻译水平的影响,发现miR-146a对HS3ST3B1 mRNA水平无明显影响,但可抑制HS3ST3B1蛋白表达。即miR-146a可能通过作用于HS3ST3B1 3′UTR抑制HS3ST3B1翻译,降低细胞内HBV抑制因子HS3ST3B1水平促进HBV复制和蛋白表达,从而实现对HBV生活周期的影响。
HBV感染后,HBV基因组在肝细胞中整合导致细胞miRNA的表达水平发生变化[18]。许多研究已经证明了miRNA不仅是固有免疫应答的重要组成部分,其在宿主抗病毒反应中也发挥重要作用[8-9]。目前关于miR-146a在HBV感染中的作用研究主要在其免疫发病机制方面,且报道较少。WANG等[19]研究发现,慢性乙型肝炎病毒感染时,miR-146a在T细胞中表达上调并靶向作用于STAT1,导致T细胞功能受损从而抑制T细胞抗病毒应答;HOU等[20]报道,在HBV感染过程中,miR-146a靶向作用于RIG-I和RIG-G削弱细胞固有抗病毒免疫应答,沉默miR-146a是逆转HBV介导的免疫抑制的一个有效靶点。在HBV慢性感染中,miR-146a与宿主细胞间的相互作用尚少见报道。本研究发现miR-146a可能通过与宿主基因HS3ST3B1 3′UTR结合,在翻译水平降低HBV抑制因子HS3ST3B1蛋白水平影响HBV的生活周期。
综上所述,本研究证实miR-146a能影响HBV生活周期,研究发现miR-146a可能通过作用于HBV抑制因子HS3ST3B1 3′UTR抑制其翻译从而影响HBV生活周期。为基于从miRNA、宿主、病毒三者关系认识HBV的致病机制奠定了实验基础;MACHLIN等[21]研究发现靶向作用于microRNA-122的药物能明显抑制丙型肝炎病毒复制,本实验结果证实miR-146a影响HBV生活周期,为研发靶向作用于miR-146a的抗HBV药物提供了新思路。本实验在细胞层面研究了miR-146a、HS3ST3B1、HBV三者之间的关系,初步探讨了miR-146a与HS3ST3B1相互作用关系。由于存在伦理、手术创伤大、标本来源少等问题,获取临床HBV感染的肝脏组织困难,未检测HBV感染的肝脏组织中miR-146a表达情况,以及研究临床HBV感染时miR-146a、HS3ST3B1、HBV三者相互作用关系,后续进一步进行体内实验研究miR-146a、HS3ST3B1、HBV三者之间的关系,以期进一步加深病毒-宿主相互作用的认识,为研究新型抗HBV药物提供帮助。
| [1] | LAMONTAGNE R J, BAGGA S, BOUCHARD M J. Hepatitis B virus molecular biology and pathogenesis[J]. Hepatoma Res, 2016, 2: 163–186. DOI:10.20517/2394-5079.2016.05 |
| [2] | ZHANG C, ZHONG Y, GUO L. Strategies to prevent hepatitis B virus infection in China: immunization, screening, and standard medical practices[J]. Biosci Trends, 2013, 7(1): 7–12. |
| [3] | HOOFNAGLE J H, LAU D. New therapies for chronic hepatitis B[J]. J Viral Hepat, 1997, 4(Suppl 1): 41–50. DOI:10.1111/liv.13086 |
| [4] | EL-SERAG H B. Epidemiology of viral hepatitis and hepatocellular carcinoma[J]. Gastroenterology, 2012, 142(6): 1264–1273.e1. DOI:10.1053/j.gastro.2011.12.061 |
| [5] | BLUM H E. History and Global Burden of Viral Hepatitis[J]. Dig Dis, 2016, 34(4): 293–302. DOI:10.1159/000444466 |
| [6] | ZOULIM F, DURANTEL D. Antiviral Therapies and Prospects for a Cure of Chronic Hepatitis B[J]. Cold Spring Harb Perspect Med, 2015, 5(4). DOI:10.1101/cshperspect.a021501 |
| [7] | GISH R G, GIVEN B D, LAI C L, et al. Chronic hepatitis B: Virology, natural history, current management and a glimpse at future opportunities[J]. Antiviral Res, 2015, 121: 47–58. DOI:10.1016/j.antiviral.2015.06.008 |
| [8] | LIi L, CHEN X P, LI Y J. MicroRNA-146a and human disease[J]. Scand J Immunol, 2010, 71(4): 227–231. DOI:10.1111/j.1365-3083.2010.02383.x |
| [9] | SABA R, SORENSEN D L, BOOTH S A. MicroRNA-146a: a dominant, negative regulator of the innate immune response[J]. Front Immunol, 2014, 5: 578. DOI:10.3389/fimmu.2014.00578 |
| [10] | HAYES C N, CHAYAMA K. MicroRNAs as biomarkers for liver disease and hepatocellular carcinoma[J]. Int J Mol Sci, 2016, 17(3): 280. DOI:10.3390/ijms17030280 |
| [11] | REN J P, YING R S, CHENG Y Q, et al. HCV-induced miR146a controls SOCS1/STAT3 and cytokine expression in monocytes to promote regulatory T-cell development[J]. J Viral Hepat, 2016, 23(10): 755–766. DOI:10.1111/jvh.12537 |
| [12] | RUSCA N, MONTICELLI S. MiR-146a in Immunity and Disease[J]. Mol Biol Int, 2011, 2011: 437301. DOI:10.4061/2011/437301 |
| [13] | ZHAO J L, STARCZYNOWSKI D T. Role of microRNA-146a in normal and malignant hematopoietic stem cell function[J]. Front Genet, 2014, 9: 219. DOI:10.3389/fgene.2014.00219.eCollection2014 |
| [14] | SELLS M A, ZELENT A Z, SHVARTSMAN M, et al. Replicative intermediates of hepatitis B virus in HepG2 cells that produce infectious virions[J]. J Virol, 1988, 62(8): 2836–2844. |
| [15] | ZHANG Z, LIU X, CHEN J, et al. Heparin sulphate D-glucosaminyl 3-O-sulfotransferase 3B1 plays a role in HBV replication[J]. Virology, 2010, 406(2): 280–285. DOI:10.1016/j.virol.2010.07.030 |
| [16] | HOU Z H, HAN Q J, ZHANG C, et al. miR146a impairs the IFN-induced anti-HBV immune response by downregulating STAT1 in hepatocytes[J]. Liver Int, 2014, 34(1): 58–68. DOI:10.1111/liv.12244 |
| [17] | RIAZALHOSSEINI B, MOHAMED Z, APALASAMY Y D, et al. Association between microRNA-196A2 and microRNA-146A polymorphisms and progression to cirrhosis and hepatocellular carcinoma in patients with viral hepatitis B[J]. Pharmacogenet Genomics, 2016, 26(2): 74–79. DOI:10.1097/FPC.0000000000000187 |
| [18] | GUO L, YANG X, DUAN T. Altered microRNA expression profile in maternal and fetal liver of HBV transgenic mouse model[J]. J Matern Fetal Neonatal Med, 2012, 25(10): 2071–2077. DOI:10.3109/14767058.2012.678431 |
| [19] | WANG S, ZHANG X, JU Y, et al. MicroRNA-146a feedback suppresses T cell immune function by targeting Stat1 in patients with chronic hepatitis B[J]. J Immunol, 2013, 191(1): 293–301. DOI:10.4049/jimmunol.1202100 |
| [20] | HOU Z, ZHANG J, HAN Q, et al. Hepatitis B virus inhibits intrinsic RIG-I and RIG-G immune signaling via inducing miR146a[J]. Sci Rep, 2016, 6: 26150. DOI:10.1038/srep26150 |
| [21] | LINDOW M, KAUPPINEN S. Discovering the first microRNA-targeted drug[J]. J Cell Biol, 2012, 199(3): 407–412. DOI:10.1083/jcb.201208082 |



