颅脑计算机断层扫描(computed tomography, CT)表现低密度、磁共振成像(magnetic resonance imaging, MRI)表现长T1和长T2异常信号的大脑半球白质疏松(leukoaraiosis, LA),由Hachinski等[1]于1987年首次提出,是50岁以上人群比较常见的影像学改变,随年龄增长其发生率逐渐增加,国外报道60岁以上人群脑白质疏松检出率约为30%[2-3],国内报道60岁以上健康体检人员的检出率为35%[4]。越来越多的证据显示脑白质疏松与认知损害有关,普遍认为是血管性痴呆和Alzheimer病的独立危险因素[5-7]。然而,早期局部脑白质疏松(孤立性半卵圆区、侧脑室前角旁、后角旁或室体旁白质疏松)[2-8]是否对认知功能造成损害,以及不同部位脑白质疏松造成的认知损害特点仍然不十分清楚,迄今尚不能提出脑白质疏松所致认知损害的神经心理重点测评指标和测评方案,制约了认知损害的早期诊断和痴呆风险性的早期预测,由此也制约了对认知损害的早期积极干预。
Fazekas等[9]按病理解剖特点将脑白质疏松分为侧脑室旁白质损害(periventricular white matter lesions,PVWML)和深部白质损害(deep white matter lesions,DWML)。Defrancesco等[10]报道:侧脑室旁白质损害与认知加工速度减慢有关,而深部白质损害与视觉记忆减退有关;Ai等[11]研究认为:额叶白质损害与执行功能下降有关,枕叶白质损害与视觉空间认知功能和记忆减退有关。但是,关于脑白质疏松部位与认知损害及其特征的关联性迄今研究较少,以往研究纳入受试者往往同时存在多部位脑白质损害,研究结论的可靠性尚待进一步证实[12]。
本研究筛选孤立性侧脑室后角旁白质疏松(occipital periventricular leukoaraiosis,OPVL)受试者,应用神经心理量表评价其认知功能,与年龄、性别和受教育程度匹配且无脑实质结构性改变的受试者,以及混合型脑白质疏松(多部位脑白质疏松)患者比较,评估侧脑室后角旁白质疏松是否可能导致认知能力的减退,并初步探讨其认知损害特征。
1 对象与方法 1.1 研究对象在第三军医大学新桥医院神经内科于2015年4月至2016年12月收治的住院患者中,根据颅脑MRI检查结果筛选出30例仅有侧脑室后角旁3~13 mm范围损害的孤立性侧脑室后角旁白质疏松(后角组)、32例侧脑室旁和深部白质存在多部位白质疏松(混合组)以及33例颅脑MRI证实无脑实质结构性改变的受试者(对照组)。3组的影像学表现见图 1。
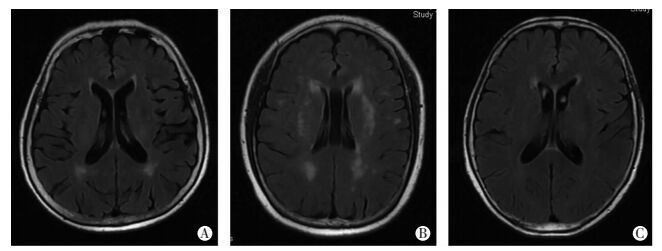
|
| A:后角组;B:混合组;C:对照组 图 1 各组受试者颅脑MRIFlair成像 |
纳入标准:① 年龄为55~82岁;② 文化程度:小学毕业及以上;③ 近1个月内未服用影响认知功能的药物;④ 无影响神经心理测评的疾病,包括严重听力减退、视力障碍以及感觉和运动功能障碍等;⑤ 无精神疾病史,且神经精神问卷(neuropsychiatric inventory, NPI)检查未发现幻觉、妄想或激越等精神症状;⑥ 日常活动能力无显著缺损,总体认知功能正常[简易精神状态量表(mini-mental state examination scale, MMSE)评分≥24 分] [13]。
排除标准:① 颅脑创伤、颅内感染、脑卒中、癫痫、炎性或中毒性脑病史等;② 严重内科疾病,如甲状腺功能减退、肝肾功能衰竭、急性心肌梗死、中重度贫血(Hb<90 g/L)或营养不良(体质量指数:女性<19,男性<20) 等;③ 物质依赖(药物或酒精);④ 汉密尔顿抑郁量表(HAMD-24项)诊断抑郁状态(评分≥20分)[14];⑤ 颅脑MRI检查发现存在脑梗死、腔隙状态或其他局灶病变。
本研究经第三军医大学新桥医院伦理委员会审查批准(2016026),所有受试者签署知情同意书。
1.2 神经心理测评患者入院后2周内,由经过专门培训的技术人员在相同安静环境下给予各项神经心理量表测评,测评人员对于受试者分组不知情。采用郭起浩等[13]收录的老年人认知功能减退知情者问卷(informant questionnaire on cognitive decline in the elderly, IQCODE)纵向了解受试者认知能力变化,MMSE和蒙特利尔认知评估量表(Montreal cognitive assessment, MoCA,北京版)评价总体认知功能(受教育程度≤12年的受试者MoCA总分增加1分),韦氏成人智力量表(Wechsler adult intelligence scale, WAIS)中数字广度测验(digit span test, DST)分项评估注意能力。临床记忆量表(clinical memory scale, CMS甲式)[15]评估记忆能力。此外,采用NPI和汉密尔顿抑郁量表以排除精神症状和抑郁状态。
1.3 统计学分析采用SPSS 19.0统计软件。年龄、受教育程度和各量表得分等计量资料以x±s表示。方差齐性时3组间比较行单因素方差分析,两组间比较行LSD检验;方差不齐时3组间比较采用非参数检验,两组间的比较采用所有成对比较。性别和脑血管病各危险因素等计数资料的组间比较行χ2检验, 检验水准:α=0.05。
2 结果 2.1 一般资料的组间比较后角组、混合组和对照组受试者的性别、年龄、受教育程度以及脑血管病等各危险因素的比较差异无统计学意义(P>0.05,表 1)。
| 组别 | n | 年龄(岁) | 男/女 | 受教育年限(年) | 危险因素(例) | IQCODE测评(分) | |||
| 高血压 | 糖尿病 | 高脂血症 | 高同型半胱氨酸 | ||||||
| 对照组 | 33 | 65.88±4.61 | 13/20 | 10.76±3.23 | 14 | 4 | 10 | 1 | 3.28±0.19 |
| 后角组 | 30 | 65.70±5.64 | 13/17 | 10.67±3.13 | 13 | 4 | 14 | 3 | 3.39±0.22 |
| 混合组 | 32 | 68.47±6.11 | 17/15 | 9.50±3.61 | 16 | 9 | 11 | 2 | 3.54±0.35a |
| P值 | 0.084 | 0.521 | 0.249 | 0.758 | 0.001 | ||||
| a: P<0.01,与对照组比较 | |||||||||
IQCODE测评方面,3组间比较差异有统计学意义(P<0.01)。后角组与混合组、对照组比较差异无统计学意义(P>0.05),混合组得分明显高于对照组(P<0.01,表 1)。
2.2 MMSE测评3组间比较,MMSE总分、定向力、短时记忆和语言测试差异有统计学意义(P<0.05,P<0.01)。
后角组和混合组与对照组比较,MMSE总分、定向力、短时记忆和语言能力得分显著降低(P<0.05,P<0.01),而即刻记忆和计算力评分差异无统计学意义(P>0.05,表 2)。
| 组别 | n | MMSE总分 | 定向力 | 即刻记忆 | 短时记忆 | 计算力 | 语言测试 |
| 对照组 | 33 | 28.21±0.99 | 9.85±0.36 | 2.97±0.17 | 2.33±0.74 | 4.36±0.86 | 8.70±0.47 |
| 后角组 | 30 | 26.30±1.97b | 9.57±0.50a | 2.90±0.31 | 1.60±1.00b | 4.03±1.13 | 8.20±0.71b |
| 混合组 | 32 | 26.22±1.29b | 9.47±0.80a | 2.88±0.34 | 1.59±0.98b | 4.00±1.14 | 8.28±0.77a |
| P值 | <0.001 | 0.036 | 0.366 | <0.001 | 0.307 | 0.007 | |
| a:P<0.05,b:P<0.01,与对照组比较 | |||||||
后角组与混合组比较,MMSE总分以及其他认知方面单项评分差异无统计学意义(P>0.05,表 2)。
2.3 MoCA测评3组间比较,MoCA总分、视觉空间与执行、语言测试、抽象和延迟记忆差异有统计学意义(P<0.01)。
后角组与对照组比较,MoCA总分、语言测试和延迟记忆力评分显著降低(P<0.05,P<0.01),而视觉空间与执行功能、命名、注意、抽象和定向力评分差异无统计学意义(P>0.05, 表 3)。
| 组别 | n | MoCA总分 | 视觉空间与执行 | 命名 | 注意 | 语言测试 | 抽象 | 延迟记忆 | 定向力 |
| 对照组 | 33 | 26.15±1.50 | 4.00±0.75 | 2.52±0.57 | 5.45±0.67 | 2.39±0.61 | 1.67±0.48 | 3.42±0.90 | 5.94±0.24 |
| 后角组 | 30 | 23.37±2.71b | 3.50±1.22 | 2.20±0.66 | 5.10±0.96 | 2.03±0.49a | 1.43±0.5c | 2.73±0.98bc | 5.73±0.45 |
| 混合组 | 32 | 21.25±3.19b | 2.88±1.13b | 2.12±0.91 | 4.84±1.08 | 1.97±0.65a | 1.00±0.67b | 1.94±1.01b | 5.66±0.65 |
| P值 | <0.001 | <0.001 | 0.122 | 0.063 | 0.008 | <0.001 | <0.001 | 0.063 | |
| a:P<0.05,b:P<0.01,与对照组比较;c: P<0.01,与混合组比较 | |||||||||
后角组与混合组比较,抽象和延迟记忆力评分显著提高(P<0.01),其他认知方面单项评分差异无统计学意义(P>0.05, 表 3)。
混合组与对照组比较,MoCA总分、视觉空间与执行功能、语言测试、抽象和延迟记忆单项评分均显著降低(P<0.05,P<0.01),其他认知方面单项评分差异无统计学意义(P>0.05, 表 3)。
2.4 数字广度测验3组间比较,数字广度总分差异有统计学意义(P<0.05),数字广度顺背和倒背单项评分无意义(P>0.05)。
后角组与对照组和混合组比较,数字广度测验总分差异无统计学意义(P>0.05,表 4)。
| 组别 | n | 数字广度顺背 | 数字广度倒背 | 数字广度总分 |
| 对照组 | 33 | 6.97±1.40 | 4.15±1.18 | 11.12±1.96 |
| 后角组 | 30 | 6.50±1.28 | 3.97±1.00 | 10.47±1.93 |
| 混合组 | 32 | 6.19±1.47 | 3.59±1.18 | 9.78±2.07a |
| P值 | 0.079 | 0.134 | 0.029 | |
| a:P<0.01,与对照组比较 | ||||
混合组与对照组比较, 数字广度测验总分显著降低(P<0.01,表 4)。
2.5 临床记忆量表测评后角组25例、混合组27例、对照组29例完成临床记忆量表测评。
3组间比较,记忆商、指向记忆、图像自由回忆和人像特点联系回忆差异有统计学意义(P<0.05,P<0.01)。
后角组与对照组比较,记忆商和指向记忆显著降低(P<0.05),其他分项评分差异无统计学意义(P>0.05, 表 5)。
| 组别 | n | 记忆商 | 指向记忆 | 联想记忆 | 图像自由回忆 | 无意义图像再认 | 人像特点联系回忆 |
| 对照组 | 29 | 90.31±9.17 | 11.79±2.96 | 15.31±3.56 | 13.69±4.86 | 14.14±6.43 | 18.34±4.24 |
| 后角组 | 25 | 83.32±14.59a | 9.44±4.01a | 15.28±5.13 | 11.36±4.85c | 12.12±8.11 | 17.60±6.21c |
| 混合组 | 27 | 77.85±12.6b | 8.78±4.37b | 13.63±3.7 | 8.44±4.09b | 12.26±4.70 | 13.11±3.6b |
| P值 | <0.001 | 0.010 | 0.084 | <0.001 | 0.347 | <0.001 | |
| a:P<0.05,b:P<0.01,与对照组比较;c:P<0.05,与混合组比较 | |||||||
后角组与混合组比较,图像自由回忆和人像特点联系回忆评分显著提高(P<0.05),其他分项评分差异无统计学意义(P>0.05, 表 5)。
混合组与对照组比较,记忆商、指向记忆、图像自由回忆和人像特点联系回忆评分均显著降低(P<0.01, 表 5)。
3 讨论脑白质疏松是常见于中老年人的与年龄增长相关的病理现象,与老年期认知功能减退有着密切关系。早期多为局灶性,逐渐进展累及半球广泛白质区域并导致严重认知损害。因此,探讨脑白质疏松对于认知功能的影响,尤其是局灶性脑白质疏松所致认知损害特点,才能早期识别脑白质疏松相关的认知障碍,并及时采取措施防止疾病的进展,以降低老年期痴呆的发生率。
本研究选择孤立性侧脑室后角旁白质疏松受试者,采用神经心理测评方法评价其注意、记忆和总体认知能力,与年龄、性别和受教育程度匹配的无脑器质性病变的对照受试者比较,结果发现孤立性侧脑室后角旁白质疏松即可导致认知能力的减退,主要累及定向力、记忆力和语言能力,而执行功能、视觉空间认知、计算力和注意力等方面无明显损害。
本研究侧重探讨侧脑室后角旁白质损害对认知功能的影响。有研究报道脑白质疏松主要造成执行、注意、认知加工速度和记忆能力的损害[7, 9, 11, 16-17],因而本研究选择成套神经心理测评量表(MMSE、MoCA),主要用于评估受试者是否存在认知损害,侧重评估注意力和记忆力,分别选用数字广度测验和临床记忆量表。不同于以往研究,本研究筛选孤立性侧脑室后角旁白质疏松受试者作为研究对象,避免了其他部位白质疏松或局灶性脑损伤对于神经心理测评结果的影响,获得结果能够更真实地反映后角旁白质损害的认知障碍特点。纳入年龄、性别、受教育程度和脑血管病主要危险因素匹配,且无脑实质结构性改变的受试者作为对照(对照组),避免了前述因素对于受试者认知功能的影响而干扰后角旁白质疏松所致认知损害及其特征的判断。本研究还纳入多部位脑白质疏松而其他方面匹配的受试者(混合组),发现其与对照组相比存在几乎涉及认知功能各方面的较显著的认知损害,表明脑白质疏松的进展和加重造成更广泛的认知功能障碍。后角组执行功能、视觉空间认知、抽象能力以及图像自由回忆和人像特点联系回忆等评分均显著高于混合组,而与对照组比较差异无统计学意义,表明后角组所表现出的定向力、记忆力和语言能力的减退确为其认知损害特征。
脑白质疏松最常见病因是脑实质内广泛小动脉硬化引起的慢性脑血流低灌注,早期多发生于缺血易损区域(侧脑室壁旁3~13 mm范围分水岭区,深穿支小动脉供应的半卵圆区), 可呈现为孤立性半卵圆区、侧脑室前角旁、后角旁或室体旁白质疏松[8]。本研究发现孤立性侧脑室后角旁白质疏松可能造成以定向力、记忆力和语言能力减退为特征的认知损害,其中记忆力损害以短时、延迟和指向记忆能力减退为主。本实验室以往采用fMRI的研究发现,与健康对照比较,孤立性侧脑室后角旁白质疏松受试者左侧岛叶和Heschl回皮质激活水平显著降低,而右侧缘上回、角回、颞中回和扣带回前部皮质体积减小,提示前述部位皮质功能可能受到损害[18-19]。而以往认知神经生理学研究已经证实,前述皮质部位是记忆和语言功能的重要中枢,或许由此可以解释孤立性侧脑室后角旁白质疏松导致记忆和语言能力的损害。Stenset等[20]报道顶、枕区室旁白质疏松与定向力损害密切相关,这与本研究“侧脑室后角旁白质疏松受试者定向力减退”的结果一致。究其神经机制,右侧顶、颞交界区(缘上回、角回)皮质功能与空间定向有关[21],而时间定向依赖于注意和记忆力[22],本课题组以往研究已经发现侧脑室后角旁白质疏松伴随右侧缘上回和角回皮质体积减小[19],而本研究发现后角旁白质疏松受试者记忆功能受损,与对照组比较注意力可能也存在损害(数字广度测验各项得分均低于对照组,但差异无统计学意义),这或许可以解释孤立性侧脑室后角旁白质疏松受试者的定向力障碍。至于脑白质疏松与皮质功能和结构改变的关系及其机制,目前存在两种学说:① 皮质继发损伤学说,认为白质病变导致顺行(或逆行)皮质神经元溃变,致使相应皮质结构和功能障碍[23];② 白质继发损伤学说,认为慢性脑血流低灌注导致皮质神经元丢失,继发轴突变性引起相应白质部位疏松[24]。确切的机制有待进一步研究阐明。
本研究发现孤立性侧脑室后角旁白质疏松导致以定向力、记忆力和语言能力减退为特征的认知功能损害,今后将扩大样本量并结合功能影像学技术手段进行研究,将有助于提高认知功能神经机制的认识,并为临床制定脑白质疏松相关认知损害神经心理测评方案奠定基础。
| [1] | Hachinski V C, Potter P, Merskey H. Leuko-araiosis[J]. Arch Neurol, 1987, 44(1): 21–23. DOI:10.1001/archneur.1987.00520130013009 |
| [2] | de Leeuw F E, de Groot J C, Achten E, et al. Prevalence of cerebral white matter lesions in elderly people: a population based magnetic resonance imaging study. The Rotterdam Scan Study[J]. Prevalence of cerebral white matter lesions in elderly people: a population based magnetic resonance imaging study. The Rotterdam Scan Study, 2001, 70(1): 9–14. DOI:10.1136/jnnp.70.1.9 |
| [3] | Breteler M M, van Swieten J C, Bots M L, et al. Cerebral white matter lesions, vascular risk factors, and cognitive function in a population-based study: the rotterdam study[J]. Neurology, 1994, 44(7): 1246–1252. DOI:10.1212/wnl.44.7.1246 |
| [4] |
彭超英, 解恒革, 李金梅. 脑白质疏松症相关因素的多因素回归分析[J].
中国康复理论与实践, 2009, 15(7): 650–651.
Peng C Y, Xie H G, Li J M. Related factors of leukoaraiosis: a multi-logistic regression analysis[J]. Chin J Rehab Theory Pract, 2009, 15(7): 650–651. DOI:10.3969/j.issn.1006-9771.2009.07.020 |
| [5] | Maillard P, Carmichael O, Fletcher E, et al. Coevolution of white matter hyperintensities and cognition in the elderly[J]. Neurology, 2012, 79(5): 442–448. DOI:10.1212/WNL.0b013e3182617136 |
| [6] | Hajjar I, Quach L, Yang F, et al. Hypertension, white matter hyperintensities, and concurrent impairments in mobility, cognition, and mood: the Cardiovascular Health Study[J]. Circulation, 2011, 123(8): 858–865. DOI:10.1161/CIRCULATIONAHA.110.978114 |
| [7] | Smith E E, Salat D H, Jeng J, et al. Correlations between MRI white matter lesion location and executive function and episodic memory[J]. Neurology, 2011, 76(17): 1492–1499. DOI:10.1212/wnl.0b013e318217e7c8 |
| [8] | Kim K W, MacFall J R, Payne M E. Classification of white matter lesions on magnetic resonance imaging in elderly persons[J]. Biol Psychiatry, 2008, 64(4): 273–280. DOI:10.1016/j.biopsych.2008.03.024 |
| [9] | Fazekas F, Chawluk J B, Alavi A, et al. MR signal abnormalities at 1.5 T in Alzheimer's dementia and normal aging[J]. AJR Am J Roentgenol, 1987, 149(2): 351–356. DOI:10.2214/ajr.149.2.351 |
| [10] | Defrancesco M, Marksteiner J, Deisenhammer E, et al. Impact of white matter lesions and cognitive deficits on conversion from mild cognitive impairment to Alzheimer's disease[J]. J Alzheimers Dis, 2013, 34(3): 665–672. DOI:10.3233/JAD-122095 |
| [11] | Ai Q, Pu Y H, Sy C, et al. Impact of regional white matter lesions on cognitive function in subcortical vascular cognitive impairment[J]. Neurol Res, 2014, 36(5): 434–443. DOI:10.1179/1743132814Y.0000000354 |
| [12] | Bolandzadeh N, Davis J C, Tam R, et al. The association between cognitive function and white matter lesion location in older adults: a systematic review[J]. BMC Neurol, 2012, 12: 126. DOI:10.1186/1471-2377-12-126 |
| [13] |
郭起浩. 神经心理评估[M]. 第2版. 上海: 上海科学技术出版社, 2016: 57-352.
Guo Q H. Neuropsychological assessment[M]. 2nd ed. Shanghai: Shanghai Science and Technology Press, 2016: 57-352. |
| [14] |
汤毓华, 张明园. 汉密顿抑郁量表(HAMD)[J].
上海精神医学, 1984, 4(2): 61–64.
Tang Y H, Zhang M Y. Hamilton depression scale(HAMD)[J]. Shanghai Archives of Psychiatry, 1984, 4(2): 61–64. |
| [15] |
"临床记忆量表"编制协作组. "临床记忆量表"的编制[J].
心理学报, 1986, 18(1): 100–108.
Collaborative group of the compilation of "Clinical memory scale". the preparation of "Clinical memory scale"[J]. Acta Psychologica Sinica, 1986, 18(1): 100–108. |
| [16] | Debette S, Markus H S. The clinical importance of white matter hyperintensities on brain magnetic resonance imaging: systematic review and meta-analysis[J]. BMJ, 2010, 341(26): c3666–c3666. DOI:10.1136/bmj.c3666 |
| [17] | Matthijs Biesbroek J, Kuijf H J, van der Graaf Y, et al. Association between subcortical vascular lesion location and cognition: a voxel-based and tract-based lesion-symptom mapping study. The SMART-MR Study[J]. PLoS One, 2013, 8(4): e60541. DOI:10.1371/journal.pone.006054 |
| [18] | Duan D, Shen L, Li C, et al. Memory impairment in occipital periventricular hyperintensity patients is associated with reduced functional responses in the insula and Heschl's gyrus[J]. Int J Neurosci, 2016: 1–8. DOI:10.1080/00207454.2016.1198345 |
| [19] | Duan D, Li C, Shen L, et al. Regional gray matter atrophy coexistent with occipital periventricular white matter hyper intensities[J]. Front Aging Neurosci, 2016, 8: 214. DOI:10.3389/fnagi.2016.00214 |
| [20] | Stenset V, Hofoss D, Berstad A E, et al. White matter lesion subtypes and cognitive deficits in patients with memory impairment[J]. Dement Geriatr Cogn Disord, 2008, 26(5): 424–431. DOI:10.1159/000165355 |
| [21] |
汤美慈. 神经心理学[M]. 北京: 人民军医出版社, 2001: 67-68.
Tang M C. Neuropsychology[M]. Beijing: People's Military Medical Publisher, 2001: 67-68. |
| [22] |
贾建平. 临床痴呆病学[M]. 北京: 北京大学医学出版社, 2007: 42-43.
Jia J P. Clinical dementia[M]. Beijing: Peking University Medical Press, 2007: 42-43. |
| [23] | Schmidt R, Ropele S, Enzinger C, et al. White matter lesion progression, brain atrophy, and cognitive decline: the Austrian stroke prevention study[J]. Ann Neurol, 2005, 58(4): 610–616. DOI:10.1002/ana.20630 |
| [24] | Wen W, Sachdev P S, Chen X, et al. Gray matter reduction is correlated with white matter hyperintensity volume: a voxel-based morphometric study in a large epidemiological sample[J]. Neuroimage, 2006, 29(4): 1031–1039. DOI:10.1016/j.neuroimage.2005.08.057 |



