胰十二指肠切除术(pancreatoduodenectomy, PD)是腹部外科中最为复杂的手术[1]。随着麻醉监护水平及外科医师手术技术的提高,PD术中死亡率已经显著降低,但术后并发症的高发生率仍然无法有效避免。胰瘘便是其中最为常见的严重并发症,其发生率仍高达5%~40%[2]。如何减少PD术后胰瘘的发生率,改善患者的预后情况仍然是外科医师的难题和关注的热点。既往有部分研究表明术前胰腺CT平扫值可预测PD术后胰瘘的发生风险[3-4]。但多为样本量较小的回顾性研究,且未将更多的术前指标及全身因素纳入研究中进行探讨。本研究回顾性分析了西南医院肝胆外科2013年1月至2015年12月期间408例住院行胰十二指肠切除术患者的完整病历资料,探讨胰十二指肠切除术后胰瘘发生的独立高危因素及胰体部CT值对PD术后胰瘘发生风险的预测价值。
1 资料与方法 1.1 一般资料本研究共分析了408例患者的完整病历资料,其中男性274例,女性134例。年龄14~82岁,平均54.6岁。术后病理证实包括胰腺导管腺癌285例,胃肠来源肿瘤81例,神经内分泌肿瘤13例,炎症性改变16例,胰腺乳头状瘤8例,浆液性囊腺瘤4例,腹膜后脂肪肉瘤1例。收集患者的一般情况、既往史(包括糖尿病史、高血压史、腹部手术史)、术前评估和实验室检查结果(包括血红蛋白、ALT、AST、总胆红素、白蛋白、GGT、ALP等)、术前影像学检查(包括影像学诊断、有无血管侵犯、皮下脂肪厚度、胰体部拟切除断面平扫期CT值等)、术中情况(包括手术耗时、术中出血量、胰腺质地软硬等)、术后情况(有无胰瘘、有无胆瘘、有无胃肠瘘等)。所有手术均由副教授以上职称医师主刀,均采用child术式重建消化道。
1.2 胰瘘的诊断标准及分级本研究中胰瘘的诊断及纳入标准采用国际胰瘘研究小组给予胰瘘的定义:术后第3天或之后,出现可计量的腹腔引流液,引流液淀粉酶含量高于血清淀粉酶含量的3倍,或经影像学检查有胰液外渗者。分级:A级,无明显临床表现,无需特殊处置,通畅引流即可痊愈;B级,有轻度临床表现,在谨慎对症处理、通畅引流及营养支持后多可痊愈;C级,有明显症状表现,伴或不伴有局部及全身感染,需要主动干预疾病进程,可能需要二次手术或相关处置,预后较差[5]。本研究据此标准将PD术后患者分为胰瘘组及非胰瘘组,并记录胰瘘患者的胰瘘分级。
1.3 术前胰体部拟切除断面平扫期CT Hu值的测量患者术前均采用双源64排螺旋CT(西门子, 德国)进行上腹部增强扫描,断层厚度5 mm。由一位完全不了解课题内容及患者信息的影像学医师在CT平扫图像上测量胰体部CT值。测量方法为:① 胰管正常患者:在胰腺最宽平面以肠系膜上动脉跨过胰腺处左侧取一椭圆形待测区,由计算机识别该区CT值。② 胰管扩张患者:测量扩张胰管上下部分的胰腺组织CT值,取二者平均值作为该平面的CT Hu值。上述操作均需避开胰管及脾动脉,并重复测量前后3个层面的数据取平均作为最终CT值。
1.4 统计学分析本研究采用SPSS 18.0软件进行统计分析,单因素分析采用χ2检验,多因素分析采用二分类Logistic回归分析。胰体部拟切除断面平扫期CT值与胰瘘之间的相关性采用简单线性相关分析。采用受试者工作特征(receiver operation characteristic, ROC)曲线下面积评价胰体部CT值对PD术后胰瘘的预测价值,以>0.9提示价值较高,0.7~0.9提示价值中等,>0.5且 < 0.7提示价值较低。检验水准α=0.05。
2 结果 2.1 术后胰瘘和其他并发症发生情况及转归本研究观察范围内(住院治疗期间)408例患者共发生PD术后胰瘘123例(30.14%),其中A级胰瘘55例(13.48%),B级胰瘘56例(13.73%),C级胰瘘12例(2.94%)。其中合并胆瘘15例(给予抗感染、补液、延长引流管安置时间等处理后13例痊愈,2例带引流管出院),合并胃肠瘘11例(给予禁食、补液、腹腔穿刺置管等对症处理后10例痊愈,2例因感染重自动出院后于院外死亡),合并术后出血33例(急诊均行开腹手术止血成功,术后给予双套管持续腹腔滴注冲洗、抗感染、抑制胰腺外分泌、补液等处理后32例痊愈,1例因经济原因放弃治疗)。其余二次手术19例,总计院内死亡5例。
2.2 单因素分析结果χ2检验结果显示PD术后胰瘘与患者BMI、术前γ-谷氨酰转肽酶、胰管直径、手术时间、胰腺质地软硬(术中判断)有关。而与性别、年龄等一般情况,糖尿病、高血压、腹部手术史等既往史,血红蛋白、白蛋白、总胆红素、ALT、AST、ALP等术前检验结果,手术方式、术中出血量等手术情况及肿瘤血管侵犯情况无统计学相关性,见表 1。
| 相关因素 | 例数 | 胰瘘发生[例(%)] | χ2 |
| 性别 | |||
| 男 | 274 | 85(31.02) | 0.303 |
| 女 | 134 | 38(28.36) | |
| 年龄(岁) | |||
| < 55 | 191 | 53(27.75) | 0.981 |
| ≥55 | 217 | 70(32.26) | |
| BMI(kg/m2) | |||
| < 25 | 312 | 78(25.00) | 7.773a |
| ≥25 | 96 | 45(46.88) | |
| 糖尿病史 | |||
| 无 | 361 | 111(30.75) | 0.537 |
| 有 | 47 | 12(25.53) | |
| 高血压史 | |||
| 无 | 346 | 98(28.32) | 3.595 |
| 有 | 62 | 25(40.32) | |
| 腹部手术史 | |||
| 无 | 324 | 101(31.17) | 0.786 |
| 有 | 84 | 22(26.19) | |
| 术前血红蛋白(g/L) | |||
| > 120 | 208 | 64(30.77) | 0.078 |
| ≤120 | 200 | 59(29.50) | |
| 术前白蛋白(g/L) | |||
| < 30 | 15 | 7(46.67) | 2.018 |
| ≥30 | 393 | 116(29.51) | |
| 术前总胆红素(μmol/L) | |||
| > 171 | 151 | 49(32.45) | 0.604 |
| ≤171 | 257 | 74(28.79) | |
| 术前ALT(U/L) | |||
| > 126 | 163 | 55(33.74) | 1.666 |
| ≤126 | 245 | 68(27.76) | |
| 术前AST(U/L) | |||
| > 126 | 134 | 37(27.61) | 0.609 |
| ≤126 | 274 | 86(31.39) | |
| 术前GGT(U/L) | |||
| > 150 | 266 | 89(33.46) | 3.98a |
| ≤150 | 142 | 34(23.94) | |
| 术前ALP(U/L) | |||
| > 342 | 191 | 61(31.94) | 0.546 |
| ≤342 | 217 | 62(28.57) | |
| 胰管直径(mm) | |||
| > 3 | 209 | 28(13.40) | 57.089 |
| ≤3 | 199 | 95(47.74) | |
| 胰体部CT值(Hu) | |||
| < 40 | 74 | 27(36.49) | 2.209a |
| ≥40 | 334 | 96(28.74) | |
| 手术方式 | |||
| PPPD | 124 | 36(29.03) | 0.105 |
| PD | 284 | 87(30.63) | |
| 手术时间(min) | |||
| < 360 | 166 | 41(24.7) | 3.945a |
| ≥360 | 242 | 82(33.88) | |
| 术中失血量(mL) | |||
| < 400 | 174 | 54(31.03) | 0.113 |
| ≥400 | 234 | 69(29.49) | |
| 胰腺质地软硬(术中判断) | |||
| 软 | 207 | 94(45.41) | 46.485a |
| 硬 | 201 | 29(14.43) | |
| 血管侵犯 | |||
| 无 | 354 | 112(31.64) | 2.825 |
| 有 | 54 | 11(20.37) | |
| a:P < 0.05 | |||
2.3 多因素分析结果
我们将χ2检验所得出的PD术后胰瘘危险因素纳入二分类Logistic回归分析中。结果显示患者BMI、胰管直径、胰腺质地软硬(术中判断)及胰体部CT值是PD术后胰瘘发生的独立高危因素。见表 2。
| 相关因素 | B | S.E. | Wald | EXP(B)(95%CI) |
| BMI(kg/m2)a | 0.186 | 0.185 | 2.013 | 1.504(1.826-2.733) |
| 术前GGT(U/L) | 0.140 | 0.287 | 0.324 | 0.449(0.633-2.102) |
| 胰管直径(mm)a | -0.386 | 0.179 | 4.662 | 1.685(1.455-1.983) |
| 胰体部CT值(Hu)a | -0.886 | 0.246 | 9.821 | 1.615(1.255-1.779) |
| 手术时间(min) | 0.046 | 0.216 | 0.039 | 1.021(0.597-1.652) |
| 胰腺质地软硬(术中判断)a | -0.480 | 0.223 | 4.997 | 2.519(2.069-2.959) |
| a:P < 0.05 | ||||
2.4 不同等级胰瘘组间胰体部CT值的比较
胰体部CT值在不同胰瘘等级组间的两两比较中差异有统计学意义(P < 0.01),轻度胰瘘的胰体部CT值高于重度胰瘘者,且胰体部CT值与胰瘘严重程度之间具有明显等级相关性(r=-0.288,P < 0.01),见表 3。
| 胰瘘程度 | 病例数(例) | 胰体部CT值(Hu) |
| A级 | 55 | 38.1±2.1 |
| B级 | 56 | 35.0±1.8a |
| C级 | 12 | 30.0±2.6ab |
| a:P < 0.05, 与A级比较;b:P < 0.05,与B级比较 | ||
2.5 胰瘘严重程度与胰体部CT值的相关性研究
我们按照“未发生胰瘘=0,A级胰瘘=1,B级胰瘘=2,C级胰瘘=3”进行赋值。通过简单线性相关分析发现,胰瘘严重程度与胰体部CT值呈负相关。
2.6 ROC曲线测试结果利用ROC曲线检测胰体部CT值对PD术后胰瘘发生风险的预测价值。结果显示胰体部CT值的ROC曲线下面积为0.714(95%CI为0.662~0.767,P < 0.01),具有中等预测价值。见图 1。
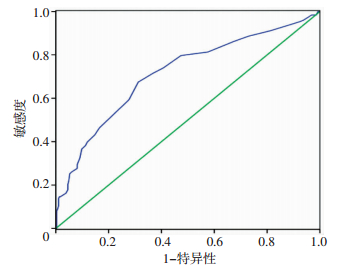
|
| 图 1 胰体部CT值的ROC曲线分析 |
3 讨论
胰瘘是胰十二指肠切除术后一项常见且严重的并发症,是导致患者继发其他并发症抑或死亡的重要原因之一[6]。目前研究发现,胰瘘发生的主要原因在于胰肠吻合口瘘和术中损伤正常胰腺组织被膜[7]。浙江大学的彭淑牖教授[8]认为捆绑式胰肠吻合术可以大幅度避免胰腺吻合口渗漏,是一种安全有效的胰肠吻合技术。Shubert等[9]认为,胰腺癌患者术前风险评估能够有效预测胰十二指肠切除术后的胰瘘发生率。而在临床相关因素分析中发现其可能与患者年龄、BMI、术前胆红素值、术中出血量、手术时间、胰腺质地软硬、主胰管的直径大小和术者胰肠吻合技术等有密切关系。本研究利用单因素及多因素统计学分析后发现BMI、胰管直径、胰体部CT值、胰腺质地软硬是PD术后胰瘘发生的高危因素。同时,胰体部CT值与PD术后胰瘘具有良好的相关性,可以作为反映胰腺质地的客观指标,结合术者术中的主观触摸判断,将大大提高对患者PD术后胰瘘风险的预测准确性,对指导围手术期治疗方案的制定具有重要意义。
3.1 BMI与胰瘘本研究表明BMI≥25 kg/m2是PD术后胰瘘的独立高危因素,这与Gaujoux等[10]在2010年对100例行PD术患者的回顾性分析所得出的结论一致。在本项研究中,BMI < 25 kg/m2有312例,其中发生胰瘘78例,胰瘘发生率为25%;BMI≥25 kg/m2有96例,其中发生胰瘘有45例,胰瘘发生率为46.88%,经卡方检验差异具有统计学意义(P < 0.01)。在多因素Logistic回归分析中发现BMI仍然是PD术后胰瘘的高危因素,且BMI≥25 kg/m2患者的术后胰瘘发生风险是BMI < 25 kg/m2患者的1.504倍,差异有统计学意义。我们认为其原因主要有:① 腹部脂肪及胰周脂肪的堆积,影响了胰腺组织的暴露,增加了手术难度;② 过多脂肪的干扰,在分离胰旁组织时将更容易损伤胰腺被膜;③ 肥胖将会影响胰腺组织质地,改变生理结构。
3.2 胰管直径与胰瘘多项国内外研究均认为胰管直径≤3 mm是PD术后胰瘘发生的高危因素[11-12]。Pratt等[13]通过研究发现胰管直径减小1 mm则胰瘘风险相应地增加68%。Akamatsu等[14]分析了122例行PD术患者的临床资料,统计后发现如果患者胰管直径与胰体部纵轴的比值大于1/5时术后胰瘘风险将大大降低。其原因可能是胰管直径大能够降低胰肠吻合手术难度,更便于缝合打结,且避免损伤到胰管;且胰管直径大有利于术后胰液引流,避免胰管阻塞、影响胰肠吻合口生长;另外,胰管直径大的胰腺通常存在胰腺组织纤维化导致合成的胰液量减少。考虑到以上因素,我们建议在可能的情况下放置胰管以充分引流胰液、降低胰管压力,避免胰管术后堵塞从而降低胰瘘发生风险。
3.3 胰腺质地软硬、胰体部CT值与胰瘘Brooks等[15]在1984年首次提出了胰腺质地较软是PD术后胰瘘的高危因素这一观点,随后的几项研究均证实了这一观点[16-17]。现该理论已经存在了三十多年,且被大多数专家学者所认可。在本研究中,我们同样发现了这一规律。在单因素及多因素分析中我们均可以看到胰腺质地软硬(术中判断)是PD术后胰瘘的独立高危因素。在207例胰腺质地软的病例中有97例发生了术后胰瘘,而在201例胰腺质地硬的病例中仅有29例发生了术后胰瘘。
目前而言,各大研究中的胰腺质地软硬均是根据术者的术中直接触摸主观判断,缺乏客观的评价体系。虽然已有部分文献报道利用CT值来预测PD术后胰瘘的风险性,但所纳入研究的病例数较少且尚无法形成科学的评价体系[3-4]。随着医学辅助检查手段的不断发展,CT已成为胰腺疾病诊断的主要手段,我院胰腺疾病患者术前均常规进行螺旋CT三期增强扫描。CT值是指射线穿过组织被机体吸收后的衰减值, 其临床意义通常代表密度,组织密度越高则CT值越大,正常人体胰腺组织CT值为40~54 Hu。根据这一特性,CT值在临床中通常用来测定体内组织的密度。虽然密度与硬度是否完全一致尚不能明确。但文献[18]报道胰腺质地软的胰体部CT值显著低于质地较硬者,差异有统计学意义(P < 0.05)。且在本项研究中,不论是单因素分析还是多因素分析,都强烈证明了术前胰体部平扫期CT值 < 40 Hu是PD术后胰瘘发生的独立高危因素。并且不同的胰瘘分级与术前胰腺组织平扫期CT值均具有相关关系,两者之间呈负相关。因此本研究同样认为胰腺CT值可反映胰腺的质地,但需要更深入的研究进一步明确其机制。而胰体部CT值除了同胰腺密度相关外,还能反映胰腺组织的其他一些信息。从组织学角度看,胰腺的CT值可以反映腺泡的数量和分泌能力,由于腺泡是分泌和储存胰液的场所, 而胰液在CT成像中呈低密度,因此腺泡丰富者胰腺组织的CT值也较低,可分泌更多的胰液。我院的增强CT检查前均要求患者空腹,这就消除了食物刺激对腺泡分泌水平差异的影响。因此可以认为,在同样的腺泡分泌水平下,胰腺CT值较低的患者其胰腺组织中的腺泡更为丰富,即胰液的分泌潜力更为旺盛。而此类患者术中缝合时更容易损伤腺泡导致单纯的胰液渗漏或术后因较多的胰液积蓄在吻合口周围使张力增高而造成吻合口瘘。从病理学的角度分析,当组织发生纤维化时其CT值将有所增高。有研究表明肝纤维化的严重程度与肝脏CT值呈正相关。王伟等[19]通过动物实验发现:家兔肺纤维化的程度越深肺部相应区域的CT值也越高。由此可推测当胰腺发生纤维化时,其CT值也会相应地增高。Kakita等[20]研究了胰腺残端的纤维化程度与术后胰腺外分泌功能和胰肠吻合缺陷的关系,发现胰腺纤维化程度与胰腺外分泌功能显著相关,是胰腺吻合口缺陷的重要因素。Bassi等[21]的前瞻性随机比较研究发现纤维化的胰腺吻合口漏发生率较低。因此CT值高于正常值者可能提示胰腺组织发生了纤维化,从而能大大降低术后胰瘘的发生风险。另外,当胰腺组织发生水肿、坏死或脂肪浸润时,其CT值均会相应下降,而这些病理改变都会影响胰肠吻合口的正常愈合。本研究对胰体部CT值行ROC曲线检测,结果显示ROC曲线下面积为0.714,对PD术后胰瘘具有中等预测价值。据此,我们认为胰体部CT值可以作为反映胰腺质地软硬的客观指标,从而预测PD术后胰瘘的风险。而且胰体部CT值可通过无创检查简易获取,如患者术前胰体部CT值 < 40 Hu应当列为术后胰瘘高危人群。该项指标可能对行PD手术的患者围手术期治疗方案的制定起到积极影响。
| [1] | Conzo G, Gambardella C, Tartaglia E, et al. .Pancreatic fistula following pancreatoduodenectomy.Evaluation of different surgical approaches in the management of pancreatic stump.Literature review[J]. Int J Surg, 2015, 21(Suppl 1): S4–S9. DOI:10.1016/j.ijsu.2015.04.088 |
| [2] | Seeliger H, Christians S, Angele M K, et al. Risk factors for surgical complications in distal pancreatectomy[J]. Am J Surg, 2010, 200(3): 311–317. DOI:10.1016/j.amjsurg.2009.10.022 |
| [3] |
陈和平, 邵伟新, 龙德云. 手术前计算机断层扫描对胰十二指肠切除术后患者发生胰瘘的预测价值[J].
世界华人消化杂志, 2015, 23(9): 1489–1494.
Chen H P, Shao W X, Long D Y. Value of preoperative computed tomography for prediction of pancreatic fistula after pancreaticoduodenectomy[J]. World Chinese Journal of Digestology, 2015, 23(9): 1489–1494. DOI:10.11569/wcjd.v23.i9.1489 |
| [4] |
翁昊, 束翌俊, 包润发, 等. 术前胰腺平扫CT值可预测胰十二指肠切除术后胰瘘危险性[J].
中华普通外科杂志, 2014, 29(1): 21–24.
Weng H, Shu Y J, Bao R F, et al. Preoperative pancreas plain scan CT value for the evaluation of the risk of postoperative pancreatic fistula[J]. Chin J Gen Surg, 2014, 29(1): 21–24. DOI:10.3760/cma.i.issn.1007-63lX.2014.01.006 |
| [5] | Vallance A E, Young A L, Macutkiewicz C, et al. Calculating the risk of a pancreatic fistula after a pancreaticoduodenectomy: a systematic review[J]. HPB(Oxford), 2015, 17(11): 1040–1048. DOI:10.1111/hpb.12503 |
| [6] | Hackert T, Büchler M W. Management of postoperative pancreatic fistula[J]. Chirurg, 2015, 86(6): 519–524. DOI:10.1007/s00104-015-0003-2 |
| [7] | El Nakeeb A, Salah T, Sultan A, et al. Pancreatic Anastomotic Leakage after Pancreaticoduodenectomy.Risk factors, Clinical predictors, and Management (Single Center Experience)[J]. World J Surg, 2013, 37(6): 1405–1418. DOI:10.1007/s00268-013-1998-5 |
| [8] | Peng S Y, Wang J W, Hong D F, et al. Binding pancreaticoenteric anastomosis: from binding pancreaticojejunostomy to binding pancreaticogastrostomy[J]. Updates Surg, 2011, 63(2): 69–74. DOI:10.1007/s13304-011-0067-6 |
| [9] | Shubert C R, Wagie A E, Farnell M B, et al. Clinical Risk Score to Predict Pancreatic Fistula after Pancreatoduodenectomy: Independent External Validation for Open and Laparoscopic Approaches[J]. J Am Coll Surg, 2015, 221(3): 689–698. DOI:10.1016/j.jamcollsurg.2015.05.011 |
| [10] | Gaujoux S, Cortes A, Couvelard A, et al. Fatty pancreas and increased body mass index are risk factors of pancreatic fistula after pancreaticoduodenectomy[J]. Surgery, 2010, 148(1): 15–23. DOI:10.1016/j.surg.2009.12.005 |
| [11] | Liu Q Y, Zhang W Z, Xia H T, et al. Analysis of risk factors for postoperative pancreatic fistula following pancreaticoduodenectomy[J]. World J Gastroenterol, 2014, 20(46): 17491–17497. DOI:10.3748/wjg.v20.i46.17491 |
| [12] | Yang Y M, Tian X D, Zhuang Y, et al. Risk factors of pancreatic leakage after pancreaticoduodenectomy[J]. World J Gastroenterol, 2005, 11(16): 2456–2461. DOI:10.3748/WJG.v11.i16.2456 |
| [13] | Pratt W B, Callery M P, Vollmer C M Jr. Risk prediction for development of pancreatic fistula using the ISGPF classification scheme[J]. World J Surg, 2008, 32(3): 419–428. DOI:10.1007/s00268-007-9388-5 |
| [14] | Akamatsu N, Sugawara Y, Komagome M, et al. Risk factors for postoperative pancreatic fistula after pancreaticoduodenectomy: the significance of the ratio of the main pancreatic duct to the pancreas body as a predictor of leakage[J]. J Hepatobiliary Pancreat Sci, 2010, 17(3): 322–328. DOI:10.1007/s00534-009-0248-6 |
| [15] | Brooks J R, Culebras J M. Cancer of the pancreas.Palliative operation, Whipple procedure, or total pancreatectomy?[J]. The American Journal of Surgery, 1976, 131(4): 516–520. DOI:10.1016/0002-9610(76)90167-7 |
| [16] | Yeo C J, Cameron J L, Lillemoe K D, et al. Does prophylactic octreotide decrease the rates of pancreatic fistula and other complications after pancreaticoduodenectomy? Results of a prospective randomized placebo-controlled trial[J]. Ann Surg, 2000, 232(3): 419–429. DOI:10.1097/00000658-200009000-00014 |
| [17] | Robinson J R, Marincola P, Shelton J, et al. Perioperative risk factors for delayed gastric emptying following pancreaticoduodenectomy[J]. HPB, 2015, 17(6): 495–501. DOI:10.1111/hpb.12385 |
| [18] |
彭淑牖, 刘颖斌. 胰十二指肠切除术胰肠吻合口漏的防治措施[J].
临床外科杂志, 2004, 12(4): 199–200.
Peng S Y, Liu Y B. Prevention and treatment of pancreatic and intestinal anastomotic leakage in pancreaticoduodenectomy[J]. J Clin Surg, 2004, 12(4): 199–200. DOI:10.3969/j.issn.1005-6483.2004.04.005 |
| [19] |
王伟, 宋祖军, 丁红, 等. 百草枯致肺纤维化病变区域分布的影像学研究[J].
中华急诊医学杂志, 2011, 20(6): 614–618.
Wang W, Song Z J, Ding H, et al. Imaging study about distribution sites of lesion areas of pulmonary fibrosis induced by paraquat[J]. Chin J Emerg Med, 2011, 20(6): 614–618. DOI:10.3760/cma.j.issn.1671-0282.2011.06.014 |
| [20] | Kakita A, Yoshida M, Takahashi T. History of pancreaticojejunostomy in pancreaticoduodenectomy: development of a more reliable anastomosis technique[J]. J Hepatobiliary Pancreat Surg, 2001, 8(3): 230–237. DOI:10.1007/s0053410080230 |
| [21] | Bassi C, Falconi M, Molinari E, et al. Duct-to-mucosa versus end-to-side pancreaticojejunostomy reconstruction after pancreaticoduodenectomy: results of a prospective randomized trial[J]. Surgery, 2003, 134(5): 766–771. DOI:10.1016/S0039-6060(03)00345-3 |



