2. 400038 重庆,第三军医大学军事预防医学院毒理学研究所
2. Institute of Toxicology, College of Military Preventive Medicine, Third Military Medical University, Chongqing, 400038, China
近年来,不育症的发病率呈全球性增高趋势。育龄夫妇中不孕不育症的发生率为10%~15%[1-3],其中仅由男性因素引起的不育比例大约为50%[4-5]。传统上,WHO推荐的精液参数分析用于判断男性精液质量,但这些常规参数分析未考虑潜在的精子DNA损伤[6]。DNA是遗传信息的载体,DNA结构的完整性对正常受精和胚胎发育具有重要意义,无论是体内受精还是体外人工授精,精子DNA损伤都会导致生殖异常[7]。因此,精子DNA损伤已逐渐成为精液常规分析的必要补充[8-9]。精子中DNA成分包括位于精子头部的核DNA和位于精子中部的线粒体DNA (mitochondrial DNA, mtDNA)。与精子细胞的核DNA相比,mtDNA更容易受到各种内外源因素的影响,导致精子质量的改变,甚至可能影响生育力[10-11]。因此,mtDNA相关指标或许可以作为反映精子质量的敏感生物标志物。
既往在探讨线粒体DNA改变与精液参数之间关系的研究中,较少同时报道精子mtDNA拷贝数和mtDNA缺失的变化。此外,大部分研究所选择的个体为不孕不育专科门诊的特殊人群,难免会存在一些选择偏倚。本研究以社区为单位选取成年男性志愿者作为研究对象,同时检测精子mtDNA拷贝数和mtDNA完整性,分析mtDNA相关指标与精液参数之间的相关性,为将线粒体相关指标应用于精液质量分析和男性生育力预测提供参考依据。
1 资料与方法 1.1 研究对象本研究于2015年12月在重庆市丰都县开展,以社区为单位,从当地的三合街道中招募常住成年男性为研究对象。依托当地卫计委资料,将符合条件的居民按门牌进行排序成随机数字,取最后一位数字为起始值,考虑到拒访及因其他因素造成的研究对象被排除,抽样时按2倍样本量计算抽样间隔,即按总候选人数/(2×计划采样人数)形成门牌号间隔进行抽样。采用自制调查问卷记录研究对象的一般情况(年龄、身高、体质量、禁欲天数及吸烟、饮酒情况)及疾病史(既往史、外科手术史、泌尿系统感染史及其他疾病)。研究对象纳入标准为:① 禁欲天数为2~7 d;② 年龄≥18周岁;③ 无泌尿系统感染史、附睾炎病史、睾丸损伤史、精索静脉曲张治疗史、睾丸下降不全;④ 无喉结、阴毛、乳腺发育异常、阴茎异常、睾丸损伤、附睾炎症、精索静脉曲张、隐睾术后;⑤ 常规精液参数检测均齐全。最终纳入161例作为研究对象。本研究获得了第三军医大学伦理委员会批准,所有的志愿者签署了知情同意书。
1.2 精液质量分析和精子形态学检测根据2010年第5版《WHO人类精液检验与处理实验室手册》的操作标准[12]和本实验室前期建立的方法[13]进行实验。研究对象通过手淫法采集精液于无菌的塑料采精杯中。于37 ℃孵箱中液化,待完全液化后立即采用计算机辅助精子分析系统(computer-aided sperm analysis,CASA,西班牙MICROPTIC公司)进行精液常规分析,分析参数包括:精液体积、精子浓度、精子总数、前向运动率、精子活率。同时,取少量精液涂片、风干、固定后,采用Diff-Quik试剂盒(深圳市博锐德公司)快速染色后观察精子形态并计算精子正常形态率。CASA精液质量分析和精子形态检测均由专业人员进行。
1.3 精子总DNA提取每个样本按照1×107个精子取相应体积的精液标本,3 500 r/min离心5 min,弃上层精浆。余下精子细胞团按照DNA/RNA/蛋白质共提取试剂盒(美国Omega公司)说明书操作提取精子总DNA。
1.4 实时荧光定量PCR检测精子mtDNA拷贝数以线粒体DNA编码的16S rRNA基因为目的基因,GAPDH为核内参基因,精子mtDNA拷贝数通过16S rRNA与GAPDH的比值进行分析。16S rRNA在mtDNA基因组中处于转录终止位置,为不编码线粒体功能蛋白的一个相对保守、不易缺失的基因。PCR引物参照Song等[14]设计,由Invitrogen(上海)公司合成,序列如下:16S rRNA,上游:5′-ACTTTGCAAGGAGA-GCCAAA-3′和下游:5′-TGGACAACCAGCTATCACCA-3′,153 bp;GAPDH,上游:5′-GGATGATGTTCTGGAAG-AGCC-3′和下游:5′-AACAGCCTCAAGATCATCAGC-3′,141 bp,采用SYBR® Premix Ex TaqTM Ⅱ试剂盒(日本TaKaRa公司)在实时荧光定量PCR仪(美国伯乐公司)上进行PCR扩增反应,根据说明书制备20 μL PCR反应混合物,反应条件为:95 ℃预变性30 s;94 ℃变性15 s, 60 ℃退火15 s, 50个循环。设定融解曲线(60~95 ℃),检测PCR反应特异性。采用2-ΔΔCt 对PCR结果进行相对定量分析。为了平衡每次测量之间的差异,从研究对象中随机选取15份DNA样本混合,制作成参考样本。每个DNA样本进行3个复孔检测,最后计算平均值。
1.5 长链PCR方法检测精子mtDNA完整性参考Song等[14]的方法进行精子mtDNA完整性的检测。采用长链PCR(Long-PCR)方法扩增线粒体DNA的8 700 bp片段,该片段包含了线粒体DNA的常见缺失类型,如4 900 bp片段缺失。引物由Invitrogen(上海)公司合成,序列为:上游:5′-AA-GGATCCTCTAGAGCCCACTGTAAAG-3′,下游:5′-TTGGATCCAGTGCATACCGCCAAAAG-3′,8 700 bp。采用TaKaRa LA Taq®试剂(日本TaKaRa公司)制备50 μL PCR反应混合物。反应条件为:95 ℃预变性2 min;95 ℃变性15 s, 62 ℃退火1 min, 68 ℃延伸9 min,共30个循环。PCR产物在0.8%的琼脂糖凝胶中电泳,EB染色后观察并采用Image J2x软件分析条带的光密度,以8 700 kb片段PCR产物的产量来反映精子mtDNA完整性水平。为消除样本之间mtDNA数量不同的影响,每个样本mtDNA完整性的定量结果进一步使用该样本的mtDNA拷贝数结果进行标准化处理。
1.6 统计学分析采用SPSS 16.0统计软件。研究对象基本情况和精液相关数据以中位数(P5,P95) 或构成比(%)来表示。采用Spearman相关性分析精液质量参数与精子mtDNA相关指标(mtDNA拷贝数、mtDNA完整性)之间的关联。采用多元线性回归校正年龄、体质量指数(body mass index, BMI)、禁欲天数、吸烟状态、饮酒状态等混杂因素后,评价精液质量参数与精子mtDNA相关指标间的联系。多元线性回归分析中,由于mtDNA拷贝数的数据为偏态分布,因此采用lg10转换成近似正态分布。P<0.05为差异有统计学意义。
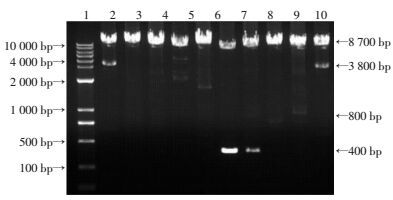
2 结果 2.1 一般资料及精液质量、mtDNA指标的分布研究对象年龄中位数为32周岁,90%的研究对象年龄分布在22~44周岁,吸烟和饮酒人数分别占总人数的57.8%和63.4%。精子mtDNA相关指标中,mtDNA拷贝数的中位数值为2.5(1.0, 8.6)。精子DNA提取后,采用Long-PCR检测mtDNA完整性,研究对象mtDNA完整性的中位数值为30.0(9.4,75.1;表 1)。图 1为部分个体的PCR产物凝胶图像结果。如果样本mtDNA存在片段缺失,则mtDNA的完整性降低,表现为8 700 bp全长片段条带的强度降低,并出现其他扩增条带,常见的为4 900 bp片段缺失。
| 变量 | 数据分布a |
| 年龄(岁) | 32(22, 44) |
| BMI(kg/m2) | 24.3 (19.4, 30.8) |
| 禁欲天数(d) | 4(2~7) |
| 吸烟状态构成比[例(%)] | |
| 不吸烟 | 62(38.5) |
| 已戒烟 | 6(3.7) |
| 吸烟 | 93(57.8) |
| 饮酒状态构成比[例(%)] | |
| 不饮酒 | 41(25.5) |
| 已戒酒 | 18(11.2) |
| 饮酒 | 102(63.4) |
| 精液参数 | |
| 精液体积(mL) | 3.1(0.9,6.4) |
| 精子密度(×106/mL) | 72.2(12.7, 273.1) |
| 精子总数(106) | 232.6(6.6, 796.3) |
| 前向运动率(%) | 64.3(29.7, 88.9) |
| 精子活率(%) | 90.6(55.9, 99.5) |
| 正常形态率(%) | 10.0(4.0, 18.7) |
| mtDNA完整性 | 30.0(9.4, 75.1) |
| mtDNA拷贝数 | 2.5(1.0, 8.6) |
| a:以中位数(P5, P95) 或构成比表示 | |
|
| M:DNA标准,最大相对分子质量为10 000 bp;1~10:分别为10个研究对象的mtDNA完整性检测条带;8 700 bp:mtDNA全长扩增片段;3 800 bp: 4 900 bp片段的缺失 图 1 Long-PCR检测精子mtDNA的完整性 |
2.2 精子mtDNA相关指标与精液参数的相关性分析
Sperman相关性分析结果显示:精子mtDNA拷贝数与所检测的精液参数指标,包括精液体积、精子密度、精子总数、前向运动率、精子活率及精子正形态率均存在显著的负相关。同时,除精子前向运动率外,精子mtDNA完整性与其余的精液参数指标之间存在正相关(表 2)。
| 精液质量参数 | mtDNA拷贝数 | mtDNA完整性 | ||
| r值 | P值a | r值 | P值a | |
| 精液体积(mL) | -0.168 | 0.039 | 0.193 | 0.018 |
| 精子密度(×106/mL) | -0.452 | <0.001 | 0.379 | <0.001 |
| 精子总数(×106) | -0.474 | <0.001 | 0.480 | <0.001 |
| 前向运动率(%) | -0.189 | 0.019 | 0.116 | 0.159 |
| 精子活率(%) | -0.306 | <0.001 | 0.325 | <0.001 |
| 正常形态率(%) | -0.235 | 0.004 | 0.282 | 0.001 |
| a:采用Spearman相关分析得出的P值 | ||||
此外,参考既往研究结果[15],进一步将年龄、BMI、禁欲天数、吸烟状态、饮酒状态等作为潜在的混杂因素纳入多元线性回归分析后,结果如表 3所示:精子密度、精子总数、精子活率、精子正常形态率仍然与mtDNA拷贝数呈负相关,与精子mtDNA完整性呈正相关(P均<0.05),而精液体积和精子前向运动率与mtDNA相关指标之间的关联消失。
| 精液参数 | mtDNA拷贝数a | mtDNA完整性 | ||
| β(95%CI) | P值b | β(95%CI) | P值b | |
| 精液体积(mL) | -4.281(-10.669~2.565) | 0.204 | 1.491(-0.556~3.538) | 0.152 |
| 精子密度(106/mL) | -0.230(-0.459~-0.230) | 0.001 | 0.102(0.064~0.140) | <0.001 |
| 精子总数(106) | -0.096(-0.230~0.056) | <0.001 | 0.035(0.022~0.047) | <0.001 |
| 前向运动率(%) | 0.010(-0.230~0.231) | 0.937 | -0.057(-0.132~0.018) | 0.136 |
| 精子活率(%) | -1.145(-1.825~-0.230) | 0.010 | 0.441(0.197~0.685) | <0.001 |
| 正常形态率(%) | -6.244(-11.080~-1.145) | 0.016 | 0.998(0.363~1.633) | 0.002 |
| a:采用了lg10(x)转换分析后得到的结果按照(10x-1) ×100%反转得到的β值及95%CI,表示精液参数指标每改变一个单位,精子mtDNA损伤指标相应改变的百分数;b:调整年龄、BMI、禁欲天数、吸烟状态、饮酒状态之后的P值 | ||||
3 讨论
随着精液质量常规参数检测的开展,男性不育诊断率得以普遍提高。然而,目前在男性不育患者中仍有大约15%的个体不能通过常规精液质量检测发现异常[6]。同时,传统的精液质量分析未考虑精子DNA的异常。因此,寻找反映精子质量敏感性生物标志物变得很有必要。近年来,精子mtDNA相关指标与精液质量是否存在关联,引起了研究者的普遍关注。哺乳动物精子的线粒体位于精子中段,与精子的运动能力密切相关,也是精子获能后能量的主要来源。本研究在正常成年男性精子中发现一定程度的mtDNA缺失,包括4 900 bp的mtDNA片段缺失。Cummins等[16]也在普通人群发现大约50%正常男性精子中可观察到一定水平的mtDNA缺失。本研究中,在调整了年龄、BMI、禁欲天数、吸烟状态、饮酒状态等混杂因素后,多元线性回归分析发现mtDNA完整性与精子密度、精子总数、精子活率以及精子正常形态率均存在显著的正相关。Song等[14]对57例不育男性精子mtDNA进行了分析,结果发现精子总数与mtDNA完整性呈正相关。Zhang等[17]在对656例随访的大学生队列研究中,采用偏相关分析发现精子浓度和精子总数与mtDNA完整性呈正相关,精子前向运动率与mtDNA完整性无关联。孙志敏等[18]对52例不育患者的精液标本采用Percoll非连续密度梯度离心法分析了80%层精子mtDNA完整性,结果显示精子mtDNA完整性与精子密度呈正相关。这些都说明了精液质量越差,mtDNA完整性越低,与本研究结果一致。线粒体是细胞内产生ROS的重要场所,在氧化磷酸化过程中能伴随产生ROS,正常生理状况下,少量的ROS能调节细胞增殖、分化及细胞信号传导,但是,过量的ROS将引起线粒体的氧化损伤[19]。此外,mtDNA缺乏DNA结合蛋白的保护和DNA损伤修复系统,使得mtDNA容易受到各种内、外源性有害因素的影响[10]。如有研究显示:相比核DNA, mtDNA明显更容易受到H2O2的损伤[20]。
MtDNA拷贝数是反映线粒体DNA数量的指标。本研究采用荧光定量PCR方法检测精液样本的相对线粒体拷贝数,结果显示本组人群中mtDNA拷贝数中位数值为2.5, 平均数值为3.8,与本课题组前期在重庆市大学生人群中研究得出的精子mtDNA拷贝数均数值为3.68的结果相近[17]。在本研究中,多元线性回归分析结果显示:mtDNA拷贝数与常规精液参数,如精子浓度、精子总数、精子活率及正常形态精子率呈负相关,这一结果与既往研究报道一致[14, 21-22]。这些结果提示精液质量与线粒体DNA数量之间存在负向的关联。总体来说,质量差的精液中存在精子mtDNA拷贝数的增加,可以从以下两个方面来解释。首先,mtDNA拷贝数增加与氧化应激升高有关[23-24]。长期过量的ROS刺激,引起线粒体呼吸链功能受损,抑制ATP的合成,为了弥补损伤后的功能缺陷,mtDNA代偿性增加[18],但这种代偿可能不能恢复线粒体功能及正常精子生成,因此,有研究显示高水平ROS可能会导致男性精液质量异常及不育[25]。其次,mtDNA拷贝数在正常精子生成过程中减少[26-27],当精子生成异常或中止凋亡时可能导致人类精子mtDNA拷贝数增加[26]。本研究及既往研究[21-22]均表明mtDNA拷贝数与精液质量呈负性相关,提示精子mtDNA拷贝数增加可以作为精子发生障碍的一个重要标志。
综上所述,本研究通过对正常男性精液质量的检测,进一步证实了mtDNA拷贝数与常规精液参数存在负相关,mtDNA完整性与常规精液质量参数存在正相关。这些关联提示mtDNA相关指标可能作为反映精液质量的重要标志物,并提示这些标志物结合经典的精液质量参数分析,可能有助于男性生育力的诊断。但是,精子mtDNA拷贝数和mtDNA完整性与精液参数内在的生物学联系还值得深入研究。此外,由于目前样本量较小,还需要更大的人群样本进一步论证、证实上述结论。
| [1] | Chandra A, Copen CE, Stephen EH. Infertility service use in the United States: data from the National Survey of Family Growth, 1982-2010[J]. Natl Health Stat Report, 2014(73): 1–21. |
| [2] | Thonneau P, Marchand S, Tallec A, et al. Incidence and main causes of infertility in a resident population (1, 850, 000) of three French regions (1988-1989)[J]. Hum Reprod, 1991, 6(6): 811–816. DOI:10.1093/oxfordjournals.humrep.a137433 |
| [3] | Sharlip I D, Jarow J P, Belker A M, et al. Best practice policies for male infertility[J]. Fertil Steril, 2002, 77(5): 873–882. DOI:10.1016/s0015-0282(02)03105-9 |
| [4] | Smith R P, Coward R M, Lipshultz L I. The office visit[J]. Urol Clin North Am, 2014, 41(1): 19–37. DOI:10.1016/j.ucl.2013.08.002 |
| [5] | Matzuk M M, Lamb D J. The biology of infertility: research advances and clinical challenges[J]. Nat Med, 2008, 14(11): 1197–1213. DOI:10.1038/nm.f.1895 |
| [6] | Agarwal A, Allamaneni S S. Sperm DNA damage assessment: a test whose time has come[J]. Fertil Steril, 2005, 84(4): 850–853. DOI:10.1016/j.fertnstert.2005.03.080 |
| [7] | Bungum M, Humaidan P, Axmon A, et al. Sperm DNA integrity assessment in prediction of assisted reproduction technology outcome[J]. Hum Reprod, 2007, 22(1): 174–179. DOI:10.1093/humrep/del326 |
| [8] | Han X, Zhou N, Cui Z, et al. Association between urinary polycyclic aromatic hydrocarbon metabolites and sperm DNA damage: a population study in Chongqing, China[J]. Environ Health Perspect, 2011, 119(5): 652–657. DOI:10.1289/ehp.1002340 |
| [9] |
刘太秀, 崔志鸿, 曹佳. 重庆市大学生精液常规参数与精子DNA损伤的关联性分析[J].
第三军医大学学报, 2016, 38(11): 1325–1330.
LiuT X, Cui Z H, Cao J. Association analysis between routine semen parameters and sperm DNA damage in Chongqing college students[J]. J Third Mil Med Univ, 2016, 38(11): 1325–1330. DOI:10.16016/j.1000-5404.201603024 |
| [10] | Shamsi M B, Kumar R, Bhatt A, et al. Mitochondrial DNA Mutations in etiopathogenesis of male infertility[J]. Indian J Urol, 2008, 24(2): 150–154. DOI:10.4103/0970-1591.40606 |
| [11] | St John J C, Bowles E J, Amaral A. Sperm mitochondria and fertilisation[J]. Soc Reprod Fertil Suppl, 2007, 65: 399–416. |
| [12] | Department of Reproductive Health and Research WHO. WHO laboratory manual for the examination and processing of human semen[M]. 5th ed. Geneva: WHO Press, 2011. |
| [13] | Yang H, Chen Q, Zhou N, et al. Lifestyles associated with human semen quality: results from MARHCS cohort study in chongqing, China[J]. Medicine (Baltimore), 2015, 94(28): e1166. DOI:10.1097/MD.0000000000001166 |
| [14] | Song G J, Lewis V. Mitochondrial DNA integrity and copy number in sperm from infertile men[J]. Fertil Steril, 2008, 90(6): 2238–2244. DOI:10.1016/j.fertnstert.2007.10.059 |
| [15] |
李强, 崔向荣, 井宣, 等. 吸烟对男性精液质量、精子DNA完整性及Chk1基因表达的影响[J].
生殖医学杂志, 2015, 24(12): 1019–1024.
Li Q, Cui X R, Jing X, et al. Effect of smoking on semen quality, sperm DNA integrity and expression of Chk1[J]. J Reprod Med, 2015, 24(12): 1019–1024. DOI:10.3969/j.issn.1004-3845.2015.12.009 |
| [16] | Cummins J M, Jequier A M, Kan R. Molecular biology of human male infertility: links with aging, mitochondrial genetics, and oxidative stress[J]. Mol Reprod Dev, 1994, 37(3): 345–362. DOI:10.1002/mrd.1080370314 |
| [17] | Zhang G, Wang Z, Ling X, et al. Mitochondrial biomarkers reflect semen quality: results from the MARCHS study in Chongqing, China[J]. PloS One, 2016, 11(12): e0168823. DOI:10.1371/journal.pone.0168823 |
| [18] |
孙志敏, 彭红梅, 赵恩锋, 等. 不同质量精子线粒体DNA拷贝数及完整性的比较研究[J].
中国妇产科临床杂志, 2014, 15(4): 337–340.
Sun Z M, Peng H M, Zhao E F, et al. A comparative study on mitochondrial DNA copy number and integrity in different quality sperm[J]. Chin J Clin Obstet Gynecol, 2014, 15(4): 337–340. |
| [19] | Türk G, Ceribasi A O, Sakin F, et al. Antiperoxidative and anti-apoptotic effects of lycopene and ellagic acid on cyclophosphamide-induced testicular lipid peroxidation and apoptosis[J]. Reprod Fertil Dev, 2010, 22(4): 587–596. DOI:10.1071/RD09078 |
| [20] | Sawyer D E, Mercer B G, Wiklendt A M, et al. Quantitative analysis of gene-specific DNA damage in human spermatozoa[J]. Mutat Res, 2003, 529(1/2): 21–34. DOI:10.1016/s0027-5107(03)00101-5 |
| [21] | May-Panloup P, Chrétien M F, Savagner F, et al. Increased sperm mitochondrial DNA content in male infertility[J]. Hum Reprod, 2003, 18(3): 550–556. DOI:10.1093/humrep/deg096 |
| [22] | Tian M, Bao H, Martin F L, et al. Association of DNA methylation and mitochondrial DNA copy number with human semen quality[J]. Biol Reprod, 2014, 91(4): 101. DOI:10.1095/biolreprod.114.122465 |
| [23] | Pesce V, Cormio A, Fracasso F, et al. Age-related mitochondrial genotypic and phenotypic alterations in human skeletal muscle[J]. Free Radic Biol Med, 2001, 30(11): 1223–1233. DOI:10.1016/s0891-5849(01)00517-2 |
| [24] | Passos J F, Saretzki G, von Zglinicki T. DNA damage in telomeres and mitochondria during cellular senescence: is there a connection[J]. Nucleic Acids Res, 2007, 35(22): 7505–7513. DOI:10.1093/nar/gkm893 |
| [25] | Ko E Y, Sabanegh E S Jr, Agarwal A. Male infertility testing: reactive oxygen species and antioxidant capacity[J]. Fertil Steril, 2014, 102(6): 1518–1527. DOI:10.1016/j.fertnstert.2014.10.020 |
| [26] | Rajender S, Rahul P, Mahdi A A. Mitochondria, spermatogenesis and male infertility[J]. Mitochondrion, 2010, 10(5): 419–428. DOI:10.1016/j.mito.2010.05.015 |
| [27] | Hecht N B, Liem H. Mitochondrial DNA is synthesized during meiosis and spermiogenesis in the mouse[J]. Exp Cell Res, 1984, 154(1): 293–298. DOI:10.1016/0014-4827(84)90688-8 |



