2. 214063 江苏 无锡,无锡市江原实业技贸总公司
2. Wuxi Jiangyuan Industrial Technology and Trade Corporation, Wuxi, Jiangsu Province, 214063, China
胃蛋白酶原Ⅰ(pepsinogensⅠ,PGⅠ)是胃黏膜组织特异性分泌的胃蛋白酶的前体;血清PGⅠ含量的变化与胃溃疡、十二指肠溃疡、萎缩性胃炎等上消化道疾病有密切关系。与健康者相比,慢性胃炎和胃溃疡患者的PGⅠ升高显著;萎缩性胃炎患者PGⅠ普遍降低,所以,PGⅠ的定量检测有重要临床使用意义[1-2]。在日本,血清PG检测已被用于胃癌的早期筛查,相对于其他标志物,PG在高危人群胃癌筛查及早期诊断等方面更具有潜在的价值[3]。
现有PGⅠ检测方法,如乳胶增强比浊分析、化学发光分析、酶联免疫分析和时间分辨荧光分析,或需配备大型仪器,对场地、设备要求高,检测成本贵;或自动化程度不高,操作繁杂,反应时间长,操作人员专业要求高。临床检测迫切需要一种能同时满足快速、灵敏、经济、定量、操作简单的血清PGⅠ检测新方法。
荧光纳米微球免疫层析检测技术有快速、灵敏、操作简单等显著优势,已应用于莱克多巴胺[4]、酪蛋白[5]、金黄色葡萄球菌肠菌素B[6]等指标的检测。时间分辨荧光纳米微球较之普通荧光纳米微球,荧光强度高,发射光谱峰范围窄,激发光(320 nm)和发射光(613 nm)的stokes位移大,灵敏度高,特异性好,能更好地进行定量分析, 已成功用于临床定量快速检测甲胎蛋白[7]、铁蛋白[8]。
本研究拟研制一种能定量、快速检测PGⅠ的时间分辨荧光纳米微球免疫层析试纸,满足临床门急诊和基层单位的实际使用需求。
1 材料与方法 1.1 试剂与仪器1对灵敏度高特异性好的PGⅠ单克隆抗体、兔IgG、羊抗兔IgG、时间分辨荧光纳米微球、PGⅠ抗原、对比市售试剂——PGⅠ定量检测试剂盒(时间分辨荧光免疫分析法)均由无锡市江原实业技贸总公司惠赠;喷金划膜仪、全自动切割机购于上海杰一生物技术有限公司,荧光检测仪-X2014由上海互帼生物技术有限公司生产;硝酸纤维素膜(NC)购自美国Merck-Millipore公司;其他试纸耗材购自上海杰一生物技术有限公司;其他试剂均为国产分析纯。
489例血清样本均由江苏省江原医院提供:89例异常组收集于消化科门诊,胃镜确诊有胃部疾病,且血清经对比试剂——PGⅠ时间分辨荧光免疫试剂检测为阳性的患者;400例健康对照组为自述无胃病史,体检无疾患的正常体检人员,且血清经对比试剂检测为阴性;所有血清样本用真空管采取静脉血3 mL,室温下静置30 min,离心分离得到,置于-20 ℃冰箱冷冻保存。
1.2 制备与检测方法 1.2.1 自制PGⅠ试纸的制备(1) 制备结合垫:抗体按EDC活化羧基氨基偶联法标记在时间分辨纳米荧光微球上,标记好的微球用喷金划膜仪均匀连贯的喷涂在结合垫上,干燥后密封室温保存备用。(2) 制备包被膜:喷金划膜仪分别将PGⅠ捕获抗体和兔IgG喷涂至NC膜上的检测区和质控区,干燥后密封室温保存备用。(3) 组装:在湿度小于35%的环境下,在PVC底板上依次粘贴样品垫、结合垫、包被膜和吸水纸,按0.4 cm的宽度切条,装入塑料卡盒中,铝箔袋密封室温保存备用。
1.2.2 参考品的制备由于PGⅠ的高、低值均有临床意义,参考无锡市江原实业技贸总公司生产的PGⅠ定量检测试剂盒的检测范围,用灭活后的5%小牛血清稀释PGⅠ抗原,制成浓度为10.0、50.0、100.0、200.0、300.0、400.0、500 μg/L参考品。
1.2.3 试纸的检测试纸从密封铝箔袋取出,直接加入20 μL样本或参考品,反应结束后,插入荧光检测仪-X2014,通过测量荧光强度,对照内置标准曲线,自动读出PGⅠ浓度。
1.3 试纸优化 1.3.1 标记抗体与纳米微球的比例标记过程中,加入不同量的PGⅠ标记抗体,组装成不同试纸。取10.0、100.0、300.0、500.0 μg/L 4个参考品进行测试,确定合适的标记比例。
1.3.2 捕获抗体的包被浓度取浓度分别为0.50、0.75、1.00、1.25、1.5 mg/mL的PGⅠ捕获抗体,组装成不同试纸。取10.0、100.0、300.0、500.0 μg/L四个参考品进行测试,确定包被浓度。
1.3.3 试纸的反应时间制备好的试纸,取10.0、100.0、300.0、500.0 μg/L四个参考品,反应后分别在5、10、15、20 min检测,确定适宜的反应时间。
1.4 试纸性能评价 1.4.1 线性测定取PGⅠ参考品,每点重复测定5次,计算出直线方程y=a + bx,以及相关系数r,其中r值应大于或等于0.995。
1.4.2 灵敏度灭活后的5%小牛血清为空白样本,重复测定20次,计算结果的均值与标准差,均值+2倍标准差在标准曲线上得到对应浓度即为检测限,灵敏度。
1.4.3 精密度随机抽取两个批次的PGⅠ试纸,测试50.0、200、400.0 μg/L的浓度点各20次,分别计算批内CV和批间CV;临床要求批内CV < 10%,批间CV < 15%。
1.4.4 对比实验用试纸和市售PGⅠ定量检测试剂盒(时间分辨荧光免疫分析法)平行检测489份临床血清样本,记录结果,计算相关性。市售PGⅠ定量检测试剂盒按照其说明书进行检测操作。
1.5 统计学分析数据采用SPSS 11.5统计软件进行分析。
2 结果 2.1 工艺条件的优化 2.1.1 确定标记抗体与纳米微球的比例标记抗体与纳米微球的比例直接影响试纸性能。从图 1可以看出,低值参考品的T/C变化不明显;但随着标记抗体与纳米微球比例的增大,高值参考品的T/C从一开始的增加显著逐渐到变化不明显。标记抗体与纳米微球的比例为1:100时,试纸线性最佳,选择1:100的标记比例进行后续实验。
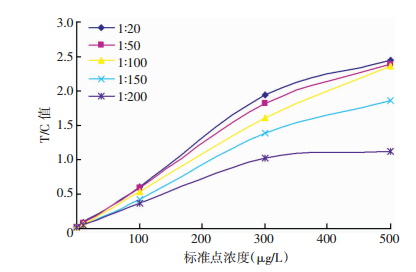
|
| 图 1 抗体标记量检测结果的影响 |
2.1.2 确定捕获抗体的包被浓度
从表 1中可以看出,PGⅠ捕获抗体浓度低于1.0 mg/mL时,随着浓度的增加,T/C增加明显;高于1.0 mg/mL后,试纸上的双抗体夹心吸附基本达到饱和,T/C增加平缓。综合试纸性能和成本考虑,选择1.0 mg/mL的划膜抗体浓度比较适合。
| 捕获抗体浓度(mg/mL) | 参考品 10.0 μg/L |
参考品 100 μg/L |
参考品 300 μg/L |
参考品 500 μg/L |
| 0.5 | 0.025 | 0.251 | 0.752 | 0.924 |
| 0.75 | 0.035 | 0.312 | 1.042 | 1.421 |
| 1.0 | 0.048 | 0.512 | 1.594 | 2.392 |
| 1.25 | 0.051 | 0.681 | 1.612 | 2.514 |
| 1.4 | 0.061 | 0.741 | 1.723 | 2.601 |
2.1.3 试纸反应时间的确定
结果分析显示,试纸反应时间不仅影响荧光值,对试纸的精密度CV也有影响;但是,过长反应时间在实际应用中也是不合理的。综合考虑,选择15 min的反应时间比较适宜(表 2)。
| 反应时间 | 参考品 10 μg/L |
参考品 100 μg/L |
参考品 300 μg/L |
参考品 500 μg/L |
|||||||
| T/C | CV(%) | T/C | CV(%) | T/C | CV(%) | T/C | CV(%) | ||||
| 5 min | 0.022 | 15.52 | 0.345 | 14.12 | 0.695 | 15.41 | 1.012 | 12.54 | |||
| 10 min | 0.031 | 12.64 | 0.312 | 12.41 | 1.021 | 9.42 | 1.542 | 11.01 | |||
| 15 min | 0.051 | 7.94 | 0.545 | 6.82 | 1.526 | 6.12 | 2.332 | 6.54 | |||
| 20 min | 0.054 | 6.82 | 0.556 | 5.74 | 1.625 | 6.04 | 2.512 | 6.12 | |||
2.2 试纸性能的测定 2.2.1 检测线性
线性分析结果显示,0~500.0 μg/L范围内,各浓度与检测值呈线性相关,Y=0.027 9+ 0.004 8X,r=0.997 8,n=8(图 2)。
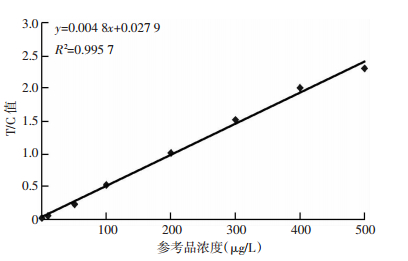
|
| 图 2 PGⅠ试纸的标准曲线分析 |
2.2.2 灵敏度结果
空白样本检测20次的均值为0.19 μg/L,标准差是0.038 μg/L,以空白均值加两倍标准差报告,灵敏度为0.27 μg/L。相比市售PGⅠ定量检测试剂盒(时间分辨荧光免疫分析法)的灵敏度0.35 μg/L,试纸灵敏度满足达到临床使用要求。
2.2.3 精密度结果如表 3,批内各检测浓度CV < 10%,批间各检测浓度CV < 15%。
| 批次 | 参考品浓度 (μg/L) |
检测次数 | CV(%) | 均值CV(%) |
| 第1批 | 50.0 | 20 | 8.86 | |
| 200.0 | 20 | 7.29 | 7.57 | |
| 400.0 | 20 | 6.57 | ||
| 第2批 | 50.0 | 20 | 8.03 | |
| 200.0 | 20 | 7.05 | 7.19 | |
| 400.0 | 20 | 6.48 | ||
| 两批间 | 50.0 | 20 | 12.61 | |
| 200.0 | 20 | 11.16 | 11.03 | |
| 400.0 | 20 | 9.32 |
2.2.4 临床标本检测结果
平行检测489份临床血清样本,结果显示两种试剂有良好的相关性,(YTRFIA= 0.856 6Xstrip+7.545 6,R2=0.989 1,P < 0.01,n=489),如图 3。
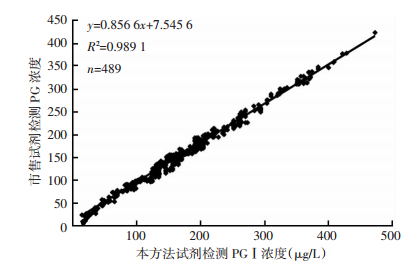
|
| 图 3 TRFIA与试纸测定PGⅠ的相关性比较 |
3 讨论
我国是胃癌的高发国家,发病率和死亡率均居前3位。早期筛查,积极治疗是胃癌防治的关键。研究结果证实,血清PG可准确地反映胃黏膜的功能和组织学状况,有“血清学活检”的作用[9]。芬兰研究人员报道在PGⅠ低水平者中有4.7%经镜检诊断患有胃癌或癌前病变,发病率为正常人的近50倍;研究表明致癌因子可使胚细胞中PGⅠ基因受损突变,失去分泌能力,胃癌组血清PGⅠ下降明显[10]。在萎缩性胃炎患者的PGⅠ普遍降低,由于胃体黏膜萎缩,腺体和主细胞数量减少,被幽门腺或肠上皮化生代替,引起PGⅠ降低[11]。进一步研究表明,慢性浅表性炎及胃溃疡患者中,PGⅠ明显升高;在炎症及溃疡的应激状态下,胃腺体细胞代偿性增加,PGⅠ大量分泌,同时胃黏膜受损(尤其在溃疡急性期)时,PGⅠ也更容易通过血-黏膜屏障进入血循环[12]。所以,低水平和高水平的血清PGⅠ与胃部疾病有密切关系,定量检测PGⅠ在临床诊断有重要价值。
目前市售PGⅠ检测试剂在临床应用均有不足。乳胶增强比浊法的PGⅠ试剂全自动操作,但灵敏度不高,检测范围受限,达不到临床使用要求;化学发光法的PGⅠ试剂灵敏度高,定量检测,但需要配备大型仪器,检测成本高;酶联免疫法和时间分辨荧光法的PGⅠ试剂,板式检测,操作繁杂,反应时间长,操作人员专业要求高。整合了时间分辨荧光、纳米微球、免疫层析技术的PGⅠ定量检测试纸,操作简单,结果快速、可单份检测,并且灵敏度高、经济、定量、结果准确。
PGⅠ检测试纸采用包裹有Eu螯合物的时间分辨荧光纳米微球作为标记物,分别标记上PGⅠ标记抗体和羊抗兔IgG;标记了的微球喷涂在结合垫上;PGⅠ捕获抗体和兔IgG分别喷涂于NC膜的检测线(T线)和质控线(C线)。滴加样本后,样品中的抗原层析至结合垫,抗原抗体发生免疫反应,形成荧光微球-标记抗体-抗原,继续层析,被检测线上的捕获抗体捕获,形成荧光微球-标记抗体-抗原-捕获抗体复合物,荧光微球被固定。激发光激发下,固定了的微球发射出荧光,测量荧光强度;无论样品中有无抗原,质控区的兔IgG均能捕获固定量的荧光微球-羊抗兔IgG,形成荧光微球-兔IgG-羊抗兔IgG复合物。样品中抗原与T线荧光值和C线荧光值的比值(T/C)呈正相关。
本实验研制的PGⅠ定量快速检测试纸,检测范围宽,线性良好,r=0.9978;灵敏度为0.27 μg/L;批内CV小于10%,批间CV小于15%;与市售试剂盒有良好的相关性。但是,由于实验条件的局限,未给出试纸的正常参考范围;后续实验中,将收集临床确诊样本,进行试纸正常参考范围的确定。PGⅠ定量快速检测试纸研制试纸操作简单、快速,经济,可定量,能满足大型医院门诊科室随来随检,开展个性化诊疗的需要,又适宜在广大基层医疗机构使用,推动血清PG快速检测在我国的应用,降低胃癌发病率和死亡率,对胃癌的防治有重要意义。
| [1] |
张洁, 刘怡菁, 王震华. 血清胃蛋白酶原Ⅰ、Ⅱ及其比值诊断效能评价[J].
上海交通大学学报(医学版), 2015, 35(6): 860–863.
ZHANG J, LIU Y J, WANG Z H. Evaluation of diagnostic performance of serum pepsinogen Ⅰ, Ⅱand their ratio[J]. J Shanghai Jiaotong Univ Med Sci, 2015, 35(6): 860–863. DOI:10.3969/j.issn.1007-4287.2013.10.042 |
| [2] | ZHANG J. Simultaneous detection of different serum pepsinogens and its primary application[J]. World Journal of Gastroenterology, 2010, 16(24): 3072. DOI:10.3748/wjg.v16.i24.3072 |
| [3] |
中华医学会检验分会, 卫生部临床检验中心, 中华检验医学杂志编辑委员会. 肿瘤标志物的临床应用建议[J].
中华检验医学杂志, 2012, 35(2): 103–115.
Chinese Society of Laboratorg Medicine, Laboratory Center of Ministry of Health, Editorial board of Chinese Journal of Laboratory Medicine. Clinical application of tumor markers[J]. Chin J Lab Med, 2012, 35(2): 103–115. DOI:10.3760/cma.j.issn.1009-9158.2012.02.003 |
| [4] |
刘道峰, 邓省亮, 赖卫华, 等. 莱克多巴胺荧光微球免疫层析检测方法的建立[J].
食品与机械, 2012, 28(1): 73–77.
LIU D F, DENG S L, LAI W H, et al. Establishment of a method for detection of ractopamine fluorescent microspheres by immunochromatography[J]. Food Machin, 2012, 28(1): 73–77. DOI:10.3969/j.issn.1003-5788.2012.01.019 |
| [5] |
杨亚杰, 倪小琴, 王茜, 等. 荧光微球免疫层析法定量检测牛乳中酪蛋白[J].
食品安全质量检测学报, 2014, 5(7): 1978–1984.
YANG Y J, NI X Q, WANG X, et al. Quantitative determination of casein in milk by fluorescent microsphere immunochromatographic assay[J]. J Food Safe Quali Testing, 2014, 5(7): 1978–1984. DOI:10.3969/j.issn.0529-6005.2016.10.029 |
| [6] | KHREICH N, LAMOURETTE P, BOUTAL H, et al. Detection of staphylococcus enterotoxin B using fluorescent immunoliposomes as label for immunochromatographic testing[J]. Anal Biochem, 2008, 377(2): 182–188. DOI:10.1016/j.ab.2008.02.032 |
| [7] |
郭明明, 周衍, 周剑波, 等. 荧光微球时间分辨免疫层析技术定量检测甲胎蛋白的研究[J].
免疫学杂志, 2015, 31(10): 897–901.
GUO M M, ZHOU Y, ZHOU J B, et al. Quantitation of alpha fetoprotein (AFP) in human serum using fluorescence microspheres time-resolved immunochromatographic technology[J]. Immunol J, 2015, 31(10): 897–901. DOI:10.13431/j.cnki.immunol.j.20150189 |
| [8] |
朱岚, 周衍, 黄彪, 等. 铁蛋白时间分辨荧光免疫层析法的建立及临床应用[J].
现代免疫学, 2015, 36(1): 50–53.
ZHU L, ZHOU Y, HUANG B, et al. Establishment of a TRFIA-POCT for FER antibody and its clinical application[J]. Curr Immunol, 2015, 36(1): 50–53. |
| [9] |
吴冠楠, 姚学权, 刘福坤. 血清胃蛋白酶原对早期胃癌检测的研究进展[J].
检验医学与临床, 2015, 12(14): 2126–2128.
WU G N, YAO X Q, LIU F K. The research of serum pepsinogen in early gastric cancer[J]. Lab Med Clin, 2015, 12(14): 2126–2128. DOI:10.3969/j.issn.1672-9455.2015.14.067 |
| [10] |
程清. 血清胃蛋白酶原对胃癌早期诊断的意义[J].
现代检验医学杂志, 2013, 28(1): 67-69–73.
CHENG Q. Significance of serum pepsinogen in early diagnosis of gastric cancer[J]. J Mod Lab Med, 2013, 28(1): 67-69–73. DOI:10.3969/j.issn.1671-7414.2013.01.022 |
| [11] |
黄语嫣, 陈卫昌, 高楠, 等. 血清胃蛋白酶原Ⅰ、Ⅱ在胃癌及癌前病变诊断中的价值[J].
中华内科杂志, 2013, 52(4): 332–333.
HUANG Y Y, CHEN W C, GAO N. The value of serum pepsinogen in diagnosis of gastric cancer and precancerous lesions[J]. Chin J Inter Med, 2013, 52(4): 332–333. DOI:10.3760/cma.j.issn.0578-1426.2013.04.017 |
| [12] |
乐嫣, 项明洁, 张华. 血清胃蛋白酶原检测在胃相关疾病中的诊断价值[J].
标记免疫分析与临床, 2016, 23(1): 12–14.
LE Y, XIANG M J, ZHANG H. The value of serum pepsinogen in diagnosis of various gastric diseases[J]. Label Immunoas Clin Med, 2016, 23(1): 12–14. DOI:10.11748/bjmy.issn.1006-1703.2016.01.004 |



