胆红素脑病是新生儿病理性黄疸的严重并发症,急性期有较高的病死率,幸存的患儿常常遗留不同程度的神经系统后遗症,严重影响患儿的生活质量,给家庭和社会带来沉重的负担。胆红素脑病发病的具体分子机制尚不清楚,因此缺乏确切有效的治疗方案[1-2]。目前研究认为,游离胆红素可透过血脑屏障沉积于神经细胞,引起细胞死亡,炎症反应、脱髓鞘病变及神经胶质细胞增生[3]。因此,有效抑制胆红素诱导的神经细胞死亡和炎症反应,可能为防治胆红素脑损伤提供新思路。
半胱氨酸天冬氨酸蛋白酶-1(caspase-1) 是天冬氨酸特异性半胱氨酸蛋白酶家族中的一员,既往称为IL-1β转换酶,在调控炎症反应、免疫应答及细胞程序性死亡等过程中发挥着重要的作用[4]。研究证实,caspase-1表达和活化的异常与多种神经系统疾病(缺氧缺血性脑病、癫痫、阿尔兹海默病、肌萎缩侧索硬化症、帕金森、中枢神经性系统感染等)的发生、发展密切相关[5-7]。
本研究旨在探究caspase-1活化是否参与胆红素神经毒性的发生机制,抑制caspase-1活化是否能抑制胆红素神经毒性,发挥神经保护作用。
1 材料与方法 1.1 实验动物SPF级SD大鼠(许可证号:SCXK渝20020001, 重庆医科大学实验动物中心),体质量(250±30) g,雌雄1:1合笼,孕(21±3) d得新生SD鼠。实验过程严格执行《中国实验动物使用和管理办法》。
1.2 试剂与仪器DMEM/F12培养基、胎牛血清(美国Gibicol),L-多聚赖氨酸,3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐(MTT)、4', 6-diamidino-2-phenylindole(DAPI)、胆红素(美国Sigma),Caspase-1抗体(美国Abcam),GFAP抗体、β-actin抗体(美国CST),VX-765(美国Selleck),ECL显影液(美国Bio-Rad),乳酸脱氢酶细胞毒性检测试剂盒、NP40裂解液、Western及IP细胞裂解液、BCA蛋白定量试剂盒、羊抗小鼠荧光二抗(上海碧云天),IL-1β ELISA检测试剂盒(武汉优尔生)。CO2细胞培养箱(美国Thermo),酶标仪(美国Synergy H1266849),ECL成像仪(美国Bio-Rad),电子天平(瑞典Mettler Toledo),荧光显微镜(日本Nikon),倒置相差显微镜(日本Olympus),微量进样器25μL(上海光正)。
1.3 动物实验方法1.3.1胆红素脑病动物模型的建立和腹腔干预参照文献[8],将新生SD大鼠随机分成为胆红素组(n=42),对照组(n=30),VX-765(n=12) 组。称质量后给予乙醚麻醉。使用微量进样器(25μL)经小脑延髓池向胆红素组及VX-765组新生鼠注射胆红素溶液(1 μL/g),对照组新生鼠注射等量对照溶液。建模前1d及建模前1 h,予VX-765组新生鼠腹腔内注射VX-765溶液(50 mg/g);胆红素组及对照组给予注射同等量的干预对照液。
1.3.2 Western blot检测脑组织中Caspase-1蛋白的表达新生鼠干预至相应时间点,按照NP40裂解液说明书提取蛋白,并行定量BCA法分析。按照Western blot标准步骤进行电泳、转膜、封闭,一抗(caspase-1或β-actin 4 ℃)冷库孵育过夜,洗膜后二抗室温孵育1 h,漂洗后ECL显影。
1.3.3 ELISA法检测脑组织炎症因子IL-1β的释放NP40裂解液提取脑组织总蛋白,按照ELISA试剂盒说明书进行操作,设置标准品孔、空白孔及待测样本孔,并设置相应副孔。酶标仪450 nm检测各孔光密度值D(450),建立标准曲线,得到直线回归方程式。再将各样品孔光密度值代入方程式中,得到相应浓度(pg/mg)。
1.3.4 免疫荧光染色检测脑组织切片中GFAP蛋白表达建模后12 h,随机抽取胆红素组及对照组新生鼠数只,断头取脑,按照免疫荧光染色步骤进行固定、脱水、穿透、封闭、抗体孵育、DAPI染核、封片。GFAP浓度为(1:200),荧光二抗浓度为(1:200),荧光显微镜下观察并拍照。
1.3.5 建模后神经系统表现动态评分建模后,每隔2 h观察实验动物是否出现典型的胆红素脑病动物表现:握拳;角弓反张;侧卧;其他,如俯卧、转圈、抽搐等。以上4种临床表现出现1种记1分,连续记录3次。
1.3.6 记录体质量腹腔干预后连续5 d称量并记录各组新生鼠体质量,对比建模前后体质量变化大致评估各组新生鼠的生活能力。
1.4 细胞实验 1.4.1 大鼠皮层星型胶质细胞原代培养参照文献[9],3 d龄SD大鼠新生鼠断头取脑,分离出大脑皮层,经机械剪碎、胰蛋白酶消化制备单细胞悬液,差速贴壁,调整细胞密度后接种于多聚赖氨酸包被的T 75 cm2培养瓶中,用完全培养基(DMEM+10% FBS)进行培养;接种后每隔3天换液,7~9 d后传代培养。细胞传至第2代培养5 d后,随机分为胆红素组,对照组和VX-765组。胆红素组给予胆红素(50 μmol/L),VX-765组在给予胆红素(50 μmol/L)作用前1h提前加入VX-765(50 μmol/L),对照组给予同等体积对照液。
1.4.2 Western blot检测细胞中Caspase-1蛋白的表达各组细胞干预至相应时间点,用Western及IP细胞裂解液提取细胞总蛋白,BCA法测浓度后,按Western blot标准步骤进行操作。
1.4.3 改良MTT法检测细胞相对存活率胆红素干预6 h后,改良MTT法测各组细胞的存活率。酶标仪于波长570 nm检测各孔光密度值D(570)。对照组细胞存活率标化为100%,胆红素组及VX-765组细胞相对存活率表示为各组D(570)/对照组D(570)×100%。
1.4.4 ELISA法检测原代培养上清液IL-1β的释放胆红素干预6 h后,收集细胞培养液上清,按说明书操作测定细胞培养中IL-1β浓度(pg/mL)。
1.5 统计学分析采用SPSS 17.0软件,计量资料经正态及方差齐性检验后,组间差异显著性采用单因素方差分析,组间两两比较用t检验,数据用x±s表示。分类资料用卡方检验,检验水准:α=0.05。
2 结果 2.1 建模后新生鼠脑组织活化型caspase-1表达情况Western blot检测结果显示:胆红素组新生鼠建模后12 h,活化型caspase-1(p20) 的表达明显高于对照组(P=0.034),建模后6、24 h活化型caspase-1(p20) 的表达与正常对照组相比差异无统计学意义(P > 0.05,图 1)。
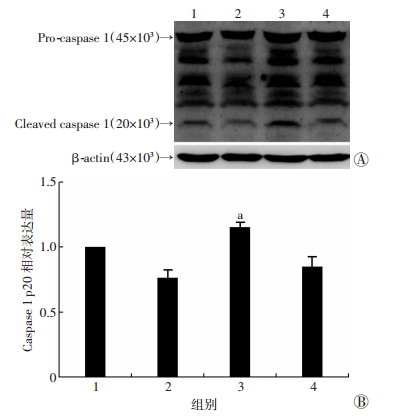
|
| 1:对照组;2:建模后6 h;3:建模后12 h;4:建模后24 h;a:P < 0.05,与对照组比较A: Western blot结果;B:半定量分析结果 图 1 Western blot检测建模后各时间点新生鼠脑组织活化型caspase-1(p20) 表达情况 |
2.2 建模后新生鼠脑组织炎症因子IL-1β的水平
建模后12 h,胆红素组新生鼠脑组织IL-1β的释放水平为(29.10±3.24) pg/mg, 明显高于对照组[(22.56±2.66) pg/mg, P=0.008 7]。
2.3 建模后新生鼠脑组织切片中皮层区星型胶质细胞GFAP的表达胆红素组新生鼠皮层区星型胶质细胞GFAP阳性表达面积/视野总面积为(42.83±6.05)%,明显高于正常对照组[(26.20±4.79)%,P=0.035, 图 2]。
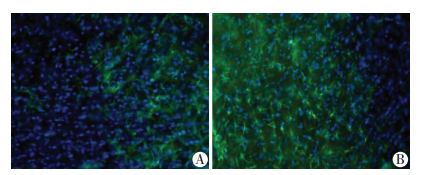
|
| A:对照组;B:胆红素组 图 2 两组新生鼠脑组织切片皮层区GFAP的表达(荧光显微镜×400) |
2.4 建模后新生鼠神经系统表现评分
建模约30 min后,胆红素组及VX-765组新生鼠开始出现明显异常神经系统表现,如握拳、角弓反张、侧卧等。对照组新生鼠未见明显的神经系统异常表现。建模后的神经系统表现评分(2 h/次,共3次),胆红素组及VX-765组分值高于对照组(P=0.007, P=0.026),但VX-765组分值明显低于胆红素组(P=0.002, 图 3)。
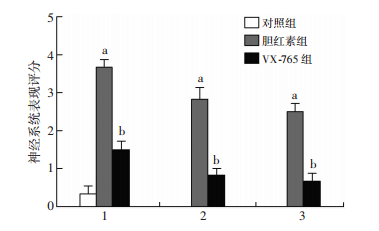
|
| 1:1~2 h;2:3~4 h;3:5~6 h;a: P < 0.01, 与对照组及VX-765组比较;b:P < 0.05, 与对照组比较 图 3 建模后新生鼠神经系统表现评分 |
2.5 建模后新生鼠体质量变化
胆红素组新生鼠建模后24、48及72 h体质量分别为(10.12±1.00) g、(11.27±1.28) g、(12.33±1.53) g,均明显低于同日龄对照组(P < 0.01);VX-765组新生鼠建模后24 h体质量(11.72±0.96) 与对照组(12.98±1.80) g相比差异无统计学意义(P > 0.05),48 h(12.97±1.37) 与对照组(15.88±2.401) g相比差异有统计学意义(P < 0.01),72 h体质量(14.6±1.44) g低于对照组(17.88±2.66) g(P < 0.01),但高于胆红素组新生鼠(P < 0.01)。
2.6 胆红素、VX-765对大鼠皮层星型胶质细胞活化型caspase-1表达的影响Western blot检测结果显示:胆红素干预原代培养大鼠皮层星型胶质细胞6 h后,活化型caspase-1的表达明显高于正常对照组(P=0.021 9)。干预后3、12、24 h,活化型caspase-1的表达与正常对照组相比差异无统计学意义(P > 0.05,图 4A、B)。
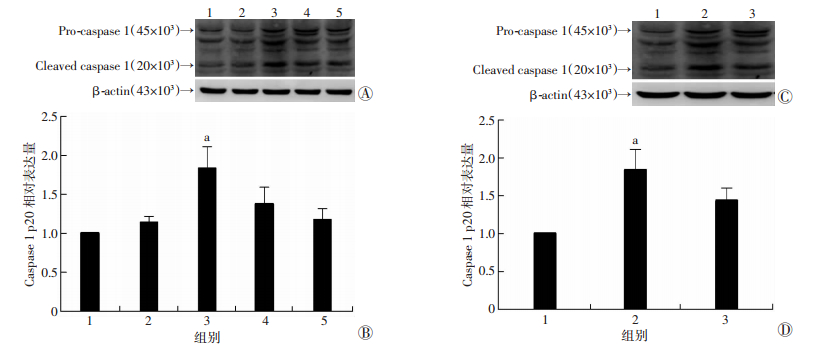
|
| A、B:胆红素干预后各时间点细胞活化型caspase-1(p20) 表达情况a:P < 0.05,与对照组比较,1:正常对照组,2:干预后3 h,3:干预后6 h,4:干预后12 h,5:干预后24 h; C、D:胆红素干预6 h各实验组细胞活化型caspase-1(p20) 表达情况1:对照组,2:胆红素组,3:VX-765组;a: P < 0.05,与对照组及VX-765组比较 图 4 原代培养大鼠皮层星型胶质细胞活化型caspase-1表达 |
原代培养大鼠皮层星型胶质细胞分组干预6 h,活化型caspase-1表达情况:VX-765组活化型caspase-1的表达明显低于胆红素组(P=0.019 6),与对照组相比差异无统计学意义(P > 0.05,图 4C、D)。
2.7 胆红素、VX-765对大鼠皮层星型胶质细胞相对存活率的影响原代培养大鼠皮层星型胶质细胞分组干预6h,对照组、胆红素组、VX-765组细胞相对存活率分别为100%、(69.041±8.138)%、(82.843±3.457)%。胆红素组细胞相对存活率显著低于正常对照组(P=0.002)。VX-765干预组细胞相对存活率显著高于胆红素干预组(P=0.014),低于正常对照组(P < 0.01)。
2.8 胆红素、VX-765对大鼠皮层星型胶质细胞IL-1β释放的影响原代培养大鼠皮层星型胶质细胞分组干预6 h,对照组、胆红素组、VX-765组原代培养星型胶质细胞上清液IL-1β浓度分别为(50.611±6.998) pg/mL、(167.732±6.826) pg/mL、(119.337±13.869) pg/mL。胆红素组IL-1β水平显著高于对照组(P=0.003 5),VX-765组IL-1β水平显著低于胆红素组(P=0.000 9),与对照组相比差异无统计学意义(P > 0.05)。
3 讨论高胆红素血症是新生儿期常见的临床症状。未结合胆红素可透过血脑屏障,沉积于中枢神经系统导致不同程度的神经细胞损伤和功能障碍。目前研究认为,胆红素神经毒性与细胞凋亡、坏死、细胞内钙超载、氧应激、NO释放等相关,但阻止相关过程却无法逆转已发生的神经损伤[3]。因此,胆红素神经毒性的发生机制尚需进一步的探索。
近年来,越来越多的证据表明,炎症在胆红素脑病发病机制中有着重要的作用[10-11]。胶质细胞的活化和炎症因子的释放是神经系统炎症的特征性表现[12-13]。其中,星型胶质细胞是神经系统中数量最多的胶质细胞,也是炎症因子的主要来源,与神经元联系紧密[14]。星型胶质细胞的功能异常与神经元的功能障碍高度相关[15]。在胆红素脑病动物模型中,观察到胆红素可诱导大脑皮层区星型胶质细胞活化。研究证实,胆红素作用于星型胶质细胞使炎症因子释放增加,引起局部炎症反应、细胞死亡;胆红素抑制星型胶质细胞重吸收谷氨酸盐,引起细胞能量代谢失调,血脑屏障功能紊乱,增加神经元对胆红素的易感性,加重胆红素神经毒性[13, 16]。因此,调控胆红素诱导的星型胶质细胞损伤可能作为防治胆红素脑病重要的干预靶点。
Caspase-1是一与炎症反应和细胞死亡密切相关的蛋白酶,静息状态下以无活性的酶原形式(pro-caspase1) 存在,当受到刺激以后,pro-caspase1自体剪切成p10/p20异源二聚体,进而形成有活性的四聚体。活化的caspase-1可剪切IL-1β的前体,使之成为成熟的IL-1β,引起炎症反应;同时激活的caspase-1还参与调控细胞程序性死亡。研究证实,caspase-1的异常表达或活性失衡与多种神经系统疾病的发生、发展密切相关,抑制caspase-1的活化可减轻神经细胞损伤,减少炎症因子释放,发挥神经保护作用[5, 7]。caspase-1的活化是否参与胆红素神经毒性的发生机制,目前尚少见相关报道。
本研究采用Western blot,在胆红素脑病动物模型及原代培养大鼠皮层星型胶质细胞中证实,胆红素诱导caspase-1活化,且其活化具有时间依赖性。Caspase-1又名IL-1β转换酶,其重要功能之一就是介导IL-1β的前体裂解,使之成为具有活性的IL-1β。国内外研究证实,IL-1β在胆红素脑病病理过程中发挥着重要作用[12, 16]。一方面,IL-1β增加星型胶质细胞谷氨酸释放,减少抑制性神经递质的传递,使细胞能量代谢障碍;另一方面,IL-1β可以结合相应的受体,激活促分裂原活化蛋白激酶(MAPK)通路,使NF-κB转录因子活化,导致细胞死亡和更多的炎症因子释放[17];另外,IL-1β还可以招募其他的细胞因子或炎症介质,导致级联反应,加重胆红素神经损伤[10]。减少IL-1β的释放,减轻炎症反应,可能拮抗胆红素神经毒性,改善胆红素脑病大鼠远期预后[18]。值得注意的是,活化的caspase-1还能直接作用于IL-18前体的天冬氨酸残基位点,使之成熟且促进其释放[19]。IL-18和IL-1β同属于IL-1家族,是一种具有多向生物学活性和功能的细胞因子。研究表明,成熟的IL-18参与了缺氧缺血性脑损伤的迟发型炎症反应,加剧脑损伤;另一方面,IL-18能诱导干扰素-γ的产生,有助于清除受感染神经细胞中的病原体,发挥一定的神经保护作用;同时,文献[20]报道IL-18在新生鼠及幼年鼠的大脑正常发育过程中,发挥着一定的生物学功能。目前研究表明,耿氏大鼠(用于研究胆红素脑病的基因缺陷鼠)胆红素干预后脑组织中IL-18表达增高[21],但IL-18在胆红素脑病中的具体作用尚不清楚,提示IL-18的作用可能在发育脑的胆红素神经毒性发生机制较复杂。因此,本研究选择了与caspase-1活化密切相关且在胆红素脑病发病机制中作用较确切的IL-1β为检测指标。
VX-765干预明显降低细胞培养液上清IL-1β的水平,提高星型胶质细胞相对存活率,提示靶向抑制胆红素诱导的星型胶质细胞caspase-1活化可减少IL-1β的释放,发挥神经保护作用。胆红素脑病模型鼠给予腹腔注射VX-765,建模后出现异常神经系统表现,但较胆红素组明显减轻,且建模后72h体质量增长好于胆红素脑病模型鼠。提示通过VX-765抑制caspase-1活化,可减轻胆红素脑病模型鼠的神经系统异常表现,改善其近期生活能力。
目前研究认为,caspase-1活化受炎症小体的调控。炎症小体是由NOD样受体家族成员(NOD-like receptors, NLRs)部分成员如NLRP1、NLRC4、NLRP3等,凋亡相关点样蛋白(apoptosis-associated speck-like protein containing a CARD, ASC)和caspase-1构成的多蛋白复合体。NLRPs在某些信号分子刺激下,暴露出其效应结构域,通过ASC招募和活化caspase-1,继之产生相应的生物学功能[22]。其中,NLRP3炎症小体是目前研究最多的炎症小体,已证实与多种神经系统疾病密切相关。文献[23]证实,NLRP3炎症小体不仅能被病原菌激活,还能被多种外源性和内源性危险信号分子激活。在机体中,外源性危险信号分子主要作用于细胞膜表面的Toll样受体,而细胞内的危险信号分子主要被NLRs识别[22]。脂溶性的游离胆红素既可作为外源性信号作用于细胞膜表面的Toll样受体,又可直接进入细胞作用于MAPK通路,激活NF-κB[23];有研究指出,NF-κB可促进NLRP3炎症体的转录和表达,并参与NLRP3炎症小体的激活[24]。因此推测,胆红素诱导的caspase-1活化可能由NLRP3炎症小体介导,可能与NF-κB的活化有密切关系,但具体机制尚不明确。
综上所述,在胆红素脑病动物模型及原代培养大鼠皮层星型胶质细胞中证实,胆红素可诱导活化型caspase-1表达增加;VX-765抑制caspase-1活化可减轻胆红素神经毒性,改善胆红素脑病模型鼠的生活能力,提高原代培养星型胶质细胞存活率,减少炎症因子释放。本研究提示,caspase-1可能作为防治胆红素脑病新的干预靶点。
| [1] | BHUTANI V K, JOHNSON L. Synopsis report from the pilot USA kernicterus registry[J]. J Perinatol, 2009, 29(Suppl 1): S4–S7. DOI:10.1038/jp.2008.210 |
| [2] | SGRO M, CAMPBELL D, SHAH V. Incidence and causes of severe neonatal hyperbilirubinemia in Canada[J]. CMAJ, 2006, 175(6): 587–590. DOI:10.1503/cmaj.060328 |
| [3] | TIRIBELLI C, OSTROW J D. The molecular basis of bilirubin encephalopathy and toxicity: report of an EASL Single Topic Conference, Trieste, Italy, 1-2 October, 2004[J]. J Hepatol, 2005, 43(1): 156–166. DOI:10.1016/j.jhep.2005.04.003 |
| [4] | GICQUEL T, ROBERT S, VICTONI T, et al. The NLRP3 inflammasome: physiopathology and therapeutic application[J]. Presse Med, 2016, 45(4 Pt 1): 438–446. DOI:10.1016/j.lpm.2016.01.006 |
| [5] | SINGHAL G, JAEHNE E J, CORRIGAN F, et al. Inflammasomes in neuroinflammation and changes in brain function: a focused review[J]. Front Neurosci, 2014, 8: 315. DOI:10.3389/fnins.2014.00315 |
| [6] | SUN Q, SCOTT M J. Caspase-1 as a multifunctional inflammatory mediator: noncytokine maturation roles[J]. J Leukoc Biol, 2016, 100(5): 961–967. DOI:10.1189/jlb.3MR0516-224R |
| [7] | Sollberger G, Strittmatter G E, Garstkiewicz M, et al. Caspase-1: the inflammasome and beyond[J]. Innate Immun, 2014, 20(2): 115–125. DOI:10.1177/1753425913484374 |
| [8] | SONG S, HU Y, GU X, et al. A novel newborn rat kernicterus model created by injecting a bilirubin solution into the cisterna magna[J]. PLoS ONE, 2014, 9(5): e96171. DOI:10.1371/journal.pone.0096171 |
| [9] |
李胜君, 李梦文, 张燕, 等. 反式激活蛋白-NEMO结合域抑制胆红素诱导的大鼠皮层星形胶质细胞NF-κB活化[J].
第三军医大学学报, 2015, 37(21): 2131–2136.
LI S J, LI M W, ZHANG Y, et al. Tat-nbd exerts anti-inflammatory effect in rat cortical astrocytes by inhibiting bilirubin-induced nuclear factor-κb activation[J]. J Third Mil Med Univ, 2015, 37(21): 2131–2136. DOI:10.16016/j.1000-5404.201503068 |
| [10] | FERNANDES A, BRITES D. Contribution of inflammatory processes to nerve cell toxicity by bilirubin and efficacy of potential therapeutic agents[J]. Curr Pharm Des, 2009, 15(25): 2915–2926. DOI:10.2174/138161209789058165 |
| [11] | BERGER I, PELEG O, OFEK-SHLOMAI N. Inflammation and early brain injury in term and preterm infants[J]. Isr Med Assoc J, 2012, 14(5): 318–323. |
| [12] | FERNANDES A, FALCÄO A S, SILVA R F, et al. Inflammatory signalling pathways involved in astroglial activation by unconjugated bilirubin[J]. J Neurochem, 2006, 96(6): 1667–1679. DOI:10.1111/j.1471-4159.2006.03680.x |
| [13] | BRITES D. The evolving landscape of neurotoxicity by unconjugated bilirubin: role of glial cells and inflammation[J]. Front Pharmacol, 2012, 3: 88. DOI:10.3389/fphar.2012.00088 |
| [14] | SOFRONIEW M V, VINTERS H V. Astrocytes: biology and pathology[J]. Acta Neuropathol, 2010, 119(1): 7–35. DOI:10.1007/s00401-009-0619-8 |
| [15] | ALLAMAN I, BÉLANGER M, MAGISTRETTI P J. Astrocyte-neuron metabolic relationships: for better and for worse[J]. Trends Neurosci, 2011, 34(2): 76–87. DOI:10.1016/j.tins.2010.12.001 |
| [16] | FERNANDES A, BARATEIRO A, FALCÃO A S, et al. Astrocyte reactivity to unconjugated bilirubin requires TNF-α and IL-1β receptor signaling pathways[J]. Glia, 2011, 59(1): 14–25. DOI:10.1002/glia.21072 |
| [17] | FERNANDES A, FALCãO A S, SILVA R F, et al. MAPKs are key players in mediating cytokine release and cell death induced by unconjugated bilirubin in cultured rat cortical astrocytes[J]. Eur J Neurosci, 2007, 25(4): 1058–1068. DOI:10.1111/j.1460-9568.2007.05340.x |
| [18] | LI M, SONG S, LI S, et al. The blockade of NF-κB activation by a specific inhibitory peptide has a strong neuroprotective role in a sprague-dawley rat kernicterus model[J]. J Biol Chem, 2015, 290(50): 30042–30052. DOI:10.1074/jbc.M115.673525 |
| [19] | FANTUZZI G, DINARELLO C A. Interleukin-18 and interleukin-1 beta: two cytokine substrates for ICE (caspase-1)[J]. J Clin Immunol, 1999, 19(1): 1–11. DOI:10.1023/A:1020506300324 |
| [20] | ALBONI S, CERVIA D, SUGAMA S, et al. Interleukin 18 in the CNS[J]. J Neuroinflammation, 2010, 7: 9. DOI:10.1186/1742-2094-7-9 |
| [21] | SEQUEIRA D, WATCHKO J F, DAOOD M J, et al. Unconjugated bilirubin efflux by bovine brain microvascular endothelial cells in vitro[J]. Pediatr Crit Care Med, 2007, 8(6): 570–575. DOI:10.1097/01.PCC.0000288716.63685.1B |
| [22] | BERGSBAKEN T, FINK S L, COOKSON B T. Pyroptosis: host cell death and inflammation[J]. Nat Rev Microbiol, 2009, 7(2): 99–109. DOI:10.1038/nrmicro2070 |
| [23] | STEVENSON D, MAISELS M J, WATCHKO J. Care of the Jaundiced Neonate[M]. New York: McGraw-Hill Professio nal, 2012: 1-285. |
| [24] | BAUERNFEIND F G, HORVATH G, STUTZ A, et al. Cutting edge: NF-kappaB activating pattern recognition and cytokine receptors license NLRP3 inflammasome activation by regulating NLRP3 expression[J]. J Immunol, 2009, 183(2): 787–791. DOI:10.4049/jimmunol.0901363 |



