YU Gengsheng, E-mail: yugengsheng@163.com
经皮腔内血管成形术广泛用于治疗先天或后天性血管狭窄,但术后再狭窄发生率较高[1]。血管损伤后,内皮祖细胞(endothelial progenitor cells,EPCs)从骨髓中动员,归巢黏附于局部损伤区,可促进血管再内皮化,抑制新生内膜的增生[2],防治血管再狭窄。但EPCs存在移植效率低及靶向性不足的问题。基质细胞衍生因子-1α(stromal cell-derived factor 1α,SDF-1α)/CXCR4生物轴对调节EPCs迁移、归巢起到关键作用,而过表达趋化因子受体4(chemokine receptor 4,CXCR4) 的外周血EPCs移植到动脉损伤的动物模型体内,能促进损伤血管的再内皮化修复[3-4]。但是,关于过表达CXCR4的大鼠骨髓来源EPCs对血管平滑肌细胞(vascular smooth muscle cells,VSMCs)迁移、增殖影响的体外研究报道较少。
本实验探讨过表达CXCR4的EPCs对VSMCs迁移、增殖的影响,从细胞层面证实上调CXCR4的表达可能是一种改善内皮祖细胞功能、防治血管再狭窄的有效手段。
1 材料与方法 1.1 主要材料雄性SD大鼠,清洁级(重庆医科大学实验动物中心);大鼠淋巴细胞分离液(天津灏洋);EGM-2MVKit培养基(LONZA);大鼠VSMCs(中科院细胞库);Dil-ac-LDL (Molecular probes);FITC-UEA-1、Matrigel基质胶(Sigma);SDF-1α细胞因子(Peprotech);Percp anti-rat CD34(Novus)、PE anti-rat VEGFR-2、(CST)、anti-rat CD133(abnova)、APC anti-rat CD133(RD);PE anti-human CD184(Biolegend);重组腺病毒Ad-CXCR4-GFP、Ad-GFP(重庆医科大学儿科研究所干细胞实验室惠赠);CCK-8试剂盒、结晶紫(天津碧云天);qRT-PCR试剂盒(TaKaRa);24孔Transwell小室(膜孔径8 μm、0.4 μm)(Corning)。
1.2 方法 1.2.1 EPCs的分离培养及鉴定取3~4周龄SD大鼠,按文献[5]报道的密度梯度离心法分离单个核细胞,按文献[6]报道的差速贴壁法1 d后首次换液,将未贴壁的细胞重新接种继续培养。光学显微镜下观察重新接种的细胞继续培养第4、7、10、21天的形态变化。收集培养7 d的细胞,按文献[5]方法对EPCs特异性表面抗原CD34、VEGFR-2、CD133予流式细胞仪进行检测,并按文献[4]方法予激光共聚焦显微镜检测其吞噬功能。
1.2.2 过表达CXCR4的EPCs制备及生物特性检测 1.2.2.1 过表达CXCR4的EPCs的制备取培养7 d的EPCs,按60%~70%接种于EGM-2MV培养基(10% Aus FBS)中。将EPCs分为3组,CXCR4组:加入Ad-GFP-CXCR4(MOI=50),GFP组:加入Ad-GFP(MOI=50),空白对照组:加入等体积EGM-2MV培养基。
1.2.2.2 感染后EPCs细胞膜CXCR4表达量检测按1.2.2.1所述分组及方法将感染48 h后的细胞移去培养液,未处理组细胞为空白对照,与各处理组细胞分别加入PE anti-human CD184,避光孵育30 min,PBS洗涤2次,流式细胞仪检测各组CXCR4的表达水平。
1.2.2.3 感染后CXCR4的mRNA表达量检测按1.2.2.1所述分组及方法将感染48 h后的EPCs移去培养液,提取各组细胞总RNA,测定RNA浓度。于37 ℃、15 min,85 ℃、5 s的条件进行反转录反应,得到cDNA。TaKaRa公司合成CXCR4引物序列:上游AGCCTGGACCGCTACC TTG,下游CAGGGATAGTCAGGAG GAGGG,产物大小121 bp;按照10 μL的反应体系,经过变性、退火、延伸3步反应,35个扩增循环后,比较各组基因的相对表达量,重复3次进行统计分析。
1.2.2.4 感染后EPCs的增殖活性检测取培养7 d 的EPCs,按1.2.2.1所述方法及分组进行病毒感染48 h后,将各组细胞按5×103/孔接种于96孔板,加空白培养基为空白孔组,每组设6个复孔,待细胞贴壁后,于1、3、5、7 d分别加入CCK-8试剂和培养基的混合液(按1 :10比例),孵育1 h,测定各孔在450 nm波长的光密度值D(450),以细胞培养时间为横坐标,吸光度值为纵坐标绘制增殖曲线。
1.2.2.5 感染后EPCs的迁移能力检测取培养7 d的EPCs,按1.2.2.1所述方法进行病毒感染48 h后,将细胞按2×106 个/mL接种于24孔Transwell小室膜上(膜孔径8 μm)。随机分为3组,空白对照组:EPCs+SDF-1α,GFP组:Ad-GFP-EPCs+SDF-1α,CXCR4组:Ad-GFP-CXCR4-EPCs+SDF-1α。每室上腔加入100 μL细胞悬液(空白培养基),下腔加入500 μL含有SDF-1α(100 ng/mL)的空白培养基。孵育12 h,取出Transwell小室上腔,棉签擦拭膜上层未移动细胞,4%多聚甲醛固定30 min,结晶紫染色10 min,于100倍显微镜下计数5个视野,计算迁移细胞数,取其平均值。
1.2.3 过表达CXCR4的EPCs对VSMCs迁移、增殖的影响共培养模型分为:A(VSMCs与EPCs)、B(VSMCs与Ad-GFP-EPCs)、C(VSMCs与Ad-GFP-CXCR4-EPCs)、D(SDF-1α+VSMCs与EPCs)、E(SDF-1α+VSMCs与Ad-GFP-EPCs)、F(SDF-1α+VSMCs与Ad-GFP-CXCR4-EPCs)组。
1.2.3.1 共培养模型VSMCs的迁移能力检测VSMCs的培养参照课题组前期的方法[7],按1.2.3所述进行分组,将VSMCs按2×105个/mL接种于24孔Transwell小室(膜孔径8 μm)上腔中,每室上腔加入100 μL VSMCs细胞悬液(空白培养基),D、E、F组加入SDF-1α(100 ng/mL),A、B、C组加入同体积空白培养基。取培养7 d的EPCs,按1.2.2.1所述方法进行病毒感染48 h后,将EPCs按2×105个/mL接种于下腔,每孔500 μL细胞悬液(空白培养基),孵育12 h;取出Transwell小室上腔,用棉签擦拭膜上层未移动细胞,4%多聚甲醛固定30 min,结晶紫染色10 min,于100倍显微镜下计数5个视野,计算迁移细胞数,取其平均值。
1.2.3.2 共培养模型VSMCs细胞存活率检测取培养7 d的EPCs,按1.2.2.1所述方法进行病毒感染48 h后,按1.2.3所述进行分组。EPCs按2×105/mL接种于24孔Transwell小室(膜孔径0.4 μm)上腔中,每室上腔加入100 μL EPCs细胞悬液;将VSMCs按2×105/mL接种于下腔,每孔500 μL细胞悬液,D、E、F组加入SDF-1α(100 ng/mL),A、B、C组加入同体积空白培养基,孵育48 h。弃去下室各孔培养基, 设只加空白培养基(无细胞)为空白孔组,每组加入CCK-8试剂和培养基的混合液(按1 :10比例),孵育1 h,测定各孔在450 nm波长的D(450) 值,每组设5个复孔。细胞存活率=[D(450)实验组-D(450)空白孔组]/[D(450)空白对照组-D(450)空白孔组]×100%。
1.3 统计学分析采用GraphPad Prism 5.0软件进行统计学数据处理分析与绘图,数据以x±s表示,两组间比较采用两样本t检验,多组间比较采用单因素方差分析。
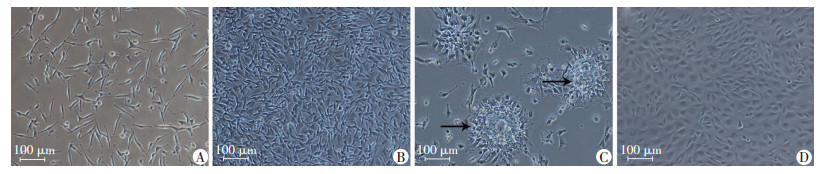
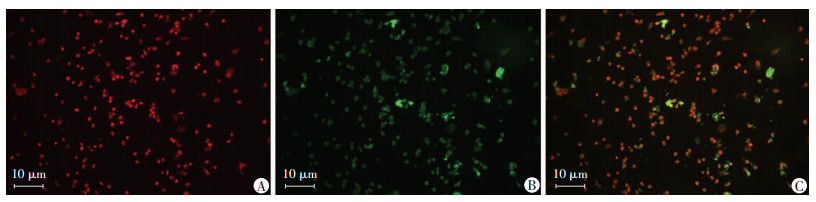
2 结果 2.1 EPCs的鉴定重新接种的非贴壁细胞继续培养4 d后细胞已贴壁,呈纺锤形、三角形及多角形(图 1A),第7 d细胞增多,以梭形细胞为主,可见多角形(图 1B),培养10 d后见“克隆样集落”(图 1C), 第21天左右细胞呈明显“铺路石”样形态(图 1D)。细胞表达EPCs特异性表面标志物CD34、CD133、VEGFR-2的阳性率分别为(69.61±2.13)%、(83.41±0.11)%、(82.45±0.01)%。摄取Dil-Ac-LDL的细胞呈红色(图 2A),摄取FITC-UEA-1的细胞呈绿色(图 2B),两者同时摄入呈橙黄色荧光的细胞比率为86.3%(图 2C),双阳性细胞即是正在分化的EPCs。
|
| A:培养第4天;B:培养第7天;C:培养第10天, ↑:示典型克隆样集落;D:培养第21天 图 1 光镜观察大鼠骨髓源性EPCs不同培养时间点的形态变化 |
|
| A: EPCs摄取Dil-Ac-LDL;B:EPCs摄取FITC-UEA-1;C:AB融合图像 图 2 荧光显微镜观察大鼠骨髓源性EPCs的吞噬功能鉴定 |
2.2 过表达CXCR4的EPCs生物特性检测 2.2.1 感染后EPCs细胞膜CXCR4表达量检测
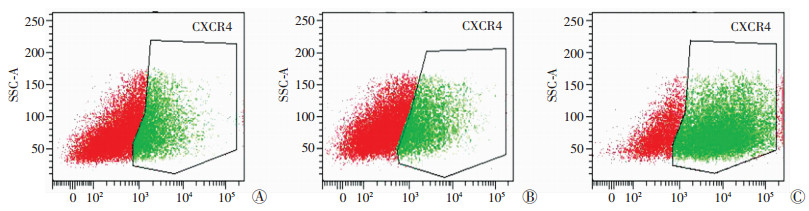
与空白对照组[(27.97±0.60)%]、GFP组相比[(28.77±1.03)%],CXCR4组细胞膜CXCR4表达率[(77.57±1.14)%]明显升高(P<0.01),空白对照组、GFP组表达差异无统计学意义(P>0.05, 图 3)。
|
| A:空白对照组;B: GFP组;C: CXCR4组 图 3 流式细胞术检测各组EPCs细胞表面CXCR4受体的表达 |
2.2.2 感染后CXCR4的mRNA表达量检测
空白对照组、GFP组、CXCR4组CXCR4 mRNA相对表达量分别为(0.071±0.013)、(0.077±0.010)、(0.270± 0.042)。CXCR4组明显高于空白对照组及GFP组(P<0.01),空白对照组、GFP组表达差异无统计学意义(P>0.05)。
2.2.3 感染后EPCs的增殖活性检测空白对照组第1、3、5、7天的D(450) 值分别为(0.216±0.003)、(0.468±0.016)、(0.706±0.017)、(0.976±0.013),GFP组第1、3、5、7天的D(450) 值分别为(0.228±0.006)、(0.474±0.010)、(0.734±0.022)、(0.978±0.010),CXCR4组第1、3、5、7天的D(450) 值分别为(0.227±0.003)、(0.482±0.008)、(0.734±0.026)、(1.044±0.022)。空白对照组、GFP组、CXCR4组EPCs细胞相对增殖率差异无统计学意义(P>0.05)。
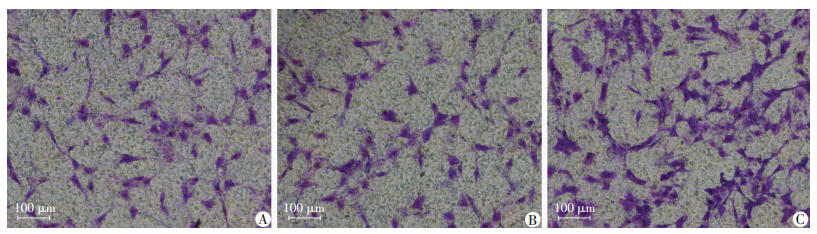
2.2.4 感染后EPCs的迁移能力检测在SDF-1α诱导下,每高倍镜视野下空白对照组、GFP组及CXCR4组平均迁移细胞数分别为(69.2±4.45)、(67.6±4.62)、(138.8±5.89),与空白对照组、GFP组相比,CXCR4组EPCs的迁移能力明显增高(P<0.01,图 4)。
|
| A:空白对照组;B: GFP组;C: CXCR4组 图 4 Transwell检测SDF-1α诱导下各组EPCs的迁移能力(结晶紫) |
2.3 过表达CXCR4的EPCs对VSMCs迁移、增殖的影响 2.3.1 共培养模型VSMCs的迁移能力检测
每高倍视野下的迁移细胞数,空白对照组(43.2±2.2)、GFP组(41.2±2.9) 及CXCR4组(40.2±3.8) VSMCs的自然迁移(无SDF-1α诱导下)能力差异无统计学意义(P>0.05);在SDF-1α诱导下,CXCR4+SDF-1α组VSMCs的迁移能力(17.2±1.9) 较空白对照组、GFP组明显降低(P<0.05),空白对照+SDF-1α组(25.8± 2.3)、GFP+SDF-1α组(24.2±3.3) 及CXCR4+ SDF-1α组(17.2±1.9) 细胞迁移能力低于无SDF-1α诱导下各组(P<0.05,图 5)。

|
| A:空白对照组;B: GFP组;C: CXCR4组;D:空白对照+SDF-1α组;E: GFP+SDF-1α组;F: CXCR4+SDF-1α组 图 5 ranswell检测SDF-1α诱导下各组VSMCs的迁移能力 |
2.3.2 共培养模型VSMCs细胞存活率检测
无SDF-1α诱导下,空白对照组[(100.00±0.98)%]、GFP组[(99.76±2.02)%]及CXCR4组VSMCs细胞存活率[(99.65±2.82)%]无明显差异(P>0.05);在SDF-1α诱导下,CXCR4+ SDF-1α组VSMCs细胞存活率[(62.26±2.55)%]较空白对照组、GFP组明显降低(P<0.05),并且空白对照+ SDF-1α组[(88.31±2.24)%]、GFP+ SDF-1α组[(87.82± 2.09)%]及CXCR4+ SDF-1α组细胞存活率[(62.26± 2.55)%]均低于无SDF-1α诱导下各组(P<0.01)。
3 讨论血管再狭窄发生的主要机制是损伤导致VSMCs增殖和内膜增生,引发血管结构重建导致管腔狭窄[8-9],其防治的关键在于血管内皮的修复和抑制血管平滑肌细胞增生。EPCs参与内源性的血管内皮损伤修复,对于维持血管内皮结构和功能的完整性起着重要作用[10-11]。SDF-1/CXCR4在介导EPCs迁移、归巢中发挥了重要作用[12]。
文献[13-14]报道EPCs可以从骨髓、外周血、脐带血中分离获得,但以骨髓中含量更高,且增殖能力最强。本研究从SD大鼠骨髓中分离提取的细胞符合EPCs的特点[15]:即培养21 d左右出现典型“铺路石”样表现,提示EPCs已逐渐向内皮细胞方向分化;CD34、CD133、VEGFR-2细胞表面抗原在所提取的细胞中阳性表达率较高;培养7 d的大部分细胞具有同时摄取Dil-ac-LDL与结合FITC-UEA-1的能力,为正在分化的EPCs。
CXCR4是趋化因子SDF-1α的特异性受体,在SDF-1α诱导下,对干细胞动员、迁移归巢等方面有重要作用。本实验采用重组腺病毒作为CXCR4基因的载体感染EPCs,结果显示CXCR4组受体阳性表达率和mRNA表达量明显高于空白对照组、GFP组,成功构建CXCR4在EPCs中的过表达。空白对照组、空质粒组及基因感染组细胞增殖活性差异无统计学意义,说明CXCR4基因转染对EPCs生长增殖无明显影响。通过Transwell实验发现,在SDF-1α诱导下,CXCR4组EPCs的迁移能力较空白对照组、GFP组明显增高,提示过表达CXCR4可增强EPCs迁移能力。
当血管发生损伤后,SDF-1水平上调并立即从损伤组织中释放[16],对EPCs有强大的趋化活性[17],并且呈浓度依赖性[18]。为了解过表达CXCR4的EPCs归巢到受损血管内膜层对VSMCs的影响,采用Transwell小室建立共培养模型,发现SDF-1α诱导下,CXCR4组VSMCs迁移、细胞存活率明显降低,且SDF-1α诱导下各组VSMCs的迁移、细胞存活率均低于无SDF-1α诱导下各组VSMCs的迁移、细胞存活率,表明过表达CXCR4的EPCs在SDF-1α诱导下对VSMCs的迁移、增殖的抑制作用更明显,该研究结果与既往动物实验结果一致[4]。
VSMCs由收缩型向合成型转换是其开始增生和迁移的先决条件。既往研究表明能够明显抑制VSMCs增殖的细胞因子主要有降钙素基因相关肽(calcitonin gene related peptide,CGRP)、一氧化氮(nitricoxide,NO),而EPCs能够合成并分泌CGRP,再通过旁分泌方式抑制VSMCs的病理性增殖和表型转化[19]。部分学者提出EPCs可能通过Jagged1相关信号转导系统抑制平滑肌细胞表型转换,而EPCs可表达Jagged1[20],相关机制有待进一步研究。CXCR4表达上调,加强了EPCs对SDF-1α的应答,另外增加SDF-1α的含量,加强了SDF-1α对EPCs的靶向迁移,最终在SDF-1α/CXCR4轴的作用下增强EPCs靶向归巢,因此EPCs归巢数量的增加对VSMCs增殖、迁移的抑制作用也随之增强。
综上所述,本研究通过体外实验证实在SDF-1α作用下,过表达CXCR4的EPCs的迁移能力增强,归巢细胞数量增加,从而加强EPCs对VSMCs迁移和增殖的抑制作用,其机制可能与EPCs细胞因子的分泌增加以及Jagged1相关信号的转导增强相关。因此,过表达CXCR4可改善内皮祖细胞功能、增强血管内皮修复,成为未来防治血管再狭窄的一种细胞治疗手段。
| [1] | POON M, BADIMON J J, FUSTER V. Overcoming restenosis with sirolimus: from alphabet soup to clinical reality[J]. Lancet, 2002, 359(9306): 619–622. |
| [2] | DOBERT N, BRITTEN M, ASSMUS B, et al. Transplantation of progenitor cells after reperfused acute myocardial infarction: evaluation of perfusion and myocardial viability with FDG-PET and thallium SPECT[J]. Eur J Nucl Med Mol Imaging, 2004, 31(8): 1146–1151. DOI:10.1007/s00259-004-1490-4 |
| [3] | SAINZ J, SATA M. CXCR4, a key modulator of vascular progenitor cells[J]. Arterioscler Thromb Vasc Biol, 2007, 27(2): 263–265. DOI:10.1161/01.ATV.0000256727.34148.e2 |
| [4] | CHEN L, WU F, XIA W H, et al. CXCR4 gene transfer contributes to in vivo reendothelializati on capacity of endothelial progenitor cells[J]. Cardiovasc Res, 2010, 88(3): 462–470. DOI:10.1093/cvr/cvq207 |
| [5] |
王丽, 张会峰, 赵志刚, 等. 大鼠骨髓内皮祖细胞的分离培养与鉴定[J].
中国组织工程研究, 2012, 16(10): 17–1736.
WANG L, ZHANG H F, ZHAO Z G, et al. Separation, culture and identification of rat bone marrow-d -erived endothelial progenitor cells[J]. Chin J Tissue Engin Res, 2012, 16(10): 17–1736. |
| [6] | LI M. Bone marrow-derived endothelial progenitor cells: isolation and characterization for myocardial repair[J]. Methods Mol Biol, 2010, 660: 9–27. DOI:10.1007/978-1-60761-705-1_2 |
| [7] | ZHU X, GUO J, HE C, et al. Ultrasound triggered image-guided drug delivery to inhibit vascular reconstruction via paclitaxel-loaded microbubbles[J]. Sci Rep, 2016, 6: 21683. DOI:10.1038/sr-ep21683 |
| [8] |
崔斌, 丁小涵, 黄岚, 等. 内皮型一氧化氮合酶基因转染促进内皮祖细胞移植对大鼠颈动脉新生内膜增生的抑制作用[J].
中国介入心脏病学杂志, 2014, 22(10): 637–641.
CUI B, DING X H, HUANG L, et al. Endothelial nitric oxide synthase gene transfection enhances anti-proliferative effect of EPCs on injured artery[J]. Chin J Intervent Cardiol, 2014, 22(10): 637–641. DOI:10.3969/j.issn.1004-8812.2014.10.006 |
| [9] | CHAABANE C, OTSUKA F, VIRMANI R, et al. Biological responses in stented arteries[J]. Cardiovasc Res, 2013, 99(2): 353–363. DOI:10.1093/cvr/cvt115 |
| [10] | LANDMESSER U, HORNIG B, DREXLER H. Endothelial function: a critical determinant in atherosclerosis[J]. ? Circulation, 2004, 109(21 Suppl 1): Ⅱ27–33. DOI:10.1161/01.CIR.0000129501.88485.1f |
| [11] | HILL J M, ZALOS G, HALCOX J P, et al. Circulating endothelial progenitor cells, vascular function, and cardiovascular risk[J]. N Engl J Med, 2003, 348(7): 593–600. DOI:10.1056/NEJMoa022287 |
| [12] | KAWAKAMI Y Ⅱ M, MATSUMOTO T, et al. SDF-1/CXCR4 axis in Tie2-lineage cells including endothelial progenitor cells contributes to bone fracture healing[J]. J Bone Miner Res, 2015, 30(1): 95–105. DOI:10.1002/jbmr.2318 |
| [13] | RESCH T, PIRCHER A, KÄHLER C M, et al. Endothelial progenitor cells: current issues on characterization and challenging clinical applications[J]. Stem Cell Rev, 2012, 8(3): 926–939. DOI:10.1007/s12015-011-9332-9 |
| [14] | ZAMPETAKI A, KIRTON J P, XU Q. Vascular repair by endothelial progenitor cells[J]. Cardiovasc Res, 2008, 78(3): 413–421. DOI:10.1093/cvr/cvn081 |
| [15] | ASAI J, TAKENAKA H Ⅱ M, et al. Topical application of ex vivo expanded endothelial progenitor cells promotes vascularisation and wound healing in diabetic mice[J]. Int Wound J, 2013, 10(5): 527–533. DOI:10.1111/j.1742-481X.2012.01010.x |
| [16] | KITAORI T, ITO H, SCHWARZ E M, et al. Stromal cell-derived factor 1/CXCR4 signaling is critical for the recru-itment of mesenchymal stem cells to the fracture site during skeletal repair in a mouse model[J]. Arthritis Rheum, 2009, 60(3): 813–823. DOI:10.1002/art.24330 |
| [17] |
尹扬光, 黄岚, 赵晓辉, 等. SDF-1对内皮祖细胞增殖迁移的影响及AMD3100对其的干预[J].
第三军医大学学报, 2007, 29(6): 475–478.
YIN Y G, HUANG L, ZHAO X H, et al. Effect of AMD3100 on SDF-1 induced proliferation and m igration of endothelial progenitor cells[J]. J Third Mil Med Univ, 2007, 29(6): 475–478. DOI:10.16016/j.1000-5404.2007.06.003 |
| [18] | SHEN L, GAO Y, QIAN J, et al. The role of SDF-1α /Rac pathway in the regulation of endothelial progenitor cell polarity; homing and expression of Rac1, Rac2 during endothelial repair[J]. Molecul Cell Biochem, 2012, 365(1-2): 1–7. DOI:10.1007/s11010-011-1083-z |
| [19] |
方立. 内皮祖细胞对血管平滑肌细胞增殖与表型转化的抑制作用及其机制研究[D]. 长沙: 中南大学, 2010.
FANG L.The inhibitory effect of endothelial progenitor cells on the proliferation and phenotype transformation of vascular smooth muscle cells and the underlying mechsnisms[D]. Changsha :Central South University, 2010. |
| [20] |
朱光旭, 周芳, 黄岚, 等. 供体年龄影响融合生长内皮祖细胞对平滑肌细胞表型转换及增殖迁移的作用[J].
中国病理生理杂志, 2015, 31(5): 769–776.
ZHU G X, ZHOU F, HUANG L, et al. Donor age affects confluent EPCs on phenotypic transition, proliferation and migration of smooth muscle cells[J]. Chin J Pathophysiol, 2015, 31(5): 769–776. DOI:10.3969/j.issn.1000-4718.2015.05.001 |



