肺癌是世界范围内因恶性肿瘤致死的第一要因[1],其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占85%~90%[2]。随着对肿瘤分子生物学和基因水平研究的深入,分子靶向治疗取得了革命性进展。表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKIs),如吉非替尼(gefitinib)和厄洛替尼(erlotinib),已成为EGFR敏感突变(19外显子缺失和/或21外显子突变)晚期NSCLC的标准一线治疗方案,明显延长了患者的无进展生存期(progress-free survival,PFS)并提高了生活质量[3-4]。然而,临床治疗有效的患者终将产生耐药,出现疾病进展[5]。因此,NSCLC EGFR-TKIs继发耐药已成为亟待解决的问题,所以深入探讨并阐明继发耐药的发生机制对克服耐药有着重大意义。
近年来,NSCLC EGFR-TKIs继发耐药机制的研究一直是相关领域的热点,并取得了重大突破。目前已明确的原因有T790M点突变[5]、MET基因扩增[6]、肝细胞生长因子(hepatocyte growth factor, HGF)过表达[7]等,但仍有部分患者发生继发耐药的原因尚不清楚。NEDD4(neural precursor cell expressed developmentally protein 4) 家族是一类具有E3泛素连接酶活性的蛋白质,通过影响多种肿瘤相关信号通路在肿瘤进展中发挥重要作用[8]。本课题组前期工作发现,NSCLC厄洛替尼耐药细胞中NEDD4的表达明显高于敏感细胞,但其在NSCLC厄洛替尼继发耐药的过程中是否发挥作用尚不清楚。故本研究选取了对EGFR-TKIs敏感的EGFR 19外显子缺失突变型的HCC827肺腺癌细胞株,以及前期实验室诱导出的厄洛替尼获得性耐药细胞(HCC827/ER)作为细胞模型,探讨NEDD4在NSCLC厄洛替尼耐药中的作用及其可能机制。
1 材料与方法 1.1 材料 1.1.1 细胞株人肺腺癌HCC827细胞株购于美国标准菌库;获得性耐药细胞株(HCC827/ER)由本实验室韩静[9]博士利用HCC827细胞在大剂量厄洛替尼(1~5 μmol/L)冲击诱导并低剂量厄洛替尼(0.01 μmol/L)维持培养8个月的条件下获得。
1.1.2 主要试剂RPMI1640培养基、TBD标准胎牛血清(购于上海拜力生物科技公司);盐酸厄洛替尼(购于上海安格化工有限公司);RNA提取、反转录及荧光实时定量PCR试剂盒(均购于TaKaRa公司);蛋白提取、BCA蛋白浓度测定、SDS-PAGE凝胶电泳试剂盒(均购于江苏碧云天生物技术有限公司);CCK-8(Cell Counting Kit 8) 细胞毒性检测试剂盒(购于上海东仁化工科技有限公司);h_NEDD4单基因siRNA套装B(购于广州锐博生物科技有限公司);siNEDD4的慢病毒(合成并购自于上海汉恒生物科技有限公司)。一抗:GAPDH(购于武汉三鹰生物技术有限公司), NEDD4、Akt、p-Akt(购于美国Cell signaling technology公司);二抗:山羊抗兔及山羊抗鼠辣根过氧化物酶(均购于武汉博士德生物工程有限公司)。
1.2 方法 1.2.1 细胞培养HCC827及HCC827/ER细胞均培养由全血清培养基(90% RPMI1640培养基加10%标准胎牛血清和100 U/mL的青霉素-链霉素溶液制成)培养,置于5%CO2、37 ℃恒温孵箱中培养,HCC827/ER细胞的培养液加0.01 μmol/L的厄洛替尼。
1.2.2 CCK-8法检测厄洛替尼对细胞的影响将目的细胞以4.5×103/孔的细胞量均匀铺种于96孔板,待细胞贴壁后。在含0、0.001、0.01、0.1、1、10、100 μmol/L厄洛替尼的培养基中培养48 h(每组设有3个复孔)。然后以CCK-8法检测细胞生长情况,即各孔均加入无血清培养基和CCK-8液配制成的混合液(体积比9: 1)100 μL,室温孵育30 min后,在酶标仪中检测450 nm波长处的光密度值[D(450)]。并按如下公式计算肿瘤细胞的生存分数,利用GraphPad Prism 5.0计算IC50值并绘制药物浓度-生存分数曲线图。
1.2.3 实时荧光定量PCR(quantitative real-time PCR,qPCR)按试剂盒说明书抽提目的总RNA,测定总RNA浓度和纯度,并按TaKaRa反转试剂盒说明书进行反转录获得cDNA后,在Real-time PCR仪(ABI7500) 上进行扩增检测。扩增引物:NEDD4(上游:5′-GGTGGAGGTGTTCGGGCT-3′下游:5′-GCAAGGCCTATTCCGGCTA-3′);β;CAAGG(上游:5′-GCGAGCACAGAGCCTCGCCTT-3′下游:5′-CATCATCCATGGTGAGCTGGCGG-3′)。扩增条件:95 ℃ 30 s→95 ℃ 5 s→60 ℃ 34 s,共40个循环。数据采用2-△△Ct法进行分析。
1.2.4 Western blot检测按试剂说明书提取目的细胞总蛋白。用BAC试剂盒测总蛋白浓度,加入1/4体积的5×SDS-PAGE上样缓冲液,于沸水中浸5 min至充分变性。在10%的SDS-PAGE凝胶中进行电泳(上层胶80 V 40 min,下层胶120 V 90 min),之后用200 mA 90 min恒流湿转到PVDF膜上。PVDF膜经5%BSA室温封闭1 h后,置于相应稀释好的抗体NEDD4(1: 1 000)、Akt(1:500)、p-Akt (1: 1 000)、GAPDH(1:1 000)4℃孵育过夜。翌日取出PVDF膜复温30 min,TBST溶液洗涤3次(每次5 min)后,于对应种属辣根过氧化物酶标记的二抗(1: 5 000) 中孵育1 h,再以TBST溶液洗膜3次后滴加显影剂,并在凝胶成像分析仪上曝光。
1.2.5 转染HCC827/ER细胞实验分为敲减组和阴性组,因h_NEDD4单基因siRNA套装B中siNEDD4共有3个序列,故敲减组标为siNEDD4#1、siNEDD4#2、siNEDD4#3。将HCC827/ER细胞以5×105/孔接种6孔板, 轻轻摇动使其均匀分布。贴壁后按siRNA产品说明书,对HCC827/ER细胞进行转染。24 h后检测RNA水平敲减效率,48 h后检测蛋白水平的敲减效率。
1.2.6 裸鼠成瘤实验裸鼠(雌性,4~6周龄)购于中国医学科学院(北京),置于SPF层流室饲养,室温控制在(22±2)℃,湿度低于40%。裸鼠共分为4组,每组3只。分别将HCC827、HCC827/ER、HCC827/ER-EV、HCC827/ER-siNEDD4细胞1×106/只接种于各组小鼠左侧腋下,6~9 d后,可观察到明显瘤体。肿瘤体积达100~150 mm3后,予厄洛替尼(60 mg/kg,1次/d)灌胃2周后,处死小鼠,观察肿瘤生长情况。
1.3 统计学分析采用SPSS 20.0统计软件进行,计量资料数据以x±s表示。两组均数比较采用t检验。分析数据及绘制图形应用GrapPad Prism 5.0软件。
2 结果 2.1 HCC827和HCC827/ER细胞对厄洛替尼的敏感性随着厄洛替尼浓度的增加,传代培养的HCC827细胞及本实验室前期诱导的获得性耐药HCC827/ER细胞的生存分数均有不同程度的下降(图 1)。在厄洛替尼物质的量浓度为0.01~10 μmol/L区间内,暴露在相同浓度时,HCC827细胞的生存分数明显低于HCC827/ER细胞。经计算,厄洛替尼对HCC827/ER的IC50值为(11.6±0.90)μmol/L,对HCC827细胞的IC50值(0.10±0.12)μmol/L,差异具有统计学意义(P<0.01)。HCC827/ER细胞的耐药指数为(118.23± 23.77)。提示HCC827/ER细胞对厄洛替尼明显耐药。
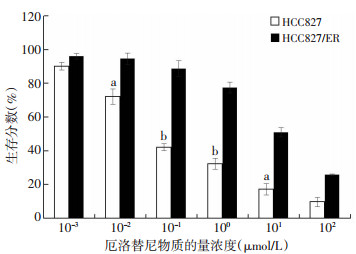
|
| a: P<0.05;b: P<0.01,与HCC827/ER比较 图 1 不同物质的量浓度厄洛替尼对HCC827细胞及HCC827/ER细胞生存分数的影响(n=3, x±s) |
2.2 NEDD4以及AKT、p-AKT在HCC827及HCC827/ER中的表达
因厄洛替尼在0.01 μmol/L时对HCC827及HCC827/ER细胞的影响开始出现差异,故本实验均以0.01 μmol/L厄洛替尼处理各组细胞,观察NEDD4以及Akt、p-Akt的表达差异。qPCR结果显示,NEDD4 mRNA在HCC827/ER细胞中的表达是HCC827细胞的(2.33±0.12) 倍(n=3,P<0.05)。Western blot检测结果显示,HCC827/ER细胞中NEDD4蛋白表达量较HCC827细胞明显升高;p-Akt蛋白表达也提高显著(图 2)。提示NEDD4表达增高可能是通过活化PI3K/Akt信号通路,促进HCC827/ER厄洛替尼耐药的发生。

|
| 1: HCC827; 2: HCC827/ER 图 2 0.01 μmol/L厄洛替尼处理48 h后两种细胞中NEDD4、AKT及p-AKT的表达 |
2.3 敲低NEDD4在HCC827/ER细胞中的表达
qPCR结果显示,与阴性对照组相比,3个敲减组NEDD4 mRNA相对表达量均有下降,siNEDD4#2、siNEDD4#3更为显著(图 3A)。Western blot检测结果显示,siNEDD4#3能显著敲低NEDD4蛋白表达水平(图 3B)。故后续实验以siNEDD4#3的序列构建慢病毒,进而构建稳定的NEDD4低表达的HCC827/ER细胞。
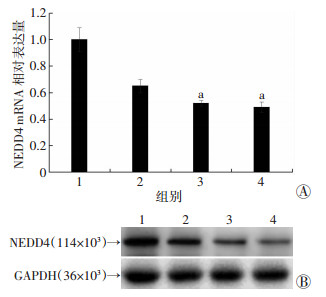
|
|
1~4分别为阴性对照组、siNEDD4#1组、siNEDD4#2组、siNEDD4#3组 A:qPCR检测mRNA表达(n=3,x±s) a:P<0.05,与阴性对照组比较;B:Western blot检测蛋白表达 图 3 检测HCC827/ER细胞NEDD4的敲减效率 |
2.4 敲低NEDD4增加HCC827/ER细胞对厄洛替尼的敏感性
在厄洛替尼浓度为0.01~100 μmol/L区间内,相同浓度的厄洛替尼对NEDD4敲减组(siNEDD4#3) 细胞的抑制率明显高于阴性对照组(图 4)。厄洛替尼对NEDD4敲减组细胞的IC50值为(0.72±0.12)μmol/L,明显低于其对阴性对照组细胞的IC50值(13.88±1.96)μmol/L(P<0.05),提示敲低NEDD4的表达能明显增加HCC827/ER细胞对厄洛替尼的敏感性。
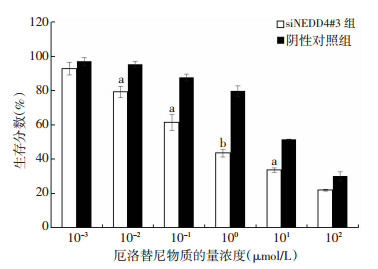
|
| a:P<0.05;b:P<0.01,与阴性对照组比较 图 4 不同物质的量浓度厄洛替尼对各转染组细胞生存分数的影响(n=3,x±s) |
2.5 敲低NEDD4改善耐药性机制探讨
为探索敲低NEDD4表达改善HCC827/ER细胞耐药的机制,在siNEDD4转染HCC827/ER细胞后,检测NEDD4、Akt及p-Akt蛋白的表达(图 5)。结果显示,转染siNEDD4的HCC827/ER细胞中,NEDD4和p-Akt蛋白的表达较阴性对照组细胞都有明显的降低。提示敲低NEDD4从而增加HCC827/ER细胞对厄洛替尼的敏感性是通过降低PI3K/Akt信号通路的活性来实现的。

|
| 1:阴性对照组;2:siNEDD4#3组 图 5 抑制NEDD4的表达后NEDD4、Akt、pAkt蛋白的变化 |
2.6 敲低NEDD4增强肿瘤对厄洛替尼的敏感性,并增加裸鼠的治疗获益
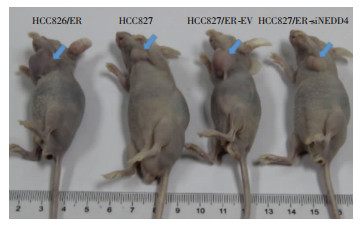
为进一步验证敲低NEDD4能增强肿瘤细胞对厄洛替尼的敏感性,将目的细胞接种于裸鼠(图 6), HCC827组[(4.7±0.6) mm]肿瘤直径显著低于HCC827/ER组[(11.0±2.6) mm, P<0.05], HCC827/ER-siNEDD4组[(5.7±0.6) mm]肿瘤直径也显著低于HCC827/ER-EV组[(10.3±2.5) mm, P<0.05]。说明厄洛替尼能明显抑制HCC827细胞组肿瘤的生长。HCC827/ER-siNEDD4组肿瘤生长较HCC827/ER-EV组也受到了明显抑制。
|
 :示肿瘤结节
图 6
厄洛替尼抑制NEDD4敲低组小鼠肿瘤增长的大体观察 :示肿瘤结节
图 6
厄洛替尼抑制NEDD4敲低组小鼠肿瘤增长的大体观察
|
3 讨论
NEDD4是E3泛素连接酶家族的重要成员,在前列腺癌、膀胱癌、结肠癌以及乳腺癌等多种肿瘤组织中均有异常表达[8, 10-11]。AMODIO等[12]对103例原发性NSCLC标本进行检测,发现82例NEDD4表达增强,且其表达水平与肿瘤远处转移呈正相关。提示其异常表达与肿瘤的发生与进展有着密切的关系。但其与肿瘤耐药的关系鲜有报道。本实验通过对比HCC827和HCC827/ER细胞中NEDD4 mRNA及蛋白表达,发现HCC827/ER细胞中NEDD4 mRNA和蛋白表达明显高于其亲本细胞。敲低NEDD4在HCC827/ER细胞中的表达后,HCC827/ER细胞对厄洛替尼的敏感性获得明显提高。活体实验也证实敲低HCC827/ER细胞中NEDD4的表达能够明显增加厄洛替尼对荷瘤小鼠的治疗获益。提示NEDD4的表达增高是HCC827/ER细胞厄洛替尼继发耐药的一个重要原因。
NEDD4具有E3泛素连接酶活性,可通过蛋白质泛素化途径降解多种蛋白, 从而发挥其生物学功能。有研究表明,NEDD4通过泛素化降解LATS1(large tumour suppressor kinase 1,LATS1),使YAP1的表达增高,从而调节Hippo信号通路的活性[13]。WANG等[14]指出,NEDD4促进PTEN多泛素化降解,致使PI3K/PTEN/Akt信号通路活化,发挥其促肿瘤功能。也有报道称NEDD4能与衔接蛋白Grb10结合,从而调节IGF-1/PI3K/Akt信号通路的活性[15]。CAO等[16]发现NEDD4-/-的小鼠因IGF-1的降低而生长迟滞,更进一步证明了NEDD4是通过调节IGF-1的表达来调控细胞增殖、生长、分化及迁移的。本课题组前期研究结果显示[9, 17-18],IGF-R、YAP1的增高和PTEN降低均是NSCLC厄洛替尼继发耐药的重要原因。但NEDD4是通过何种途径促进NSCLC厄洛替尼继发耐药仍需进一步探讨。本研究结果显示,在NEDD4高表达的HCC827/ER细胞中,其PI3K/Akt信号通路的活性也较HCC827细胞中明显增高,抑制NEDD4的表达后,PI3K/Akt通路活性随之下降,提示NEDD4促进NSCLC厄洛替尼继发耐药是通过PI3K/Akt通路活化实现的。后续的研究我们将围绕NEDD4是通过何种途径促使PI3K/Akt通路活化展开,进一步阐明NEDD4促进NSCLC继发厄洛替尼耐药的分子机制。
YE等[19]提出,NEDD4调节着诸多肿瘤发生与进展相关的信号通路,是一个很有前景的肿瘤治疗的靶点。本实验证实,NEDD4高表达在NSCLC厄洛替尼继发耐药中发挥着重要作用,抑制NEDD4的表达能够显著提高NSCLC对厄洛替尼的敏感性。因此,NEDD4可以作为克服NSCLC厄洛替尼继发耐药的一个靶点。聚焦NEDD4的调节,也将为克服耐药打开新的思路,同时也为NSCLC患者的个体化治疗提供指导性建议。
| [1] | MALVEZZI M, BERTUCCIO P, ROSSO T, et al. European cancer mortality predictions for the year 2015: does lung cancer have the highest death rate in EU women?[J]. Ann Oncol, 2015, 26(4): 779–786. DOI:10.1093/annonc/mdv001 |
| [2] | RECK M, POPAT S, REINMUTH N, et al. Metastatic non-small-cell lung cancer (NSCLC): ESMO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2014, 25(Suppl 3): i27–i29. DOI:10.1093/annonc/mdu199 |
| [3] | ZHOU C, WU Y L, CHEN G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study[J]. Lancet Oncol, 2011, 12(8): 735–742. DOI:10.1016/S1470-2045(11)70184-X |
| [4] | D'ADDARIO G, FELIP E. Non-small-cell lung cancer: ESMO clinical recommendations for diagnosis, treatment and follow-up[J]. Ann Oncol, 2009, 20((Suppl 4)): 68–70. DOI:10.1093/annonc/mdp132 |
| [5] | KOBAYASHI S, BOGGON T J, DAYARAM T, et al. EGFR mutation and resistance of non-small-cell lung cancer to gefitinib[J]. N Engl J Med, 2005, 352(8): 786–792. DOI:10.1056/NEJMoa044238 |
| [6] | BEAN J, BRENNAN C, SHIH J Y, et al. MET amplification occurs with or without T790M mutations in EGFR mutant lung tumors with acquired resistance to gefitinib or erlotinib[J]. Proc Natl Acad Sci U S A, 2007, 104(52): 20932–20937. DOI:10.1073/pnas.0710370104 |
| [7] | YANO S, WANG W, LI Q, et al. Hepatocyte growth factor induces gefitinib resistance of lung adenocarcinoma with epidermal growth factor receptor-activating mutations[J]. Cancer Res, 2008, 68(22): 9479–9487. DOI:10.1158/0008-5472.CAN-08-1643 |
| [8] | CHEN C, MATESIC L E. The Nedd4-like family of E3 ubiquitin ligases and cancer[J]. Cancer Metastasis Rev, 2007, 26(3/4): 587–604. DOI:10.1007/s10555-007-9091-x |
| [9] | HAN J, ZHAO F, ZHANG J, et al. miR-223 reverses the resistance of EGFR-TKIs through IGF1R/PI3K/Akt signaling pathway[J]. Int J Oncol, 2016, 48(5): 1855–1867. DOI:10.3892/ijo.2016.3401 |
| [10] | EIDE P W, CEKAITE L, DANIELSEN S A, et al. NEDD4 is overexpressed in colorectal cancer and promotes colonic cell growth independently of the PI3K/PTEN/AKT pathway[J]. Cell Signal, 2013, 25(1): 12–18. DOI:10.1016/j.cellsig.2012.08.012 |
| [11] | JUNG S, LI C, JEONG D, et al. Oncogenic function of p34SEI-1 via NEDD41mediated PTEN ubiquitination/degradation and activation of the PI3K/AKT pathway[J]. Int J Oncol, 2013, 43(5): 1587–1595. DOI:10.3892/ijo.2013.2064 |
| [12] | AMODIO N, SCRIMA M, PALAIA L, et al. Oncogenic role of the E3 ubiquitin ligase NEDD4-1, a PTEN negative regulator, in non-small-cell lung carcinomas[J]. Am J Pathol, 2010, 177(5): 2622–2634. DOI:10.2353/ajpath.2010.091075 |
| [13] | SALAH Z, COHEN S, ITZHAKI E, et al. NEDD4 E3 ligase inhibits the activity of the hippo pathway by targeting LATS1 for degradation[J]. Cell Cycle, 2013, 12(24): 3817–3823. DOI:10.4161/cc.26672 |
| [14] | WANG X, TROTMAN L C, KOPPIE T, et al. NEDD4-1 is a proto-oncogenic ubiquitin ligase for PTEN[J]. Cell, 2007, 128(1): 129–139. DOI:10.1016/j.cell.2006.11.039 |
| [15] | MORRIONE A, PLANT P, VALENTINIS B, et al. mGrb10 interacts with Nedd4[J]. J Biol Chem, 1999, 274(34): 24094–24099. DOI:10.1074/jbc.274.34.24094 |
| [16] | CAO X R, LILL N L, BOASE N, et al. Nedd4 controls animal growth by regulating IGF-1 signaling[J]. Sci Signal, 2008, 1(38): ra5. DOI:10.1126/scisignal.1160940 |
| [17] | ZHAO F Y, HAN J, CHEN X W, et al. miR-223 enhances the sensitivity of non-small cell lung cancer cells to erlotinib by targeting the insulin-like growth factor-1 receptor[J]. Int J Mol Med, 2016, 38(1): 183–191. DOI:10.3892/ijmm.2016.2588 |
| [18] |
王江, 王旭东, 赵凤仪, 等. YAP1在人肺腺癌细胞厄洛替尼耐药中的作用[J].
军事医学, 2016, 40(1): 35–39.
WANG J, WANG X D, ZHAO F Y, et al. Effect of YAP1 on erlotinib-resistance in lung adenocarcinoma cells[J]. Mil Med Sci, 2016, 40(1): 35–39. DOI:10.7644/j.issn.1674-9960.2016.01.009 |
| [19] | YE X, WANG L, SHANG B, et al. NEDD4: a promising target for cancer therapy[J]. Curr Cancer Drug Targets, 2014, 14(6): 549–556. DOI:10.2174/1568009614666140725092430 |




