新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是早产儿和低出生体质量新生儿最常见的胃肠道病症,病死率较高,存活患儿遗留不同程度后遗症。早产儿肠道屏障功能不成熟,肠道菌群异常定植,菌群及其产物通过模式识别受体(microbial-associated molecular patterns,MAMPs)被肠道上皮Toll样受体识别,并使其活化,启动一系列信号转导途径,导致细胞因子和趋化因子的产生(如TNF-α、IL-1、IL-6、IL-8以及PAF等因子),促进炎症发生,加重肠道损伤[1-2]。
Syndecan-1可维持肠道紧密连接完整性。在损伤和炎症时,上皮细胞的Syndecan-1蛋白水平下调,其胞外域游离蛋白增多,游离HS链可通过抑制白细胞的黏附,参与炎症[3]。Syndecan-1HS链的脱落是一个依赖金属蛋白酶-7(matrix metalloproteinase-7,MMP-7) 的过程。而IL-1β通过细胞内信号转导可增强MMP-7的表达[4],TNF-α可以诱导细胞IL-1β的产生。
那么Syndecan-1在新生大鼠发生坏死性小肠结肠炎时表达有何变化?研究表明生后1~2周的早产儿肠道中双歧杆菌缺失,而补充双歧杆菌可以降低NEC的发生率[5]。但是双歧杆菌保护NEC肠道炎症的具体机制不清楚。有研究表明双歧杆菌通过调节紧密连接而改善肠道通透性[6],但是,双歧杆菌如何调节Syndecan-1目前研究较少。
本研究采用新生大鼠NEC模型,双歧杆菌治疗NEC模型,检测TNF-α、IL-1β、MMP-7和Syndecan-1的表达,探究在NEC肠道损伤时,Syndecan-1在其中的意义,以及双歧杆菌的保护作用,为双歧杆菌治疗NEC提供进一步理论支持。
1 材料与方法 1.1 实验动物、主要试剂与仪器30只清洁级新生1 d龄SD大鼠,购自重庆医科大学实验动物中心,雌雄不限,体质量5~10 g。雅培加营素蛋白质粉购自美国雅培公司,多美滋婴儿配方奶粉购自法国多美滋公司,中/长链脂肪乳注射液(C6-24)购自华瑞制药有限公司。E-coli O55:B5脂多糖(lipopolysaccharide,LPS)购自美国Sigma公司。Syndecan-1(ab34164) 单克隆抗体购自美国Abcam公司,山羊抗小鼠二抗购自中杉金桥公司,DAB显色试剂盒购自中杉金桥公司,各相关因子引物由上海生工生物工程股份有限公司合成。RNA提取试剂盒美国Promega试剂盒,购自重庆荣达生物技术有限公司。反转录试剂盒Promega试剂盒。RT-PCR扩增试剂盒Bio-Rad试剂盒购自美国Bio-Rad。蛋白提取试剂盒购自凯基生物技术股份有限公司。便携式数字测氧仪(CY-100) 购自浙江建德仪器设备厂,根据实验要求自制新生鼠保育箱及缺氧箱。
1.2 实验方法 1.2.1 建立NEC大鼠模型参照本课题组新生大鼠人工喂养+LPS灌胃+缺氧复氧冷刺激建立NEC模型构建[7-8]。新生SD大鼠在出生后24 h与母鼠分离,放置在自制保育箱内(控制保育箱内温度28 ℃~30 ℃,湿度45%~65%),采用鼠乳代用品喂养。代乳品参考AUESTAD等[9]报道配制,用清洁无菌1.9 F硅胶管每4 h经口插管喂养1次,首次喂养量为0.1 mL,以后每24 h增加0.1~0.3 mL。LPS以5 mg/kg稀释于0.1 mL灭菌水中,每日灌胃1次,连续3 d。将新生SD大鼠置入缺氧箱中,测氧仪调零后将探头连接于密闭缺氧箱顶端缺口处,胶布封闭,入气孔中充入纯N2,控制N2流量为15 L/min,箱内氧气浓度降至零后迅速将新生鼠置入,持续通入N2,维持1 000 mL/L N2 3 min后打开箱盖取出新生鼠,随即将其置于1 000 mL/L氧气环境之氧仓中,保持3 min后立即将其置于4℃冰箱中刺激10 min。每日在10:00和20:00分别进行一次缺氧+复氧+冷刺激,连续3 d。
1.2.2 实验动物分组及处理新生大鼠生后24 h分成3组,每组10只。健康对照组:生后24 h继续与母鼠同笼,鼠乳喂养,共3 d;NEC组:新生大鼠生后24 h进行新生鼠NEC动物模型构建;双歧杆菌干预组(C组):建立新生鼠NEC动物模型后,双歧杆菌(0.04 g/只,即2×108CFU/只)灌胃3 d,每天2次。
1.2.3 标本的收集造模成功后新生大鼠,空腹24 h后脱臼处死,清洁并消毒腹部皮肤,打开腹腔,仔细分离肠系膜及血管后取出十二指肠下端至回盲部肠管,取近回盲部肠组织2~3 cm固定于多聚甲醛中,石蜡包埋、切片,进行HE染色镜检,免疫组化检测Syndecan-1蛋白表达。剩余肠段组织置于冻存管中-80 ℃保存备用,提取RNA。
1.2.4 qRT-PCR检测TNF-α、IL-1β、MMP-7和Syndecan-1的mRNA表达水平严格依据检测试剂盒说明书操作如下:肠组织称量后,提取RNA,检测RNA浓度后,使用Eastep RT Master Mix反转录试剂盒将mRNA反转录成cDNA。反转录反应条件为:37 ℃ 15 min,98 ℃ 15 min,4 ℃保存。获取的cDNA稀释5~10倍,-20 ℃保存备用。利用2×SYBR Real-time PCR premixture试剂盒,行实时荧光定量PCR,加样体系为2×Mix 10 μL,Primer 1.6 μL,cDNA 2 μL,加水至20 μL,在Bio-Rad实时荧光定量PCR仪上程序为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃(或每对引物的最适退火温度)退火延伸30 s共计40个循环,65 ℃下30 s,逐渐升温至95 ℃下溶解曲线分析。待测目的基因均以GAPDH为内参。IL-1β(118 bp)的引物序列正义链为5′-ATGCCTCGTGCTGTCT-3′,反义链为5′-TCGTTGCTTGTCTCTCCTTG-3′;MMP-7(107 bp)的引物序列正义链为5′-GGACAAACTGAGGGAAATGC-3′,反义链为5′-CATCTGGCACTCCACACCT-3′;TNF-α(147 bp)的引物序列正义链为5′-GTCGTAGCAAACCACCAAGC-3′,反义链为5′-GAAGAGAACCTGGGAGTAGATAAGG-3′;Syndecan-1(120 bp)的引物序列正义链为5′-TGAAACATCTGGGGAGAACA-3′,反义链为5′-AGCACTTCCTTCCTGTCCAA-3′;GAPDH(110 bp)的引物序列正义链为5′-CCTGGAGAAACCTGCCAAG-3′,反义链为5′-CACAGGAGACAACCTGGTCC-3′。
1.2.5 Western blot检测Syndecan-1蛋白表达水平称取等质量肠组织提取总蛋白。蛋白变性后行电泳、转膜、孵育抗体,一抗(抗Syndecan-1抗体,稀释度为1:400,抗β-actin抗体稀释度为1:1 000) 置于4 ℃冰箱摇床孵育过夜,辣根过氧化物酶(HRP)标记羊抗兔二抗(抗体稀释度为1:5 000) 室温震荡孵育1 h,ECL化学发光显影。
1.2.6 免疫组化检测Syndecan-1蛋白表达水平石蜡切片,常规脱蜡、水化、抗原修复后,PBS漂洗3次每次5 min;胎牛血清在室温下封闭30 min,PBS液漂洗3次每次5 min;滴加小鼠抗大鼠Syndecan-1单克隆抗体(抗体稀释度为1:100)4 ℃冰箱孵育过夜,PBS液漂洗;滴加生物素化的山羊抗小鼠IG抗体室温孵育60 min,PBS液冲洗;DAB显色5~8 min,苏木精复染、透明、干燥后中性树脂胶封片镜下观察。
1.3 统计学方法采用GraphPad Prism 5.0统计软件,所有计量资料均以x±s表示,两两比较用t检验。
2 结果 2.1 新生大鼠肠组织病理学形态和病理评分光学显微镜观察显示:健康对照组大鼠肠组织结构清晰正常,无中性粒细胞浸润,上皮完整连续,腺体排列规则,绒毛高耸整齐,黏膜层,黏膜下层,固有层无充血水肿甚至断裂分离(图 1A)。NEC组大鼠肠组织坏死严重,肠壁绒毛参差不齐,变性水肿,部分绒毛坏死,脱落消失,腺体排列紊乱消失,肌层变薄甚至断裂,固有层与黏膜下层重度水肿,可见中性粒细胞浸润(图 1B)。C组肠黏膜及黏膜下层可见轻中度水肿充血,绒毛水肿,腺体结构紊乱,部分肠管病变不十分明显,部分可见中性粒细胞浸润(图 1C)。
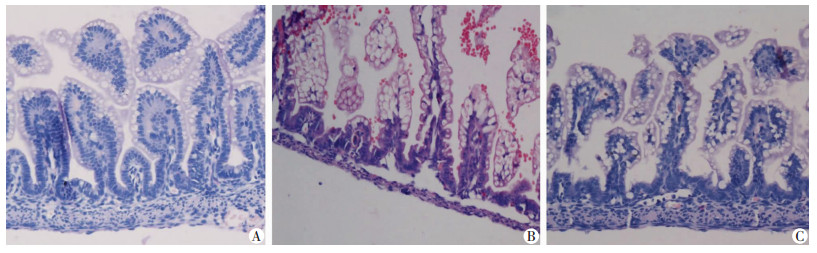
|
| A:健康对照组;B:NEC组;C:双歧杆菌组 图 1 HE染色观察各组大鼠肠组织病理学变化(LM ×200) |
2.2 qRT-PCR检测大鼠肠组织TNF-α、IL-1β、MMP-7和Syndecan-1的mRNA表达水平
qRT-PCR检测细胞因子TNF-α和IL-1β mRNA表达水平结果显示:NEC组TNF-α mRNA表达水平明显高于健康对照组,差异有统计学意义(图 2A,P<0.01)。NEC组IL-1β mRNA表达水平也高于健康对照组,差异有统计学意义(图 2B,P<0.05)。双歧杆菌干预组TNF-α和IL-1β与NEC组相比明显下降(P<0.01),差异有统计学意义。此结果说明NEC时TNF-α、IL-1β参与了肠道炎症,并且双歧杆菌可抑制TNF-α、IL-1β的表达。

|
| A:TNF-α mRNA;B:IL-1β mRNA;C:MMP-7 mRNA;D:Syndecan-1 mRNA a:P<0.01, 与健康对照组比较;b:P<0.01, c:P<0.05, 与双歧杆菌组比较 图 2 qRT-PCR检测各组大鼠肠组织各因子mRNA表达水平变化(n=10,x±s) |
qRT-PCR检测各组MMP-7 mRNA表达水平,结果显示,NEC组比健康对照组明显升高(图 2C,P<0.01),与TNF-α、IL-1β的表达变化有相同的趋势。而双歧杆菌干预使MMP-7 mRNA表达水平下降(图 2C,P<0.05)。
NEC组Syndecan-1 mRNA的表达水平略高于健康对照组,但二者差异无统计学意义(图 2D,P>0.05)。NEC组和双歧杆菌组Syndecan-1的mRNA水平与对照组相比差异均无统计学意义(图 2D,P>0.05)。说明发生NEC时,以及双歧杆菌干预均未能引起Syndecan-1的mRNA表达变化。
2.3 Western blot检测大鼠肠组织Syndecan-1蛋白表达水平Western blot结果显示(图 3):对照组Syndecan-1蛋白呈高水平表达,而NEC组几乎未检测到Syndecan-1蛋白的表达。两组对比,表达差异有统计学意义。双歧杆菌干预后Syndecan-1又有所表达,与NEC组相比差异有统计学意义。说明发生NEC时Syndecan-1蛋白参与了炎症发生,可能发生了脱落,而双歧杆菌对其有修复作用。
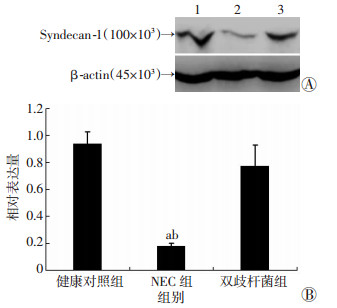
|
| 1:健康对照组;2:NEC组;3:双歧杆菌组;A:Western blot检测结果;B:半定量分析结果(n=10,x±s) a: P<0.01, 与健康对照组比较;b:P<0.01, 与双歧杆菌组比较 图 3 Western blot检测各组大鼠肠组织Syndecan-1蛋白表达 |
2.4 免疫组化检测大鼠肠组织Syndecan-1蛋白表达水平
Syndecan-1主要分布于细胞膜,炎症时从细胞膜脱落。免疫组化结果显示,对照组(图 4A)绒毛上皮细胞膜呈深棕色,而NEC组(图 4B)绒毛上皮细胞膜棕色染色明显减弱,双歧杆菌组上皮细胞膜呈淡棕色,与Western blot检测蛋白表达水平结果一致(图 4C)。
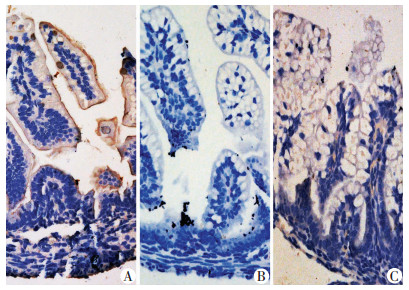
|
| A:健康对照组;B:NEC组;C:双歧杆菌组 图 4 免疫组化检测各组大鼠肠组织Syndecan-1表达(二步法×200) |
3 讨论
NEC是新生儿尤其是早产儿死亡的重要原因,病死率较高。目前所知早产、缺氧、喂养不当、细菌感染、肠道缺血等多种因素可导致NEC并引起炎症连锁反应[10],但其确切的发病原因和机制仍不十分清楚。
Syndecan-1主要于上皮细胞表达,其结构包括跨膜的核心蛋白和连接于核心蛋白上的硫酸乙酰肝素(heparansulphate,HS)链及硫酸软骨素(chondroitin sulphate,CS)链。其核心蛋白包括胞内区、跨膜区和胞外区。胞外区由HS链和CS链连接于Syndecan-1核心蛋白构成,HS链脱落后结合胞外配体发挥生理功能。研究表明在损伤和炎症时,Syndecan-1蛋白会发生胞外域HS链的脱落[11]。本研究发现NEC时肠组织的Syndecan-1 mRNA水平虽与对照组差异无统计学意义,但Western blot检测到Syndecan-1的蛋白表达水平却明显下降,推测是因为其HS链发生了脱落,而不是由于mRNA水平减少所致。Syndecan-1胞外域的脱落在炎症和肿瘤中是一个重要的生理过程,脱落后成为的游离Syndecan-1包含完整的HS链,并可在体液中[12]检测到,其可结合相关因子产生炎症反应,如可与IL-8结合,通过抑制白细胞-内皮细胞间的反应而起作用[13]。MARY[14]和THOMAS[15]的两项研究表明NEC患儿血清中IL-8是升高的。由此推测,NEC时,脱落的HS链可能与体液中IL-8作用,加剧炎症反应。
目前已知的可促进Syndecan-1胞外域脱落的因子包括MMP-7、MMP-9、MT-MMP1、ADAM10、ADAM17以及解聚素[16]。基质金属蛋白酶(MMPs)是一类锌离子依赖性内肽酶,在正常创面修复期间,降解细胞外基质(extracellular matrix,ECM)、清除失活组织、重塑底层结缔组织、迁移炎性细胞以及血管再生[17-20]。MMP-7具有MMPs的一般特性。BISTER[21]证实在NEC患儿的肠道组织中MMP-7表达上调。本研究结果也同样证实在NEC大鼠模型中,MMP-7的表达水平是升高的。我们和BISTER等[21]的结果均表明MMP-7在NEC肠道损伤中表达上调。研究证明,MMP-7切割Syndecan-1的机制可能是由于其可以与细胞膜表面的HS链结合[22],本研究发现NEC模型组MMP-7的mRNA表达水平是升高的,而Syndecan-1的mRNA水平虽与对照组差异无统计学意义,但是蛋白水平降低,说明Syndecan-1蛋白参与了新生大鼠坏死性结肠炎的发生过程,且其减少不是由于mRNA水平减少所致,而是MMP-7与HS链结合使其从Syndecan-1蛋白脱落。
TNF-α,是一类促炎因子,在NEC模型中血浆TNF-α水平是增加的[23],本研究发现NEC模型新生大鼠TNF-α表达水平高于对照组。大量研究表明,IL-1β在各种生理和病理情况中都与TNF-α紧密相关,且TNF-α可以诱导细胞IL-1β的产生。本研究中新生大鼠发生坏死性小肠结肠炎时IL-1β表达水平也是升高的。IL-1β通过细胞内信号转导可增强MMP-7的表达[24-25],而MMP-7能切割Syndecan-1使其脱落,我们推测IL-1β调节了Syndecan-1在NEC中的作用。另外,研究表明,游离的HS链可以与TNF-α结合,减弱活化因子的浓度[26]。因此认为在炎症过程中,HS链发挥了调节炎症的中心作用。
早产儿肠道发育不成熟,肠道菌群异常定植,生后1~2周缺乏对肠道有益的双歧杆菌。肠道菌群紊乱的早产儿容易发生坏死性小肠结肠炎,而补充双歧杆菌后,可减少早产儿病死率,改善早产儿肠道菌群紊乱,减弱NEC的严重程度,说明双歧杆菌对新生儿的肠道具有保护作用。由于肠道中的微环境复杂,双歧杆菌发挥保护作用的机制目前还不明确。研究表明双歧杆菌通过zonulin影响肠道上皮的通透性[6],且在一定程度上降低NEC时炎症因子的表达。文献[27]的研究发现给予外源性TNF-α后Syndecan-1表达下降,本研究证实在新生大鼠坏死性小肠结肠炎中,双歧杆菌抑制TNF-α和IL-1β的表达同时也抑制了MMP-7的表达,使得Syndecan-1蛋白表达水平降低。因此我们推测双歧杆菌通过调节MMP-7对Syndecan-1的切割,阻止了Syndecan-1的胞外域脱落,从而发挥其保护作用,为双歧杆菌的治疗作用提供了理论支持。
综上所述,本研究证实在大鼠NEC模型肠道组织中TNF-α、IL-1β、MMP-7的mRNA表达水平均上调,而Syndecan-1蛋白表达下降。我们推测,NEC炎症发生时,TNF-α促进了IL-1β的表达,IL-1β通过增强MMP-7的表达,从而完成对Syndecan-1的切割。双歧杆菌抑制炎症因子的同时保护了肠黏膜的Syndecan-1蛋白,以此来保护肠道黏膜屏障。本研究为临床应用双歧杆菌治疗NEC提供了进一步理论支持,但是在复杂的肠道微环境中,对双歧杆菌如何调节MMP-7保护Syndecan-1蛋白的机制仍需要进一步确切研究。
| [1] | MAHESHWARI A, LACSON A, LU W, et al. Interleukin-8/CXCL8 forms an autocrine loop in fetal intestinal mucosa[J]. Pediatr Res, 2004, 56(2): 240–249. DOI:10.1203/01.PDR.0000133196.25949.98 |
| [2] | DAIG R, ROGLER G, ASCHENBRENNER E, et al. Human intestinal epithelial cells secrete interleukin-1 receptor antagonist and interleukin-8 but not interleukin-1 or interleukin-6[J]. Gut, 2000, 46(3): 350–358. DOI:10.1136/gut.46.3.350 |
| [3] | LI Q, PARK P W, WILSON C L, et al. Matrilysin shedding of syndecan-1 regulates chemokine mobilization and transepithelial efflux of neutrophils in acute lung injury[J]. Cell, 2002, 111(5): 635–646. DOI:10.1016/s0092-8674(02)01079-6 |
| [4] | GUAN P P, YU X, GUO J J, et al. By activating matrix metalloproteinase-7, shear stress promotes chondrosarcoma cell motility, invasion and lung colonization[J]. Oncotarget, 2015, 6(11): 9140–9159. DOI:10.18632/oncotarget.3274 |
| [5] | BIN-NUN A, BROMIKER R, WILSCHANSKI M, et al. Oral probiotics prevent necrotizing enterocolitis in very low birth weight neonates[J]. J Pediatr, 2005, 147(2): 192–196. DOI:10.1016/j.jpeds.2005.03.054 |
| [6] |
向玲, 杜维霞, 刘依枫, 等. 双歧杆菌通过zonulin影响坏死性小肠结肠炎新生大鼠模型肠道通透性[J].
第三军医大学学报, 2016, 38(05): 469–475.
XIANG L, DU W X, LIU Y F, et al. Effect of bifidobacterium on intestinal permeability and expression of zonulin in neonatal rats with necrotizing enterocolitis[J]. J Third Mil Med Univ, 2016, 38(05): 469–475. DOI:10.16016/j.1000-5404.201507127 |
| [7] |
李金纯, 韦红, 贾盛华, 等. 新生儿坏死性小肠结肠炎动物模型建立方法改进与比较[J].
重庆医科大学学报, 2009, 34(3): 313–317.
LI J C, WEI H, JIA S H, et al. Improvement and comparison of animal models of neonatal necrotizing enterocolitis[J]. J Chongqing Med Univ, 2009, 34(3): 313–317. |
| [8] |
魏小娣, 韦红, 贾盛华, 等. 姜黄素对新生大鼠坏死性小肠结肠炎模型NF-κB, TNF-α及IL-6表达的影响[J].
第四军医大学学报, 2009, 30(22): 2537–2540.
WEI X D, WEI H, JIA S H, et al. Effect of curcumin on expression of nuclear factor-κB, tumor necrosis facror-α and interleukin-6 in necrotizing enterocolitis rat model[J]. J Fourth Mil Med Univ, 2009, 30(22): 2537–2540. DOI:10.3321/j.issn:1000-2790.2009.22.013 |
| [9] | AUESTAD N, KORSAK R A, BERGSTROM J D, et al. Milk-substitutes comparable to rat's milk; their preparation, composition and impact on development and metabolism in the artificially reared rat[J]. Br J Nutr, 1989, 61(3): 495–518. DOI:10.1079/BJN19890139 |
| [10] | MATSUNO K, ADACHI Y, YAMAMOTO H, et al. The expression of matrix metalloproteinase matrilysin indicates the degree of inflammation in ulcerative colitis[J]. J Gastroenterol, 2003, 38(4): 348–354. DOI:10.1007/s005350300062 |
| [11] | FITZGERALD M L, WANG Z, PARK P W, et al. Shedding of syndecan-1 and -4 ectodomains is regulated by multiple signaling pathways and mediated by a TIMP-3-sensitive metalloproteinase[J]. J Cell Biol, 2000, 148(4): 811–824. DOI:10.1083/jcb.148.4.811 |
| [12] | HOOPER N M, KARRAN E H, TURNER A J. Membrane protein secretases[J]. Biochem J, 1997, 321(Pt 2): 265–279. DOI:10.1042/bj3210265 |
| [13] | MARSHALL L J, RAMDIN L S, BROOKS T, et al. Plasminogen activator inhibitor-1 supports IL-8-mediated neutrophil transendothelial migration by inhibition of the constitutive shedding of endothelial IL-8/heparan sulfate/syndecan-1 complexes[J]. J Immunol, 2003, 171(4): 2057–2065. DOI:10.4049/jimmunol.171.4.2057 |
| [14] | EDELSON M B, BAGWELL C E, ROZYCKI H J. Circulating pro-and counterinflammatory cytokine levels and severity in necrotizing enterocolitis[J]. Pediatrics, 1999, 103(4 Pt 1): 766–771. DOI:10.1542/peds.103.4.766 |
| [15] | BENKOE T, RECK C, GLEISS A, et al. Interleukin 8 correlates with intestinal involvement in surgically treated infants with necrotizing enterocolitis[J]. J Pediatr Surg, 2012, 47(8): 1548–1554. DOI:10.1016/j.jpedsurg.2011.11.049 |
| [16] | WANG X, ZUO D, CHEN Y, et al. Shed Syndecan-1 is involved in chemotherapy resistance via the EGFR pathway in colorectal cancer[J]. Br J Cancer, 2014, 111(10): 1965–1976. DOI:10.1038/bjc.2014.493 |
| [17] | RAVANTI L, KÄHÄRI V M. Matrix metalloproteinases in wound repair (review)[J]. Int J Mol Med, 2000, 6(4): 391–407. |
| [18] | BAKER E A, LEAPER D J. Profiles of matrix metalloproteinases and their tissue inhibitors in intraperitoneal drainage fluid: relationship to wound healing[J]. Wound Repair Regen, 2003, 11(4): 268–274. DOI:10.1046/j.1524-475x.2003.11406.x |
| [19] | SCHUPPAN D, FREITAG T. Fistulising Crohn's disease: MMPs gone awry[J]. Gut, 2004, 53(5): 622–624. DOI:10.1136/gut.2003.034207 |
| [20] | VISSE R, NAGASE H. Matrix metalloproteinases and tissue inhibitors of metalloproteinases: structure, function, and biochemistry[J]. Circ Res, 2003, 92(8): 827–839. DOI:10.1161/01.RES.0000070112.80711.3D |
| [21] | BISTER V, SALMELA M T, HEIKKILÄ P, et al. Matrilysins-1 and -2 (MMP-7 and -26) and metalloelastase (MMP-12), unlike MMP-19, are up-regulated in necrotizing enterocolitis[J]. J Pediatr Gastroenterol Nutr, 2005, 40(1): 60–66. DOI:10.1097/00005176-200501000-00011 |
| [22] | YU W H, WOESSNER J F. Heparan sulfate proteoglycans as extracellular docking molecules for matrilysin (matrix metalloproteinase 7)[J]. J Biol Chem, 2000, 275(6): 4183–4191. DOI:10.1074/jbc.275.6.4183 |
| [23] | CAPLAN M S, SUN X M, HSEUH W, et al. Role of platelet activating factor and tumor necrosis factor-alpha in neonatal necrotizing enterocolitis[J]. J Pediatr, 1990, 116(6): 960–964. DOI:10.1016/s0022-3476(05)80661-4 |
| [24] | KLEIN R D, BORCHERS A H, SUNDARESHAN P, et al. Interleukin-1beta secreted from monocytic cells induces the expression of matrilysin in the prostatic cell line LNCaP[J]. J Biol Chem, 1997, 272(22): 14188–14192. DOI:10.1074/jbc.272.22.14188 |
| [25] | MAUVIEL A. Cytokine regulation of metalloproteinase gene expression[J]. J Cell Biochem, 1993, 53(4): 288–295. DOI:10.1002/jcb.240530404 |
| [26] | BODE L, SALVESTRINI C, PARK P W, et al. Heparan sulfate and syndecan-1 are essential in maintaining murine and human intestinal epithelial barrier function[J]. J Clin Invest, 2008, 118(1): 229–238. DOI:10.1172/JCI32335 |
| [27] | DAY R M, MITCHELL T J, KNIGHT S C, et al. Regulation of epithelial syndecan-1 expression by inflammatory cytokines[J]. Cytokine, 2003, 21(5): 224–233. DOI:10.1016/s1043-4666(03)00091-7 |



