类鼻疽伯克霍尔德菌(Burkholderia pseudomallei,简称类鼻疽杆菌),是一种革兰阴性短杆菌,感染后能引起一种以肺炎和多发性肺脓肿为典型临床表现的疾病即类鼻疽病。类鼻疽病的主要流行区域是东南亚和澳洲北部,但近年来其全球分布呈不断扩大趋势,我国东南部已经成为类鼻疽病流行区域[1]。类鼻疽病的主要感染途径为吸入气溶胶感染或经破损的皮肤感染。类鼻疽杆菌感染可发展为急性感染、慢性感染和隐性感染,潜伏期最长可达几十年。类鼻疽杆菌急性感染的特点是易发生菌血症,一旦引起败血性休克有很高的死亡率。而类鼻疽杆菌慢性感染的症状较轻,常表现为难以根除的局部持续性感染,容易复发。类鼻疽病危害严重,但迄今为止大多数研究主要集中在疾病的急性感染过程,并不清楚类鼻疽杆菌是如何逃避免疫反应并导致了慢性感染[2]。
动物模型作为研究病原菌与宿主相互作用机制的重要手段,能够用于宿主对病原的免疫应答、病原毒力因子确定、病原对宿主侵袭和定植等方面的研究。由于目前国内尚无类鼻疽杆菌慢性感染动物模型方面的研究,且我国类鼻疽病流行区域覆盖了东南部重要的经济中心和军事战略中心,所以类鼻疽杆菌慢性感染动物模型的建立具有重要的社会意义和军事价值。据已有的文献报道,小鼠、豚鼠、大鼠、雪貂、家兔、山羊和猕猴等动物均可用于构建类鼻疽杆菌感染模型[3],而小鼠模型是最常用的动物模型。本研究拟采用本室鉴定的国内标准菌株BPC006滴鼻感染BALB/c小鼠,建立慢性类鼻疽病模型,以期为该菌致病机制研究、疫苗研发和药物评价奠定基础[4-6]。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级、6~8周龄、体质量18~20 g的90只雌性BALB/c小鼠由第三军医大学实验动物中心提供(生产许可证号:SCXK-PLA-20120011,使用许可证号:SYXK-PLA-20120031)。动物实验在第三军医大学实验动物中心进行,实验方案得到第三军医大学实验动物福利伦理审查委员会的批准,符合中国动物实验的福利伦理准则,并按实验动物使用的3R原则给予人道的关怀。
1.1.2 菌株国内类鼻疽杆菌标准株BPC006,从海南省人民医院类鼻疽患者临床标本中分离并鉴定,本实验室保存[6]。本实验与BPC006菌株相关的所有操作均在P2+实验室进行。
1.1.3 试剂细菌DNA基因组提取试剂盒购自中国大连TaKaRa公司;10 mmol/L的PBS、HRP标记山羊抗兔IgG抗体、594荧光标记山羊抗兔购自北京中杉金桥公司;牛血清白蛋白(BSA)购自武汉Biosharp公司;小鼠TNF-α和IFN-γ试剂盒购自武汉博士德生物工程有限公司;免疫荧光固定液、免疫荧光一抗稀释液,免疫荧光二抗稀释液、抗荧光淬灭剂、DAPI核酸染料购自美国碧云天公司;类鼻疽杆菌特异的保守基因phbB-1的上游引物(5′-GCAGGCGTTCGACAAGGT-3′)、下游引物(5′-ATTGACGAGCACGTCGATCTC-3′)和探针(5′-AAGGCCGAAGTGGG-3′)由上海生工合成,0.2 mL 8-Strip PCR Tubes购自美国罗氏公司。
1.2 方法 1.2.1 感染用菌株的培养与制备复苏国内标准株BPC006,划线接种于LB平板,37 ℃、12 h,挑取单个菌落,接种于LB液体培养基中,37 ℃,220 r/min,恒温摇床培养12 h,离心(12 000 r/min)后弃上清,再以10 mmol/L的灭菌PBS洗涤2次,最后以灭菌PBS重悬菌体,测定其光密度值[D(600)]。根据D(600) 与CFU标准曲线,调整菌液浓度至3.3×106、3.3×105、3.3×104 CFU/mL。
1.2.2 攻毒剂量的探索将小鼠采用单纯随机抽样的方法分为4组,每组10只,其中实验组3组,对照组1组。提供小鼠充足的饮水和饲料,定期更换垫料。实验组小鼠(高、中、低剂量组)分别滴鼻0.01 mL洗涤后的菌液(菌液浓度分别为3.3×106、3.3×105、3.3× 104 CFU/mL,菌量则分别为3.3×104、3.3×103、3.3×102 CFU),对照组小鼠滴鼻等体积10 mmol/L的灭菌PBS[7]。每天定时观察并记录小鼠的生存状况,观察时间为42 d。根据所记录的数据,绘制小鼠感染42 d的生存曲线,并分析合适的攻毒剂量。
1.2.3 小鼠模型的建立在探索出合适的攻毒剂量后,采用单纯随机抽样的方法将小鼠分为5组,每组10只,其中实验组4组(21 d组、28 d组、35 d组和42 d组),对照组1组(PBS组)。实验组小鼠每只滴鼻0.01 mL菌液(菌液浓度为3.3×104 CFU/mL,菌量为3.3×102 CFU),对照组小鼠滴鼻等体积10 mmol/L的灭菌PBS[2]。
1.2.4 模型的评价模型主要从细菌定植、病理学检测和免疫学检测等方面进行评价,其中细菌定植为主要指标,病理学检测和免疫学检测为次要指标。本实验对感染的定义为:从血液、肝脏、脾脏和/或肺脏中分离检测到细菌。若小鼠死亡因该菌所致,也视为感染。
1.2.4.1 细菌定植检测① 涂板计数小鼠血液、肝脏、脾脏和肺脏类鼻疽杆菌定植量。小鼠感染后21、28、35、42 d分别取各组存活小鼠,同时采用单纯随机抽样的方法抽取对照组小鼠2只,在无菌条件下摘眼球取血。然后按每皿100 μL血液铺板计数细菌,剩余血液置于37 ℃水浴10 min,2 000 r/min离心20 min,取上清液置于离心管中,置-80 ℃冰箱保存备用。在无菌条件下取肺脏、脾脏和肝脏,用玻璃匀浆器磨碎后铺板计数细菌[5]。② 实时荧光定量PCR检测肝脏、脾脏和肺脏中类鼻疽杆菌量。取上一步实验中获得的肺脏、脾脏和肝脏匀浆液500 μL,8 000 r/min离心5 min,弃上清,用细菌DNA提取试剂盒提取细胞沉淀中类鼻疽杆菌的基因组,以60 μL洗脱液洗脱,以阳性标准品建立标准曲线,类鼻疽杆菌特异的保守基因phbB-1上游引物和下游引物各1 μL(10 μmol/L),探针1 μL(10 μmol/L),使用Bio-Rad CFX96 Real-Time system分析各脏器中类鼻疽杆菌的量。
1.2.4.2 病理学检测小鼠感染后21、28、35、42 d,分别取各实验组存活小鼠,同时采用单纯随机抽样的方法抽取对照组小鼠2只,在无菌条件下取小鼠肝脏、脾脏和肺脏浸泡于4%多聚甲醛溶液中。标本送西南医院病理科做石蜡切片和冰冻切片。石蜡切片进行HE染色后,于光学显微镜下观察组织的病理学变化[6-7]。冰冻切片用20%的山羊血清室温封闭2~4 h;滴加兔抗小鼠BPSS1395一抗(1 :100稀释),4 ℃孵育过夜;滴加594荧光标记山羊抗兔IgG作为二抗(1 :100稀释),37 ℃孵育1 h;滴加DAPI作为核酸染料染色20 min;滴加抗荧光淬灭剂进行封片,荧光显微镜下观察[8]。
1.2.4.3 免疫学检测① ELISA法检测类鼻疽杆菌特异性IgG抗体滴度:以类鼻疽杆菌全菌超声蛋白作为抗原包被96孔酶标板,1 μg/孔,4 ℃过夜;待检血清(21 d组、28 d组、35 d组和42 d组小鼠血清)从1 :1 000开始倍比稀释,37 ℃孵育1 h;以HRP标记的羊抗鼠IgG抗体作为二抗,37 ℃孵育1 h;底物显色剂DAB显色15~20 min;Bio-Rad model 680酶标仪检测样品光密度值[D(450)]。同时以牛血清白蛋白(BSA)作为对照组,检测IgG抗体的特异性。结果判断标准:A样品/A阴性值≥2.1为阳性,计算各组血清抗体几何平均滴度(Geometric mean titer,GMT)[9]。GMT计算公式:GMT=lg-1[(lgX1+ lgX2 +... +lgXn)/n]。② 炎性因子检测严格按照ELISA试剂盒说明书要求操作,使用Bio-Rad model 680酶标仪检测。
1.3 统计学分析采用GraphPad Prism 5.0统计软件,计数资料用百分率表示;计量资料用x±s表示,采用t检验比较组间差异,P < 0.05为差异有统计学意义。
2 结果 2.1 攻毒剂量探索不同剂量类鼻疽杆菌感染BALB/c小鼠42 d,生存曲线如图 1所示,高、中、低剂量组(剂量分别为3.3×104、3.3×103、3.3×102 CFU)和对照组小鼠生存率分别为0、0、60 %、100%。比较分析不同攻毒剂量类鼻疽杆菌感染小鼠后的感染率和死亡率时发现:低剂量组小鼠第21天时感染率高达90%,而死亡率仅10%,表明低剂量组的攻毒剂量(3.3×102 CFU)更适合用于构建类鼻疽杆菌慢性感染小鼠模型。
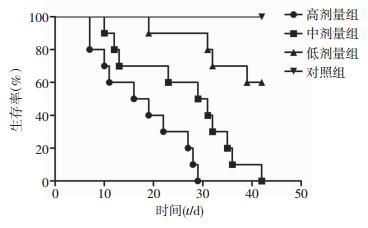
|
| 图 1 不同攻毒剂量类鼻疽杆菌感染小鼠的生存曲线 |
2.2 慢性感染模型评价 2.2.1 细菌定植情况 2.2.1.1 血液、肝脏、脾脏和肺脏的细菌定植量
低剂量(3.3×102 CFU)类鼻疽杆菌感染小鼠后21~42 d,小鼠血液、肝脏、脾脏和肺脏均有细菌定植,而对照组小鼠血液、肝脏、脾脏和肺脏中均无细菌定植。脾脏内细菌平均定植量随着时间延长逐渐增加。肺脏和肝脏的细菌平均定植量随着时间延长逐渐减少。血液中细菌平均定植量随着时间的延长无明显变化。实验组小鼠21 d组、28 d组和35 d组感染率为90%,42 d组感染率为80%(图 2)。
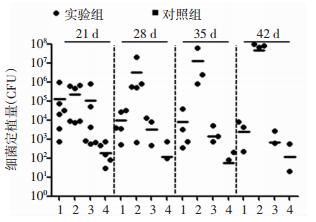
|
| 1:肝脏,2:脾脏,3:肺脏,4:血液 图 2 涂板计数类鼻疽杆菌感染后不同时间点2组小鼠各脏器和血液的细菌定植量 |
2.2.1.2 实时荧光定量PCR检测肝脏、脾脏和肺脏中类鼻疽杆菌的定植量
实时荧光定量PCR结果显示(图 3):脾脏是类鼻疽杆菌定植量最高的脏器;实验组小鼠感染21 d后,脾脏类鼻疽杆菌的定植量随着时间逐渐增高,肝脏和肺脏定植量随着时间逐渐下降;实验组脾脏和肝脏类鼻疽杆菌定植量与对照组比较,差异有统计学意义(P < 0.05),而肺脏定植量与对照组比较,差异无统计学意义(P > 0.05)。提示脾脏能够更有效地反应类鼻疽杆菌慢性感染时细菌在组织中的定植情况。

|
| a:P < 0.05, 与对照组比较 图 3 实时荧光定量PCR检测类鼻疽杆菌感染后不同时间点2组小鼠肝脏(A)、脾脏(B)和肺脏(C)中细菌定植量 |
2.2.2 病理学观察
HE染色结果显示:感染组小鼠肝脏、脾脏和肺脏均出现明显的病理学改变。随着感染时间的延长,肝脏和脾脏病理损伤更加严重,而肺脏病理损伤有所缓解。与肝脏和肺脏相比,脾脏的病理损伤最严重,正常的结构被大规模破坏,出现多灶性细胞坏死和脓肿以及特异性纤维素样结构;肝细胞体积增大出现气球样变并伴有多灶性细胞坏死,汇管区可见明显的炎性细胞分布;小鼠肺泡及间质中可见大量炎性细胞浸润,少量小鼠肺部出现小脓肿。而对照组小鼠的肺脏、脾脏和肝脏等组织中无炎性细胞浸润,组织结构正常(图 4)。
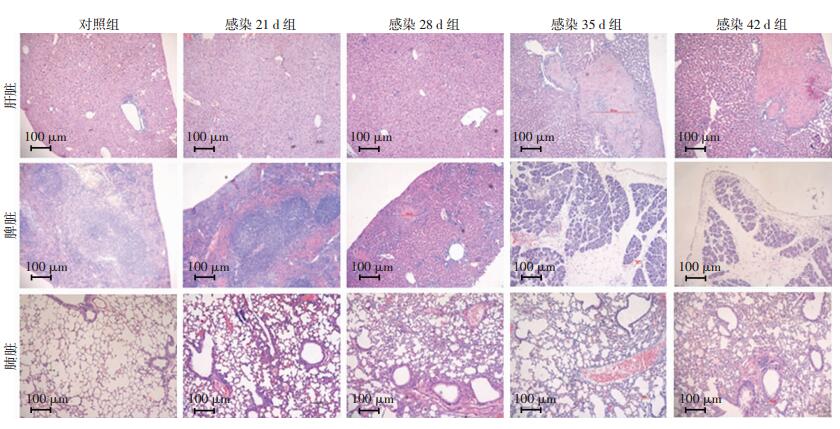
|
| 图 4 HE染色观察类鼻疽杆菌感染后不同时间点2组小鼠肝脏、脾脏和肺脏的病理改变 |
免疫荧光检测结果显示:感染42 d,实验组小鼠脾脏组织中检测到荧光标记的类鼻疽杆菌,而对照组小鼠脾脏组织中未检测到荧光标记的类鼻疽杆菌(图 5)。
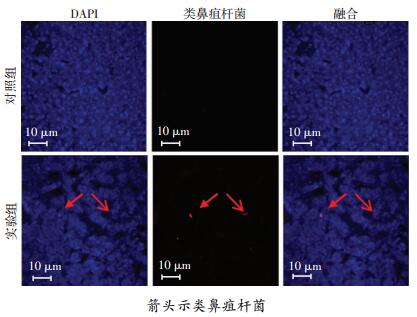
|
| 图 5 免疫荧光检测类鼻疽杆菌感染后细菌在2组小鼠脾脏的定植情况 |
2.2.3 血清学检测 2.2.3.1 ELISA法检测类鼻疽杆菌特异性IgG抗体
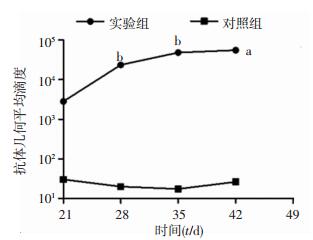
实验组小鼠感染21 d后,血清中类鼻疽杆菌特异性IgG抗体滴度持续升高,感染28 d与感染21 d比较,小鼠血清类鼻疽杆菌特异性IgG抗体几何平均滴度提高4倍以上,同时实验组与对照组组间差异具有统计学意义(P < 0.05,图 6)。
|
| a: P < 0.05, 与对照组比较;b: P < 0.05, 与21 d比较 图 6 ELISA检测类鼻疽杆菌感染后不同时间点2组小鼠血清中特异性IgG抗体几何平均滴度 |
2.2.3.2 血清细胞因子的表达
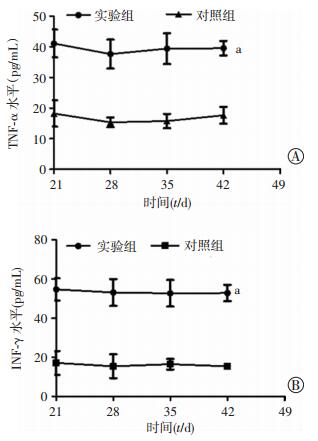
从感染21 d起,实验组小鼠血清炎性因子TNF-α和IFN-γ的表达始终处于较高水平,且与对照组比较差异具有统计学意义(P < 0.05,图 7)。
|
| a: P < 0.05, 与对照组比较 图 7 ELISA检测类鼻疽杆菌感染后不同时间点2组小鼠血清炎性因子TNF-α(A)和IFN-γ(B)的表达 |
3 讨论
类鼻疽杆菌感染人和动物后,难以被彻底清除,易发展为慢性感染和隐性感染,且其感染机制尚不清楚。为了解决这些问题,需建立一个稳定的慢性感染模型[10]。慢性感染模型的建立需要考虑菌株的毒力、感染的途径、动物的易感性以及动物的品系。由于小鼠类鼻疽病模型与临床类鼻疽病有很大的相似性,小鼠是类鼻疽病模型最常用的动物[4]。而BALB/c小鼠与C57BL/6小鼠相比,对类鼻疽杆菌更加易感,且被类鼻疽杆菌感染后病理改变更加明显[7, 11-12]。同时本研究预实验发现国内标准菌株BPC006与国外标准菌株K96247相比毒力较弱,菌株BPC006感染动物的半数致死剂量显著高于菌株K96247[2, 6]。在大量的预实验并探索了合适的攻毒剂量的基础上,本研究采用低剂量(3.3×102 CFU)的类鼻疽杆菌滴鼻感染BALB/c小鼠,建立了一种慢性类鼻疽病模型。此模型能够模拟地方性经肺部感染途径,并产生持续42 d以上的慢性感染。
本研究发现:虽然小鼠经肺部感染类鼻疽杆菌,但小鼠肺部的定植量逐渐下降。而随着细菌的定植和播散,小鼠脾脏的定植量随着时间逐渐增加并保持在较高水平。说明小鼠虽然容易经肺部感染,但脾脏才是类鼻疽杆菌在小鼠体内最主要的定植器官。据文献报道,感染组小鼠组织中类鼻疽杆菌的定植量越高,病理损伤越严重[13],这与本研究观察到的结果相一致,说明组织中类鼻疽杆菌的定植量与组织病理损伤的严重程度正相关。感染35 d后,20%的小鼠在肝脏和脾脏中能检测到类鼻疽杆菌但没有菌血症,表明类鼻疽杆菌在生物体内的传播和定植具有一定的限制性。为了更直观地观察类鼻疽杆菌在小鼠体内的传播和定植情况,本研究还采用免疫荧光的方法对实验组小鼠的肺脏、脾脏和肝脏进行观察,在小鼠脾脏中发现了标记类鼻疽杆菌的荧光信号。同时HE染色结果显示:脾脏中存在大量炎性细胞浸润和多灶性坏死,并在坏死灶周围出现特异性的纤维素样结构[5]。类鼻疽杆菌感染小鼠后的病理改变与人患类鼻疽病时相一致,表明本研究建立的类鼻疽杆菌慢性感染小鼠模型能够模拟人患类鼻疽病时的临床表现,可用于类鼻疽杆菌感染机制的研究[7]。据已有的文献报道[14],TNF-α和IFN-γ是监控类鼻疽杆菌感染的两种重要的细胞因子,实验组小鼠血清中细胞因子TNF-α和IFN-γ的表达始终高于对照组(P < 0.05),表明类鼻疽杆菌持续感染小鼠。同时类鼻疽杆菌特异性IgG抗体在小鼠血清中的持续高表达,进一步证明了小鼠处于慢性感染阶段。以上多种实验室指标提示小鼠持续感染时间超过42 d。然而在感染42 d以后仍有10%的小鼠没有表现出任何的临床症状,提示有部分小鼠可能转变为隐性感染或体内的类鼻疽杆菌被清除[13]。
由于菌株管控严格,本研究未能取得国外标准菌株,部分实验设想未能得到验证。在下一步的实验中,将争取获得国外标准菌株,增加菌株库的多样性。
综上所述,本研究成功地建立了类鼻疽杆菌慢性感染小鼠模型,并证明了模型的稳定性,为后续类鼻疽杆菌致病机制的研究和疫苗的开发奠定了基础。
| [1] |
毛旭虎. 加强类鼻疽的研究[J].
第三军医大学学报, 2011, 33(13): 1315–1317.
Mao X H. Progress on melioidosis[J]. J Third Mil Med Univ, 2011, 33(13): 1315–1317. |
| [2] | Soffler C, Bosco-Lauth A M, Aboellail T A, et al. Pathogenesis of percutaneous infection of goats with Burkholderia pseudomallei : clinical, pathologic, and immunological responses in chronic melioidosis[J]. Int J Exp Pathol, 2014, 95(2): 101–119. DOI:10.1111/iep.12068 |
| [3] | Wiersinga W J, Currie B J, Peacock S J. Melioidosis[J]. N Engl J Med, 2012, 367(11): 1035–1044. DOI:10.1056/NEJMra1204699 |
| [4] | Gauthier Y P, Hagen R M, Brochier G S, et al. Study on the pathophysiology of experimental Burkholderia pseudomallei infection in mice[J]. FEMS Immunol Med Microbiol, 2001, 30(1): 53–63. DOI:10.1016/s0928-8244(00)00234-0 |
| [5] | Leakey A K, Ulett G C, Hirst R G. BALB/c and C57Bl/6 mice infected with virulent Burkholderia pseudomallei provide contrasting animal models for the acute and chronic forms of human melioidosis[J]. Microb Pathog, 1998, 24(5): 269–275. DOI:10.1006/mpat.1997.0179 |
| [6] | Fang Y, Huang Y, Li Q, et al. First genome sequence of a Burkholderia pseudomallei Isolate in China, strain BPC006, obtained from a melioidosis patient in Hainan[J]. J Bacteriol, 2012, 194(23): 6604–6605. DOI:10.1128/JB.01577-12 |
| [7] | Tan G Y, Liu Y, Sivalingam S P, et al. Burkholderia pseudomallei aerosol infection results in differential inflammatory responses in BALB/c and C57Bl/6 mice[J]. J Med Microbiol, 2008, 57(Pt 4): 508–515. DOI:10.1099/jmm.0.47596-0 |
| [8] | Zhuang Y, Peng L S, Zhao Y L, et al. CD8(+) T cells that produce interleukin-17 regulate myeloid-derived suppressor cells and are associated with survival time of patients with gastric cancer[J]. Gastroenterology, 2012, 143(4): 951–962. DOI:10.1053/j.gastro.2012.06.010 |
| [9] |
潘金仁, 陈会红, 李寿俊, 等. A群C群脑膜炎球菌多糖结合疫苗6月龄儿童初次免疫效果[J].
中国疫苗和免疫, 2015, 21(5): 511–514.
PAN J R, Chen H H, Li S J, et al. Immunogenicity of group A and group C meningococcal conjugate vaccine after primary immunization in children aged 6 months[J]. Chin J Vaccines Immuniz, 2015, 21(5): 511–514. |
| [10] | Nandi T, Tan P. Less is more: Burkholderia pseudomallei and chronic melioidosis[J]. MBio, 2013, 4(5): e00709–e00713. DOI:10.1128/mBio.00709-13 |
| [11] | Suttisunhakul V, Wuthiekanun V, Brett P J, et al. Development of rapid enzyme-linked immunosorbent assays for detection of antibodies to Burkholderia pseudomallei[J]. J Clin Microbiol, 2016, 54(5): 1259–1268. DOI:10.1128/JCM.02856-15 |
| [12] | Champion O L, Gourlay L J, Scott A E, et al. Immunisation with proteins expressed during chronic murine melioidosis provides enhanced protection against disease[J]. Vaccine, 2016, 34(14): 1665–1671. DOI:10.1016/j.vaccine.2016.02.038 |
| [13] | Pitt T L, Trakulsomboon S, Dance D A B. Recurrent melioidosis: possible role of infection with multiple strains of Burkholderia pseudomallei[J]. J Clin Microbiol, 2006, 45(2): 680–681. DOI:10.1128/jcm.01974-06 |
| [14] | Conejero L, Patel N, de Reynal M, et al. Low-dose exposure of C57BL/6 Mice to Burkholderia pseudomallei mimics chronic human melioidosis[J]. Am J Pathol, 2011, 179(1): 270–280. DOI:10.1016/j.ajpath.2011.03.031 |



