急性应激作为应激的一部分,被认为是机体在适应环境改变中的一种方式,从多个方面影响着人类健康,也在多种疾病的发生、发展中起重要作用[1-2]。急性应激障碍(acute stress disorder, ASD)是指经历剧烈的创伤事件和强烈的精神刺激后立即或逐渐出现的分离、回避、再体验和高唤醒等症状,持续2~3 d,当症状持续超过1个月则考虑可能发展成为慢性应激性障碍,即创伤后应激障碍(posttraumatic stress disorder,PTSD)。诸多研究发现急性应激并不足以引起机体器质性改变,这是由于急性应激期机体神经、内分泌及免疫各系统的调节,在应激中属于机体自我防御修复功能极高的时期,因此急性应激后症状的普遍性和一过性特征也使ASD成为动物实验和临床研究的薄弱点。随着创伤意外事件频发,ASD发病率逐年增高,应激后心理健康状况同样是影响患者躯体创伤病理改变的重要因素,其导致的严重后果及长远影响受到更高度关注[3]。研究表明,动物在应激状态下表现出与人类相似的行为学改变,由于中枢在应激反应中的核心作用,中枢神经系统变化被认为可能是行为变化发生的基础,在急性应激后表现为诸如情绪、行为、学习记忆等一系列的改变,引起机体生理功能紊乱甚至引发严重的应激性功能障碍,因此动物行为学研究在应激反应领域的应用具有重要意义[4-5]。本研究通过建立急性应激动物模型,提供动物行为学测试方面的实验依据,为进一步寻找应激作用下行为变化的特点及其发展方向积累实验资料。
1 材料与方法 1.1 实验动物与分组实验动物为健康雄性C57小鼠,共16只,2月龄,体质量(29±2) g,通过第三军医大学实验动物福利伦理审查委员会审核,许可证号:(SYXK-PLA-20120031)。4只/笼饲养于西南医院中心实验室,实验室温度(22.0±0.5)℃,湿度50%左右,光照时间为7:00-19:00,适应性饲养7 d,自由摄食饮水,每天更换垫料。
选择活动性较好,游泳实验固定时间内游程无显著差异的16只小鼠分为实验组和对照组,每组8只。
1.2 实验器材和设备小鼠专用电击箱(22 cm×18 cm×13 cm)、旷场箱(由不透明木质材料制成,长宽高均为50 cm,无盖)、高架十字迷宫(高1 m,由横向两个闭臂和纵向两个开臂及中央区组成,每个臂长50 cm, 宽10 cm,闭合臂两侧有高40 cm的挡板,上部敞开)、Morris水迷宫(包括一个直径160 cm,高50 cm的不锈钢圆柱形水池和一个可活动的圆形玻璃平台)。
1.3 急性应激模型建立集中给予实验组小鼠一串连续多次的足底电击:电流0.8 mA,每次持续时间6 s,间隔时间15 s,重复10次;对照组小鼠不接受任何刺激,以相同条件饲养。
1.4 行为学测试 1.4.1 旷场实验分别于建模后立即(0 h)、12 h、7 d,对两组小鼠进行旷场测试,具体方法:将小鼠从旷场中央放入,用视频追踪系统记录10 min内的站立次数和中央区域活动时间、路程,用以反映小鼠的活动性、探索性以及焦虑样行为。
1.4.2 高架十字迷宫实验将小鼠从十字迷宫的中央区域放入,头朝一侧开臂,记录5 min内小鼠的行为活动,包括进入开臂的次数(OE)和时间(OT),进入闭臂的次数(CE)和时间(CT),以头部进入臂内为准,若有任一爪子或者头部退出该臂,则记录该次进入活动完成。以进入开臂闭臂的总次数(OE+CE)评价小鼠的活动性,以进入开臂次数(OE)和在开臂停留时间(OT)评价小鼠的探索样行为和焦虑状态。该实验在每次旷场实验后立即进行,时间点选取同旷场实验。
1.4.3 水迷宫实验将透明塑胶平台放于第三象限固定位置,池中放水,水面高出平台约1 cm,用无味无刺激的粉末将池水染成白色以利于视频追踪。
该实验于建模后第2天开始,分为4 d定位航行训练和1 d空间探索实验:小鼠前4 d每天游泳4次(随机从迷宫的4个象限入水点各面壁如水1次),以60 s内找到平台时间为逃避潜伏期,60 s未找到的,将其引导至平台,休息15 s后取回笼中,记潜伏期为60 s;取每天平均成绩为小鼠当天的逃避潜伏期,评价小鼠的学习能力。第5天去掉平台,每只小鼠从原平台对面象限如水,记录60 s内小鼠穿越平台次数、进入目标象限次数及目标象限的游程比例,评价小鼠的空间记忆能力。
1.5 统计学处理采用SPSS 18.0软件分析数据,结果以x±s表示,组间均数比较采用t检验,旷场、高架十字迷宫实验中不同时间点应变量及定位航行训练中的逃避潜伏期采用重复测量方差分析,并以单因素方差分析和LSD法进行两两比较。检验水准α=0.05。
2 结果 2.1 急性创伤应激降低小鼠自发行为、探索样行为实验组小鼠在应激后0、12 h的站立次数、中央区域路程、中央区域时间较对照组均显著减少(P < 0.01), 应激后7 d两组仅在中央区域时间上差异有统计学意义(P < 0.01);实验组小鼠在应激后不同时间的中央区域活动时间差异有统计学意义(F=55.790,P=0.000), 应激后即刻比应激后12 h和应激后7 d(P=0.006,P=0.000) 均显著减少,提示应激后小鼠自发行为、探索行为均发生明显改变。见图 1。

|
| A:电击后不同时间两组小鼠总路程比较;B:电击后不同时间两组小鼠中央活动路程比较;C:电击后不同时间两组小鼠站立次数比较;D:电击后不同时间两组小鼠中央活动时间比较a:P < 0.01,与对照组比较 图 1 两组小鼠旷场行为各指标比较(n=8, x±s) |
2.2 急性创伤应激降低小鼠探索行为,增加焦虑样行为
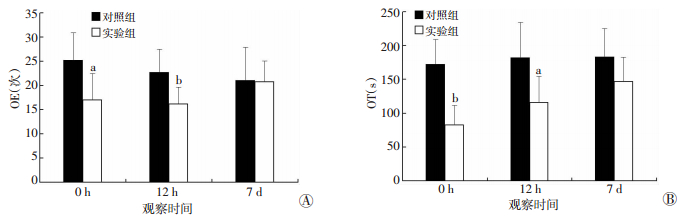
两组小鼠进入开臂闭臂总次数和总时间在应激后3个时间点比较差异均无统计学意义,结果见表 1。实验组小鼠进入开臂时间和次数在应激后立即、12 h较对照组都明显减少(P=0.000,P=0.013/P=0.012, P=0.009),如图 2所示;方差分析示,应激后进入开臂时间在3个时间点比较差异有统计学意义(F=6.697,P=0.006), 应激后立即比应激后7 d显著减少(P=0.001),提示急性创伤应激小鼠的探索行为在应激后显著减少,7 d内逐渐恢复,而焦虑样行为在应激后尤其是应激后12 h内明显增加。
| 组别 | OE+CE(次) | OT+CT(s) | |||||
| 0 h | 12 h | 7 d | 0 h | 12 h | 7 d | ||
| 对照组 | 37.00±6.50 | 36.25±7.09 | 39.13±6.98 | 266.34±27.25 | 259.25±30.33 | 272.46±23.06 | |
| 实验组 | 38.88±6.85 | 37.25±6.86 | 36.38±10.50 | 252.47±44.26 | 261.01±34.20 | 244.31±38.58 | |
| OE:进入开臂次数;CE:进入闭臂次数;OT:待在开臂时间;CT:待在闭臂时间 | |||||||
|
| A:两组小鼠不同时间进入开臂次数比较;B:两组小鼠不同时间待在开臂时间比较OE:小鼠进入开臂次数;OT:小鼠待在开臂时间a:P < 0.05,b:P < 0.01, 与对照组比较 图 2 两组小鼠不同时间进入开臂次数和时间比较(n=8, x±s) |
2.3 急性创伤应激降低小鼠学习能力,增强空间记忆能力
定位航行训练中,两组小鼠逃避潜伏期均显著下降(P < 0.01);应激后不同时间实验组小鼠的逃避潜伏期差异有统计学意义(F=5.67,P=0.03),两两比较后得出,实验组小鼠在第2天和第3天的逃避潜伏期较对照组显著延长(P=0.023,P=0.029,图 3),提示急性应激可能降低小鼠的空间学习能力。

|
| a:P < 0.05,与对照组比较 图 3 急性应激后两组小鼠逃避潜伏期变化(n=8, x±s) |
空间探索实验中,实验组小鼠穿越原平台次数和在平台象限的游程比例较对照组都显著增多,进入目标象限的时间也增多,但差异无统计学意义,见表 2,说明急性应激可能在一定程度上增强小鼠的空间记忆能力以及对空间定位的精准性。
| 组别 | 穿越原平台(次) | 目标象限时间(s) | 目标象限游程比率(%) |
| 对照组 | 2.38±1.06 | 28.84±7.36 | 46.81±6.50 |
| 实验组 | 4.50±1.20 | 38.93±5.00 | 53.92±3.84 |
| t | -3.761 | -1.910 | -2.664 |
| P | 0.002 | 0.077 | 0.019 |
3 讨论
急性应激障碍首次在《精神疾病诊断与统计手册》第4版(Diagnostic and Statistical Manual for Mental Disorders, DSM-Ⅳ)中被提出,主要目的是为了预测可能发生的PTSD[6]。近年来随着交通事故、意外创伤事件频发,精神运动性障碍对环境、社会和心理造成的重大影响,ASD无论是作为独立的创伤后应激障碍性疾病还是为了辅助预测慢性应激障碍的发生,都受到越来越多的关注。研究表明,适度应激激发动物在抵抗力和防御力方面的潜能,急性应激被认为是从应激到疾病的适应性过渡阶段[4],当应激强度、持续时间或(和)症状发展超过机体防御能力后,出现神经、内分泌和免疫功能紊乱,在环境及社会因素共同作用下,机体表现出单方面或多方面病理特征。目前动物研究被广泛应用于急性应激致焦虑、认知功能、学习记忆改变中,但利用旷场实验、高架十字迷宫实验同时叠加水迷宫实验以综合评价急性创伤应激后行为学改变的研究却报道不多。
急性应激动物模型根据应激源种类分类众多,例如足底电击、悬尾刺激、强迫游泳、恐惧环境刺激、肢体离断等;根据应激源数量可分为单一应激和复合应激;根据应激类型分为躯体应激和心理应激。电击模型作为经典急性应激模型,被广泛应用于动物实验中;目前急性应激电击模型制作没有统一标准,一般电击强度在0.2 mA以上即可引起动物僵直、毛发竖立、惊恐等表现。大部分急性应激实验都选择将动物放在不可逃避的应激环境中[7],随着实验不断改进,科学家们提出单一的较强电击或者少量次数弱电击的集中应激优于长时程的电击训练,因为重复多次暴露于刺激环境中会造成动物行为敏化,即对刺激形成适应,而这种敏化与刺激强度和测试环境有最密切的关系[8],因此本研究选择一串多次集中的足底电击建立急性应激动物模型。
实验员在3个时间点均对小鼠四肢情况进行观察,未出现颤抖无力等症状,且两组小鼠旷场活动总路程在3个时间比较差异均无统计学意义,说明应激小鼠的站立次数和中央区域活动减少并非由电击致四肢疼痛造成。旷场测试中动物行为增多或减少都反映其环境适应能力以及害怕、焦虑或情绪异常状态,因此用旷场可有效测试动物自发行为和焦虑水平[9];高架十字迷宫实验,是测试应激后回避症状的有效实验方法,通过同时唤起动物的探索性和恐惧心理,测试动物为回避这些复杂心理而产生焦虑的程度[10]。Hawley等[11]提出多次行为检测对于动物而言属于情景回顾,对结果存在一定影响,文中指出应激后3 d和7 d若没有对大鼠进行情景回顾,则电击组和对照组的焦虑探索行为差异无统计学意义。本实验过程及结果与其相似,我们选择3个时间点检测小鼠的焦虑探索行为,在12 h和7 d电击组小鼠的焦虑探索行为改变仍然明显,说明重复实验对创伤应激后小鼠属于再体验过程,小鼠在遭遇电击后立马被放入旷场和高架中,它们认为旷场和高架是与电击连续出现的恐惧环境,因此后两个时间点即使没有电击,也会对旷场和高架存在高唤醒状态。最近一项环境因素对急性应激影响的研究中发现[12],焦虑样行为在应激后1 h被立即触发,与此类似。本研究中小鼠焦虑和探索行为改变在电击后即刻发生,应激小鼠进入开臂次数随时间逐渐增多,反映探索行为随时间平稳恢复;正常小鼠对旷场中央区域和高架十字迷宫的开臂有更强的探究欲望,而应激后小鼠对空旷陌生环境恐惧回避,更愿待在安全的闭臂或角落。我们发现应激后小鼠自发、探索行为在7 d内基本恢复,焦虑状态持续时间长,7 d后仍然明显。有学者在最近一项关于创伤后应激障碍的研究中[13]发现,在电击7 d后的旷场实验中,电击组小鼠只在前5 min内表现出活动力显著降低,5 min之后与对照组比差异无统计学意义,说明即使电击方法一致,实验中其他处理步骤也会对动物焦虑状态的改变存在影响。旷场实验和高架十字迷宫实验在测试行为改变的作用中侧重点不一,但将二者结合以评价动物的焦虑状态、探索行为,具有相互验证、加强结果说服力的创新作用。本研究中旷场实验和高架十字迷宫实验结果均表明,急性应激导致小鼠探索行为减少、焦虑状态增加,在应激后立即发生;小鼠探索行为损伤后,自我修复能力较强,但焦虑状态持续时间较长,适当给予干预是有效预防长期焦虑甚至慢性行为改变的正确方法。
当动物经历一定强度刺激后,机体防御功能不能正常发挥作用,发展成急性应激障碍,表现出对创伤相关恐惧的过度反应和与创伤无关刺激的敏感反应,即高唤醒和回避,这其中包含了记忆的处理过程紊乱和学习能力的改变,协同焦虑认知等影响,固化应激对机体的负性作用。目前关于急性应激致学习记忆改变的机制探索已有大量研究,但重点集中在神经系统方面,海马是中枢与学习记忆密切相关的结构,主要参与短时程记忆向长时程记忆和空间记忆的转换,同时,也参与条件惊恐反应等情景学习过程[14]。海马内多种信号分子已被发现可能参与急性应激对动物学习和记忆功能的改变[15]。例如环磷酸腺苷反应元件结合蛋白(CREB)、脑源性神经营养因子(BDNF)、神经颗粒素(NG)、糖原合成酶激酶3(GSK-3β)等,当应激发生时,信号分子在海马内表达发生改变,导致多条信号转导通路在神经细胞的增殖、再生和成熟凋亡中发生生物学功能转变,与此同时下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal, HPA)轴功能紊乱,神经递质释放异常,海马受到高浓度糖皮质激素影响,介导下游信号分子以及与学习记忆密切相关的受体表达障碍,导致神经突触可塑性改变,是学习记忆的分子基础[16]。Morris水迷宫实验本身是一种典型的海马依赖性行为训练模型,用于评价动物空间学习记忆能力[17]。本研究发现,急性应激后小鼠学习能力只在第2、3天明显下降,第4天两组差异无统计学意义,说明创伤后前3 d小鼠的学习能力较差,对新事物领悟力较弱,但两组小鼠逃避潜伏期都有随时间下降的趋势。Wittner等[18]以低压低氧环境为应激源,制作的大鼠急性应激模型,同样用水迷宫实验评估学习和空间记忆,低压缺氧组在导航训练中成绩优于对照组(P=0.003 3), 第4天差异有统计学意义(P=0.001 8),说明应激后动物学习能力增强,且在应激后几天表现更明显,因此我们假设随着时间变化,实验组可能表现出比对照组更强的学习能力;孙伊思[19]在关于急性应激期学习敏感化的研究中就提出,经过电击的小鼠在学习获得阶段与正常小鼠差异无统计学意义,但学习保持的潜伏期要长于正常小鼠,即小鼠学习能力在恐惧环境中随时间变化,在应激后期,学习能力不断加强;目前也有关于水迷宫测试时间差异的多种研究[20],但结果不一。在本研究今后的实验中可以增加小鼠定位航行训练天数,以进一步比较和验证应激导致的学习能力差异。
通过定位航行训练,应激小鼠在空间记忆测试中能准确找到目标,目标象限游程比例和找到目标位置次数显著多于正常小鼠,但两组进入目标象限次数差异无统计学意义,说明急性应激反而在一定程度上增强和激发了小鼠的空间记忆力和准确定位能力。这一结果与国内外许多学者关于啮齿类动物在空间记忆方面的研究结果一致。一项关于急性应激与青春期大鼠空间记忆关系的研究中[21],研究者得出不管是0.2 mA电击还是1.6 mA电击,电击大鼠在水迷宫测试中都表现出比对照组更强的学习能力,他们检测了海马CA1区和齿状回中血管内皮生长因子和脑源性神经营养因子,应激组均明显升高。肖婧姗等[22]以36 V电压,持续30 s, 间隔15 s,共30次的单一足底电击作急性应激模型,对小鼠进行水迷宫测试,结果电击小鼠的空间学习和记忆能力均增强。然而本研究发现的这种学习能力减退但记忆能力增强的矛盾现象可能与电击的强度和频率以及任务的评估时间等有关。Cazakoff[23]就提出急性应激对学习记忆的影响取决于有许多参数相关的应激源、给予应激的时间、评估任务的性质以及检查时间等。
多数研究证明ASD无论在对生活睡眠质量、临床治疗的影响中,还是在对慢性应激障碍的预测[24-26]中都具有重要意义。本实验结果进一步证实急性应激导致小鼠在行为学方面的多种改变,主要包括自发、探索行为减少,恐惧、焦虑状态增加以及学习和空间记忆能力改变等特征性行为变化,均在小鼠应激后立即发生,焦虑状态持续时间较长且恢复缓慢;恐惧心理随时间缓解,在应激12 h后恢复较快,但极易被新环境或者有威胁的因素唤醒,回到被应激时状态,这为临床发现并干预ASD某些特征性症状提供了依据和支持。应激是维持机体内环境稳态的重要生物学过程,掌握急性应激后的行为学变化特点,有效控制可能影响机体行为改变的因素,从环境和社会心理角度进行干预,力求将症状控制在机体可防御范围内,对临床创伤后应激障碍的干预无疑有着重要的指导意义。
由于本研究设计的局限性,仅对急性应激后小鼠的行为表现作了检测,尚未涉及导致这种改变可能的组织特点和病理基础研究,在后续实验中拟将急性应激后小鼠的海马结构改变纳入观察比较。
| [1] | Kassi E, Pervanidou P, Kaltsas G, et al. Metabolic syndrome: definitions and controversies[J]. BMC Med, 2011, 9: 48. DOI:10.1186/1741-7015-9-48 |
| [2] | McEwen B S. Central effects of stress hormones in health and disease: Understanding the protective and damaging effects of stress and stress mediators[J]. Eur J Pharmacol, 2008, 583(2/3): 174–185. DOI:10.1016/j.ejphar.2007.11.071 |
| [3] |
杜建政, 夏冰丽. 急性应激障碍(ASD)研究述评[J].
心理科学进展, 2009, 17(3): 482–488.
Du J Z, Xia B L. A review of study on acute stress disorder[J]. Advances in Psychological Science, 2009, 17(3): 482–488. |
| [4] | Wilson M A, Grillo C A, Fadel J R, et al. Stress as a one-armed bandit: Differential effects of stress paradigms on the morphology, neurochemistry and behavior in the rodent amygdala[J]. Neurobiol Stress, 2015, 1: 195–208. DOI:10.1016/j.ynstr.2015.06.001 |
| [5] |
李欢欢, 林文娟, 李俊发. 急性生理应激对大鼠的行为及脑神经颗粒素磷酸化水平的影响[J].
心理学报, 2007, 39(4): 648–655.
Li H H, Lin W J, Li J F. The effects of an acute physiological stressor on behaviors, protein levels and phosphorylation of neurogranin in rats[J]. Acta Psychologica Sinica, 2007, 39(4): 648–655. |
| [6] |
王倩, 郑晓星, 杨蕴萍. 急性应激障碍能否预测创伤后应激障碍[J].
首都医科大学学报, 2008, 29(5): 564–568.
Wang Q, Zheng X X, Yang Y P. Can acute stress disorder predict posttraumatic stress disorder[J]. Journal of Capital Medical University, 2008, 29(5): 564–568. DOI:10.3969/j.issn.1006-7795.2008.05.006 |
| [7] | Kingsbury T J, Krueger B K. Ca2+, CREB and krüppel: a novel KLF7-binding element conserved in mouse and human TRKB promoters is required for CREB-dependent transcription[J]. Mol Cell Neurosci, 2007, 35(3): 447–455. DOI:10.1016/j.mcn.2007.04.004 |
| [8] | Stam R. PTSD and stress sensitisation: A tale of brain and body.Part 2: Animal models[J]. Neurosci Biobehav Rev, 2007, 31(4): 558–584. DOI:10.1016/j.neubiorev.2007.01.001 |
| [9] | Ekdahl C T, Kokaia Z, Lindvall O. Brain inflammation and adult neurogenesis: the dual role of microglia[J]. Neuroscience, 2009, 158(3): 1021–1029. DOI:10.1016/j.neuroscience.2008.06.052 |
| [10] | Deng W, Aimone J B, Gage F H. New neurons and new memories: how does adult hippocampal neurogenesis affect learning and memory?[J]. Nat Rev Neurosci, 2010, 11(5): 339–350. DOI:10.1038/nrn2822 |
| [11] | Hawley W, Grissom E, Keskitalo L, et al. Sexual motivation and anxiety-like behaviors of male rats after exposure to a trauma followed by situational reminders[J]. Physiol Behav, 2011, 102(2): 181–187. DOI:10.1016/j.physbeh.2010.10.021 |
| [12] | Novaes L S, Dos Santos N B, Batalhote R F, et al. Environmental enrichment protects against stress-induced anxiety: Role of glucocorticoid receptor, ERK, and CREB signaling in the basolateral amygdala[J]. Neuropharmacology, 2017, 113(Pt A): 457–466. DOI:10.1016/j.neuropharm.2016.10.026 |
| [13] | Ronzoni G, Del Arco A, Mora F, et al. Enhanced noradrenergic activity in the amygdala contributes to hyperarousal in an animal model of PTSD[J]. Psychoneuroendocrinology, 2016, 70: 1–9. DOI:10.1016/j.psyneuen.2016.04.018 |
| [14] | Haghparast A, Fatahi Z, Alamdary S Z, et al. Changes in the levels of p-ERK, p-CREB, and c-fos in rat mesocorticolimbic dopaminergic system after morphine-induced conditioned place preference: the role of acute and subchronic stress[J]. Cell Mol Neurobiol, 2014, 34(2): 277–288. DOI:10.1007/s10571-013-0011-z |
| [15] | Vila-Verde C, Marinho A L, Lisboa S F, et al. Nitric oxide in the prelimbic medial prefrontal cortex is involved in the anxiogenic-like effect induced by acute restraint stress in rats[J]. Neuroscience, 2016, 320: 30–42. DOI:10.1016/j.neuroscience.2016.01.040 |
| [16] | Clark R E, Broadbent N J, Squire L R. The hippocampus and spatial memory: findings with a novel modification of the water maze[J]. J Neurosci, 2007, 27(25): 6647–6654. DOI:10.1523/JNEUROSCI.0913-07.2007 |
| [17] | Morris R. Developments of a water-maze procedure for studying spatial learning in the rat[J]. J Neurosci Methods, 1984, 11(1): 47–60. DOI:10.1016/0165-0270(84)90007-4 |
| [18] | Wittner M, Ríha P. Transient hypobaric hypoxia improves spatial orientation in young rats[J]. Physiol Res, 2005, 54(3): 335–340. |
| [19] |
孙伊思. 急性应激期大鼠学习敏感化的改变及其对PTSD样症状形成的预测作用[D]. 长沙: 湖南师范大学, 2012. DOI: 10.7666/d.y2148260.Sun
Y S.The changes in learning sensitive of acute stress in rats and predict the symptoms of PTSD[D].Chang Sha:Hunan Normal University, 2012.DOI: 10.7666/d.y2148260. |
| [20] | McFadden L M, Paris J J, Mitzelfelt M S, et al. Sex-dependent effects of chronic unpredictable stress in the water maze[J]. Physiol Behav, 2011, 102(3/4): 266–275. DOI:10.1016/j.physbeh.2010.10.022 |
| [21] | Uysal N, Sisman A R, Dayi A, et al. Acute footshock-stress increases spatial learning memory and correlates to increased hippocampal BDNF and VEGF and cell numbers in adolescent male and female rats[J]. Neurosci Lett, 2012, 514(2): 141–146. DOI:10.1016/j.neulet.2012.02.049. |
| [22] |
肖婧姗, 李洋, 李娜, 等. BDNF在急性应激所致小鼠空间学习记忆功能改变中的作用[J].
科技视界, 2016(1): 56–57.
Xiao J S, Li Y, Li N, et al. Role of BDNF in the Spatial Learning-memory Function of Mice Induced by Acute Stress[J]. Science & Technology Vision, 2016(1): 56–57. DOI:10.3969/j.issn.2095-2457.2016.01.044 |
| [23] | Cazakoff B N, Johnson K J, Howland J G. Converging effects of acute stress on spatial and recognition memory in rodents: a review of recent behavioural and pharmacological findings[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2010, 34(5): 733–741. DOI:10.1016/j.pnpbp.2010.04.002 |
| [24] | Philbert J, Pichat P, Beesk S, et al. Acute inescapable stress exposure induces long-term sleep disturbances and avoidance behavior: a mouse model of post-traumatic stress disorder (PTSD)[J]. Behav Brain Res, 2011, 221(1): 149–154. DOI:10.1016/j.bbr.2011.02.039 |
| [25] | Sijbrandij M, Kleiboer A, Bisson J I, et al. Corrections.Pharmacological prevention of post-traumatic stress disorder and acute stress disorder: a systematic review and meta-analysis[J]. Lancet Psychiatry, 2015, 2(7): 584. DOI:10.1016/S2215-0366(15)00280-1 |
| [26] | Hansen M, Armour C, Wittmann L, et al. Is there a common pathway to developing ASD and PTSD symptoms?[J]. J Anxiety Disord, 2014, 28(8): 865–872. DOI:10.1016/j.janxdis.2014.09.019 |



