2. 西南医院血液科;
3. 西南医院整形美容科
2. Department of Hematology;
3. Department of Plastic and Aesthetic Surgery, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
造血障碍所致疾病(白血病、骨髓及髓外肿瘤、淋巴瘤、淋巴组织增生疾病等)严重威胁着人类健康[1-2]。过去的30年中,造血障碍相关疾病的发生率显著提高且趋于低龄化[3]。目前对其发病机制和治疗的研究主要聚焦在免疫系统,代表性成果是CD20单克隆抗体美罗华的研发和使用[3]。但除了免疫系统外,细胞内胆固醇代谢与造血障碍相关疾病的关联也屡见报道。近年来,有研究显示造血干细胞(hematopoietic stem cells, HSCs)和造血祖细胞(hematopoietic progenitor cells, HPCs)的稳态平衡与白血病和骨髓增生性肿瘤相关,而细胞内胆固醇的流出对HSCs和HPCs稳态维持起着重要作用,三磷酸腺苷结合蛋白ABCA1和ABCG1通过把HSCs和HPCs内胆固醇转运至高密度脂蛋白(HDL)而将其运出细胞,当ABCA1和ABCG1缺失时,上述胆固醇转运途径发生障碍,将使得造血祖细胞恢复造血功能,同时出现髓外造血[1]。此外,巨核细胞祖细胞(megakaryocyte progenitor cells,MPCs)内胆固醇外流障碍将引发血小板增多综合征,与ABCG1高度同源的三磷酸腺苷结合转运蛋白ABCG4在巨核细胞祖细胞中的缺失将使得胞内胆固醇转运至HDL障碍,进而引发细胞膜促血小板生成素受体表达增多,最终引发疾病[4]。在动脉粥样硬化的小鼠在体模型中载脂蛋白E(apolipoprotein E, ApoE)通过影响ABCA1和ABCG1的功能而调节细胞内胆固醇流出进而调控HSCs增殖,且与单核细胞增多相关[5]。但上述工作对细胞内胆固醇流出机制的研究主要局限于对Abca1、Abcg1、Abcg4和Apoe基因的探讨[1, 4-5]。然而,除了上述几种基因与胆固醇代谢相关外,NPC1和NPC2也扮演了重要角色。其中,NPC1基因是从尼曼匹克病(Niemann-Pick disease type C)中发现的,其编码蛋白是由1 278个氨基酸残基组成的膜蛋白,其氨基末端包含结合胆固醇的结构域,主要分布在晚期内含体(late endosome, LE)和溶酶体(lysosome, Ly)[6]。NPC1和可溶性胆固醇结合蛋白NPC2共同作用,将细胞摄取及合成的胆固醇从LE/Ly转运到内质网、胞浆膜和其他细胞器膜[7],是调控胆固醇流动的关键基因[7-9]。位于细胞膜的胆固醇是膜脂质筏(lipid raft)的重要成分。一些重要膜受体如c-kit、LRP6等主要分布在脂质筏,通过介导配体诱导的配体-受体复合物内陷(endocytosis)调节信号转导[10-11]。而c-kit是HSCs表面标志物,也是造血干细胞因子(stem cell factor,SCF)的受体,是调控HSCs增殖分化的主要信号分子,c-kit磷酸化是信号转导的始动环节。因此,细胞膜上胆固醇的改变可能会影响c-kit的功能。由此推测,NPC1、NPC2基因可能通过调控细胞内胆固醇代谢来影响c-kit的磷酸化进而调控HSCs的增殖分化。
重组慢病毒感染造血前体细胞(erythroid myeloid lymphoid,EML)是利用携带功能缺失维甲酸受体的逆转录病毒感染小鼠骨髓细胞分离获得的[12]。在没有支持细胞的条件下,EML细胞能够在含有SCF的培养基中通过自我更新和分化形成包含不同分化阶段、不同谱系的杂合细胞群[12-15]。EML细胞能够稳定表达CD34、sca-1、c-kit等HSCs表面标志物,是研究HSCs增殖分化等相关机制的公认有效模型[14-15]。同时,lineage- sca-1+ c-kit+(LSK)亚群具有造血重建能力,确定为造血干细胞表面标志[7-10]。在EML细胞中含约40%的LSK细胞,因此,这群细胞可作为研究小鼠HSCs的细胞模型。
本研究通过NPC1、NPC2基因shRNA重组慢病毒感染EML细胞获得NPC1、NPC2基因敲低的EML细胞,进而探究细胞内胆固醇转运相关基因NPC1、NPC2对EML细胞增殖、分化的调节作用。为造血干细胞稳态维持的研究提供理论依据,同时也为血液系统疾病的治疗和研究提供新思路。
1 材料与方法 1.1 材料细胞培养试剂:IMDM培养基、DMEM高糖培养基(美国HyClone公司)、胎牛血清(美国Gibico公司)、干细胞生长因子SCF(美国PeproTech公司)。
抗体:actin、GAPDH、Erk鼠多克隆抗体;NPC1、NPC2、p-c-kit、c-kit、p-Akt、Akt、p-Erk等抗体(美国cell signaling technology公司);CD34-FITC、lineage-APC、c-kit-APC、sca-1-PE、CD11b-FITC、B220-PE、TER-119-APC等流式抗体(美国eBioscience公司)。
qPCR试剂:RNA提取试剂盒、RT-PCR试剂盒、SYBR Premix Ex Taq Ⅱ(日本TaKaRa公司)、引物合成与测序(华大基因)。
其他:Filipin染料(美国Sigma公司)、CCK-8试剂盒(碧云天公司)、嘌呤霉素(日本鼎国公司)、青-链-新复合抗生素(美国Life公司)、PVDF膜(美国Bio-Rad公司)。
细胞:EML细胞、BHK细胞、293FT细胞由本实验室提供。
1.2 方法 1.2.1 细胞培养EML细胞培养于含70% IMDM、20% BHK、10% FBS、12 ng/mL SCF及1%青-链-新复合抗生素的培养基中。BHK细胞和293FT细胞均培养于含90% DMEM、10% FBS和1%青-链-新复合抗生素的培养基中。
1.2.2 流式细胞仪检测收集细胞于1.5 mL EP管中,1 000 r/min室温离心5 min后弃上清;加入流式Buffer 1(PBS+2% FBS)洗涤1次后1 000 r/min、4 ℃离心5 min,弃上清;加入流式Buffer 2(Buffer 1+0.1%大鼠血清)重悬,冰上孵育10 min;加入经滴定后的流式抗体,冰上孵育20 min;之后离心弃上清并用Buffer 1洗1遍,于4 ℃、1 000 r/min离心5 min,弃上清;最后,用Buffer 1重悬上机。
1.2.3 流式细胞仪分选采用文献[14]的方法,根据对照先圈出sca-1阳性细胞,再将其均分为3份,依次为sca-1-high、sca-1-inter、sca-1-low,EML细胞经滴定的sca-1抗体染色后即按上面的方法设门进行分选,最后将各亚群细胞收集于培养液中进行后续实验。
1.2.4 qPCR分析提取细胞RNA,测定浓度后按试剂盒说明书反转为cDNA作为模板,以GAPDH为内参于qPCR仪检测目的基因在mRNA水平的表达。目的基因引物序列见表 1。
| 基因 | 引物序列(5′→ 3′) | 产物长度(bp) | |
| NPC1 | 上游 | ATTTACCTCTGCTGGATTCTTCTC | 223 |
| 下游 | GGAACATACTGACCATCTTTATCG | ||
| NPC2 | 上游 | CAGTGAGTGGTTTAGCATCAG | 176 |
| 下游 | CCTTTGAAAGTTGTGGAACAG | ||
| GAPDH | 上游 | CGTGGGAGCAGGTTTCGT | 325 |
| 下游 | ACGGCCGCTTTAGTGTTGTC |
1.2.5 Western blot检测
提取细胞蛋白后测定浓度并计算出上样量,按照上样量将样品加入制备好的凝胶中。上样结束后于80 V电压下电泳,30 min后将电压调至100 V继续电泳。1 h后取出凝胶与PVDF膜叠加后于转膜仪进行转膜。2 h后取出PVDF膜于5%脱脂奶粉溶液中封闭,1 h后用TBST清洗3次,清洗完毕孵育一抗于4 ℃过夜。取出膜用TBST清洗3次,孵育二抗,室温,1 h。
1.2.6 慢病毒载体的构建设计并合成NPC1和NPC2基因的shRNA。将上述序列克隆至慢病毒载体pLKO.1的AgeⅠ和EcoRⅠ位点间,构建重组慢病毒载体pLKO.1-NPC1 shRNA和pLKO.1-NPC2 shRNA,并转化至感受态细菌。挑取阳性克隆提质粒后测序鉴定其正确性。
1.2.7 重组慢病毒NPC1和NPC2 shRNA的包装293FT细胞以3×105/孔铺6孔板,24 h后待其生长融合度达60%~70%时采用氯化钙法进行转染。8h后更换培养基,继续培养。48 h后收集上清于0.45 μm滤器过滤后分装至1.5 mL EP管中(1 mL/管),于-80 ℃保存备用。
1.2.8 pLKO.1-NPC1 shRNA和pLKO.1-NPC2 shRNA慢病毒感染EML细胞病毒液以1:2(病毒液和培养液体积比)感染接种于24孔板的EML细胞,以未经病毒感染的EML细胞作对照,24 h后转入6孔板内培养并补足培养基至总体积为2 mL/孔,48h后用含有2 μg/mL嘌呤霉素的培养基筛选。待对照EML细胞全部死亡时收集经慢病毒感染后存活的EML细胞,并将其培养于含有1 μg/mL嘌呤霉素的培养基。
1.2.9 Filipin染色首先取1×103细胞于甩片机涂片,之后用4%多聚甲醛固定30 min,PBS浸洗3次,5 min/次。接着用50 μg/mL Filipin室温孵育,此时注意避光。1 h后滴加DAPI复染细胞核,避光孵育5 min后用PBST洗涤3次,5 min/次。用抗荧光猝灭剂的封片液封片。于荧光显微镜下观察染色情况后上激光共聚焦显微镜采集图像。
1.2.10 CCK-8检测细胞增殖取细胞接种于96孔板,每孔150 μL培养液中接种3×103个细胞。接种后1、2、3 d每孔中加入100 μL CCK-8,培养3 h后于酶标仪检测光密度值[D(450)]。以D(450) 值为纵坐标,培养时间为横坐标,绘制细胞增殖曲线。
1.2.11 台盼蓝染色检测细胞增殖取细胞接种于24孔板,每孔2 mL培养基中接种2.25×105个细胞。并于接种后1、2、3 d用台盼蓝染色计数。最终以细胞数为纵坐标,培养时间为横坐标绘制细胞增殖曲线。
1.2.12 c-kit磷酸化实验按1.5×105/mL将各细胞培养于含0.5% BSA但不含血清和SCF的IMDM培养基中,每种细胞设置对照组和SCF刺激组,2h后在SCF刺激组中加入SCF(50 ng/mL),5 min后收集细胞提取全蛋白并测定浓度,Western blot检测c-kit磷酸化的改变。
1.3 统计学分析采用SPSS 18.0统计软件,采用单因素方差分析比较多组间数据的差异,两组独立样本t检验比较两组间数据的差异,数据用x±s表示,P < 0.05为差异有统计学意义。
2 结果 2.1 EML细胞lineage、c-kit、sca-1细胞表面标志物的表达流式细胞仪检测结果显示:EML细胞能够稳定表达HSCs表面标志物c-kit和sca-1,其中c-kit阳性率为99.2%,sca-1阳性率为66.5%;在EML细胞中lineage阳性细胞占25.4%(图 1)。由于LSK是HSCs的重要标志,而EML细胞中含约40%的LSK细胞;因此,这群细胞可作为研究小鼠HSCs的细胞模型。
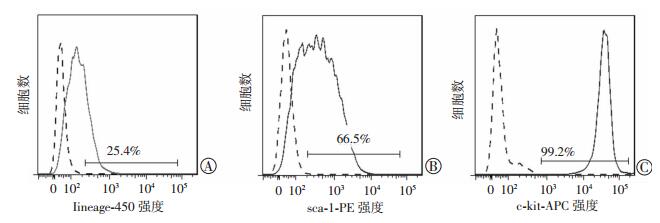
|
| 图 1 流式细胞仪检测EML细胞HSCs表面标志物lineage、sca-1、c-kit表达 |
2.2 EML细胞sca-1-high、sca-1-inter、sca-1-low各亚群中NPC1、NPC2的表达
根据sca-1表达高低采用流式细胞仪分选将EML细胞分为sca-1-high、sca-1-inter、sca-1-low 3个细胞亚群(图 2A、B);提取各群细胞RNA后,采用Real-time PCR检测NPC1、NPC2的表达。结果显示:在sca-1-low/EML亚细胞群中NPC1和NPC2基因的表达均降低(P < 0.01,图 2C、D),提示NPC1和NPC2与sca-1呈正相关。
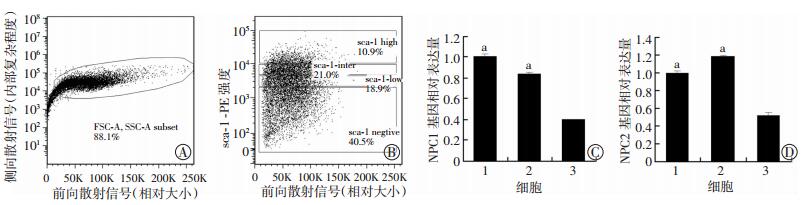
|
| A:流式细胞仪SSC通道排除死细胞和细胞碎片;B:流式细胞仪PE通道分选EML细胞sca-1-high、sca-1-inter、sca-1-low亚细胞群;C、D:qPCR检测EML细胞sca-1-high、sca-1-inter、sca-1-low亚细胞群基因NPC1、NPC2的表达 1:EML/sca-1-high;2:EML/sca-1-inter;3:EML/sca-1-low; a:P < 0.01,与EML/sca-1-low比较 图 2 EML细胞sca-1-high、sca-1-inter、sca-1-low亚细胞群的分选及其NPC1、NPC2基因的表达 |
2.3 NPC1 shRNA和NPC2 shRNA能有效沉默EML细胞NPC1和NPC2基因的表达
qPCR结果表明:与对照比较,慢病毒NPC1 shRNA和NPC2 shRNA感染的EML细胞NPC1、NPC2基因的表达明显下调(P < 0.01,图 3A)。Western blot检测结果显示:与对照比较,慢病毒NPC1 shRNA和NPC2 shRNA感染的EML细胞NPC1和NPC2蛋白表达也相应降低(P < 0.01,图 3B、C)。Filipin染色结果表明:在对照慢病毒GFP shRNA感染的EML细胞中未见胆固醇蓄积(图 4A),但是在慢病毒NPC1 shRNA和NPC2 shRNA感染的EML细胞中观察到胆固醇蓄积(图 4B、C),且在NPC1shRNA慢病毒感染的EML细胞中胆固醇蓄积显著(图 4B),表明成功构建了NPC1、NPC2敲低的EML细胞模型。

|
| A:qPCR检测各细胞NPC1和NPC2基因的表达 a:P < 0.01, 与EML/GFP shRNA比较;B:Western blot检测各细胞NPC1和NPC2基因编码蛋白的表达 1:EML;2:EML/GFP shRNA;3:EML/NPC1 shRNA;4:EML/NPC2 shRNA;C:半定量分析(n=3) a:P < 0.01,与EML、EML/GFP shRNA比较 图 3 NPC1和NPC2基因沉默的EML细胞验证 |
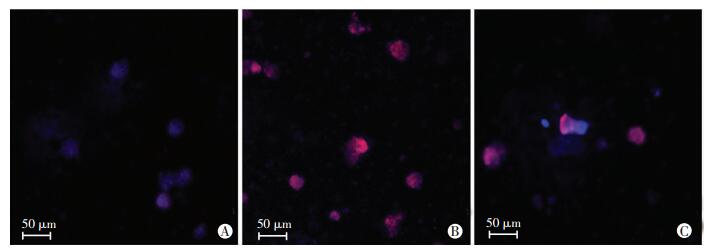
|
| A:对照EML细胞;B:NPC1敲低EML细胞;C:NPC2敲低EML细胞 图 4 Filipin染色检测各细胞内胆固醇蓄积 |
2.4 沉默NPC1、NPC2对EML细胞增殖和干性标志物表达的影响
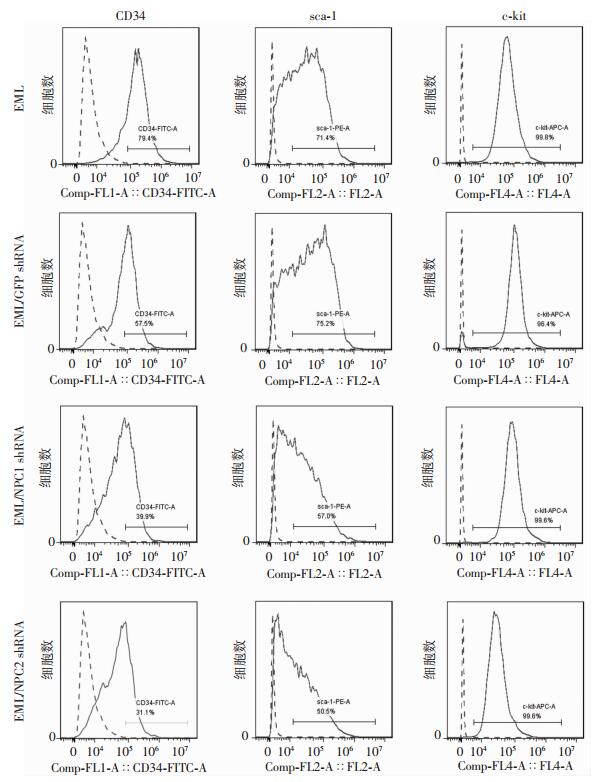
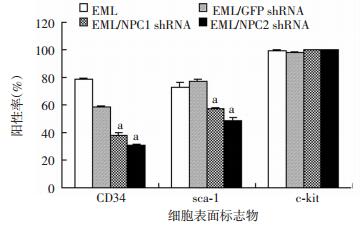
CCK-8检测和台盼蓝染色结果表明:经慢病毒NPC1 shRNA和NPC2 shRNA感染的EML细胞生长明显慢于经对照病毒感染或未经感染的EML细胞(P < 0.05,图 5),表明NPC1和NPC2基因影响EML细胞的增殖。流式细胞仪检测结果显示:与对照比较,经慢病毒NPC1 shRNA和NPC2 shRNA感染的EML细胞CD34和sca-1的阳性率显著降低(P < 0.05,图 6、7),提示NPC1、NPC2沉默以后能够使EML细胞的分化能力降低,与NPC1、NPC2在EML细胞sca-1-high、sca-1-inter、sca-1-low细胞亚群中表达的结果一致(图 2C、D)。
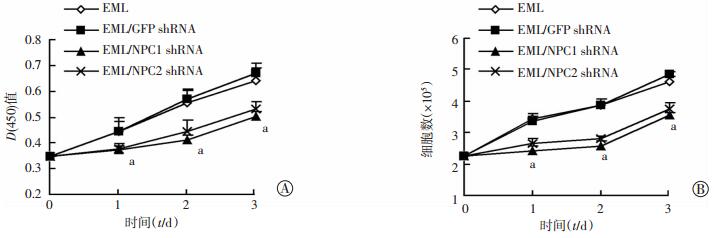
|
| A:CCK-8检测各细胞增殖变化;B:台盼蓝法检测各细胞增殖变化 a:P < 0.05,与对照细胞EML wild type和shGFP/EML比较 图 5 沉默NPC1、NPC2对EML细胞增殖的影响 |
|
| 图 6 流式细胞仪检测各细胞的CD34、sca-1、c-kit阳性率变化 |
|
| a:P < 0.05,与EML、EML/GFP shRNA比较 图 7 NPC1、NPC2基因沉默的EML细胞CD34、sca-1、c-kit阳性率的统计分析 |
2.5 沉默NPC1、NPC2对EML细胞分化的影响
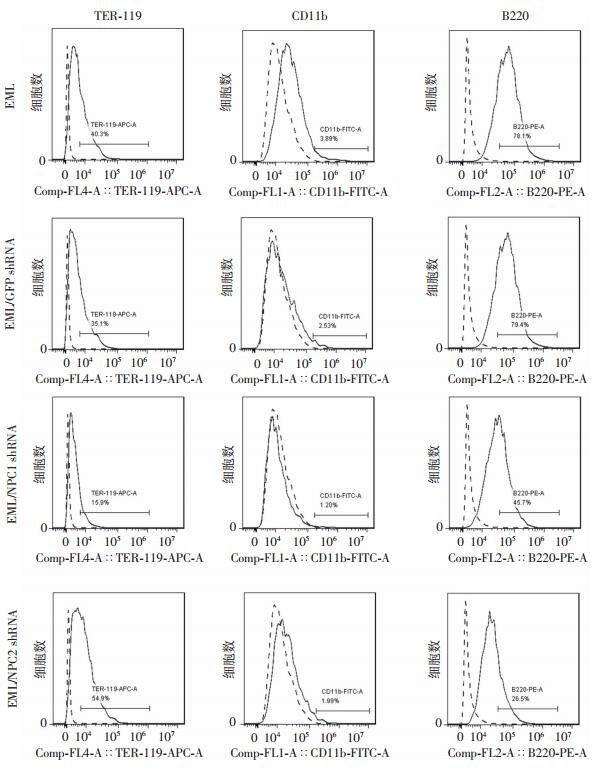
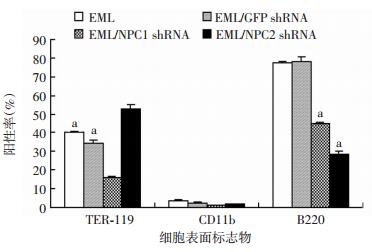
流式细胞仪检测结果显示:c-kit在上述4种细胞中的表达均为99%以上,差异无统计学意义(图 6、7)。这可能与c-kit需在磷酸化后才能进行信号转导相关,总c-kit的表达并不能说明问题。此外,采用流式细胞仪还检测了TER-119、CD11b、B220在上述4种细胞中所占比例(图 8)。其中,TER-119是红系前体细胞表面标志,CD11b是粒系前体细胞表面标志,B220是B淋巴细胞前体细胞表面标志。结果显示:在4种细胞中CD11b所占比例均较低,且差异无统计学意义(图 8、9),说明NPC1、NPC2基因敲低后对EML细胞向粒系的分化并无影响,与lineage在EML细胞中的低表达一致(图 1A);在慢病毒NPC1 shRNA感染的EML细胞中TER-119所占比例显著低于其余3种细胞(P < 0.01,图 8、9),说明NPC1基因的沉默能够抑制EML细胞向红系分化;B220所占比例在经慢病毒NPC1 shRNA和NPC2 shRNA感染的EML细胞中显著降低(P < 0.01,图 8、9),表明沉默NPC1、NPC2基因能够抑制EML细胞向淋巴系分化。
|
| 图 8 流式细胞仪检测TER-119、CD11b、B220在各细胞中所占比例 |
|
| a:P < 0.01,与对照EML细胞、EML/GFP shRNA细胞比较 图 9 NPC1、NPC2沉默的EML细胞TER-119、CD11b、B220阳性率的统计分析 |
2.6 沉默NPC1、NPC2基因能够抑制EML细胞c-kit的磷酸化
Western blot检测结果显示:相较于其他细胞,SCF刺激后NPC1基因沉默EML细胞c-kit的磷酸化受到明显抑制(P < 0.01,图 10),对SCF刺激的反应性明显降低,但在NPC2基因沉默的EML细胞中c-kit的磷酸化改变差异无统计学意义。

|
| 1:EML;2:EML+SCF;3:EML/GFP shRNA;4:EML/GFP shRNA+SCF;5:EML/NPC1 shRNA;6:EML/NPC1-shRNA+SCF;7:EML/NPC2 shRNA;8:EML/NPC2 shRNA+SCF; a:P < 0.01,与EML+SCF、EML/GFP shRNA+SCF比较 A:Western blot检测结果;B:半定量分析 图 10 Western blot检测沉默NPC1、NPC2基因对EML细胞c-kit磷酸化的影响 |
3 讨论
本研究利用胆固醇转运相关基因NPC1、NPC2沉默的EML细胞模型探讨了NPC1、NPC2基因对造血前体细胞EML增殖分化的调节作用。本研究发现:在NPC1、NPC2敲低的EML细胞中出现了胆固醇蓄积,且在NPC1敲低的EML细胞中胆固醇蓄积更显著。细胞内胆固醇的流动依赖于NPC1和可溶性胆固醇结合蛋白NPC2共同作用将细胞摄取及合成的胆固醇从LE/Ly转运到内质网、胞浆膜和其他细胞器膜,而在这个过程中NPC1起主导作用,没有NPC1与游离胆固醇的结合,NPC2将不能自发将胆固醇呈递至溶酶体外。因此,沉默NPC1引起的胆固醇蓄积比沉默NPC2显著;在EML细胞中NPC1、NPC2基因与sca-1呈正相关,而sca-1是HSCs干性的重要标志物之一[16-17],提示NPC1、NPC2基因参与了EML细胞的干性维持;沉默NPC1、NPC2基因后使得EML细胞增殖减慢,并且能够降低EML细胞CD34、sca-1的阳性率,同时抑制EML细胞向淋巴系和红系分化。EML细胞的生长依赖于SCF[12-13],包含SCF的完全培养基能够维持EML细胞自我更新及分化的平衡,而SCF的信号转导取决于细胞膜受体c-kit的磷酸化,经SCF刺激后NPC1基因沉默的EML细胞c-kit磷酸化受到显著抑制,表明NPC1对维持c-kit磷酸化及其下游信号通路介导的细胞增殖和分化起重要作用。
胆固醇是细胞膜和其他生物膜的重要组分,它不仅赋予生物膜流动性和不渗透性,还是膜脂质筏(lipid raft)的重要成分,膜脂质筏是细胞膜受体发挥功能的必要结构[18]。一些重要膜受体如c-kit、LRP6、促血小板生成素受体等主要分布在脂质筏,这些膜受体通过脂质筏介导配体诱导的配体-受体复合物内陷(endocytosis)调节信号转导[10-11]。有研究报道:阻断NPC1的表达,能够抑制膜受体mTOR介导的内皮细胞增殖,这一发现首次将NPC1所介导的胆固醇流动和细胞周期调节联系在一起[19]。EML细胞的增殖分化维持依赖于SCF[12-13],而SCF的信号转导取决于细胞膜受体c-kit的磷酸化,c-kit磷酸化将启动下游信号通路[磷脂酰肌醇3′(PI3K/Akt)、JAK-STAT、Ras-Erk,Src家族激酶(SFK)和磷脂酶Cr通路]参与细胞周期和分化调控。其中,c-kit同样位于细胞膜脂质筏,其功能的发挥也依赖于膜脂质筏介导的配体诱导的配体-受体复合物内陷[18]。本研究发现沉默NPC1、NPC2基因后EML细胞内出现不同程度的胆固醇蓄积(NPC1沉默的EML细胞胆固醇蓄积更显著),且EML细胞的增殖分化受到抑制。进一步研究发现,在NPC1基因沉默的EML细胞c-kit磷酸化显著降低。由此推测:在细胞胆固醇流动过程中NPC1基因起到主要作用,NPC1通过调控细胞胆固醇流动来调节细胞膜胆固醇的代谢,进而影响膜脂质筏的结构和功能并调控SCF受体c-kit磷酸化,最终调节EML细胞的增殖和分化。除此之外,有研究表明胆固醇代谢相关基因Abca1、Abcg1、Abcg4和Apoe的缺失将导致胆固醇因不能顺利转运至HDL而诱发造血系统相关疾病[1, 4-5]。本研究将NPC1、NPC2基因与HSCs增殖分化相联系,一方面弥补了上述研究的局限性,另一方面也为造血系统疾病的治疗提出新思路。下一步研究将探讨脂质筏在c-kit磷酸化前后的改变及c-kit磷酸化后的定位,进一步阐明其机制。
| [1] | Westerterp M, Gourion-Arsiquaud S, Murphy A J, et al. Regulation of hematopoietic stem and progenitor cell mobilization by cholesterol efflux pathways[J]. Cell Stem Cell, 2012, 11(2): 195–206. DOI:10.1016/j.stem.2012.04.024 |
| [2] | Liang S Y, Shen H J, Li Z, et al. Autophagy, autophagy-associated adaptive immune responses and its role in hematologic malignancies[J]. Oncotarget, 2016(25): 1–15. DOI:10.18632/oncotarget.13583 |
| [3] | Boyiadzis M, Bishop M R, Abonour R, et al. The society for immunotherapy of cancer consensus statement on immunotherapy for the treatment of hematologic malignancies: multiple myeloma, lymphoma, and acute leukemia[J]. J Immunother Cancer, 2016, 4: 90. DOI:10.1186/s40425-016-0188-z |
| [4] | Andrew J M, Nora B, Laurent Y C, et al. Cholesterol efflux in megakaryocyte progenitors suppresses platelet production and thrombocytosis[J]. Nat Med, 2013, 19(5): 586–594. DOI:10.1038/nm.3150 |
| [5] | Murphy A J, Akhtari M, Tolani S, et al. ApoE regulates hematopoietic stem cell proliferation, monocytosis, and monocyte accumulation in atherosclerotic lesions in mice[J]. J Clin Invest, 2011, 121(10): 4138–4149. DOI:10.1172/JCI57559 |
| [6] | Jiang W, Tang J J, Miao H H, et al. Forward genetic screening for regulators involved in cholesterol synthesis using validation-based insertional mutagenesis[J]. PLoS One, 2014, 26, 9(11): e112632. DOI:10.1371/journal.pone.0112632.eCollection2014 |
| [7] | Chu B B, Liao Y C, Qi W, et al. Cholesterol transport through lysosome-peroxisome membrane contacts[J]. Cell, 2015, 161(2): 291–306. DOI:10.1016/j.cell.2015.02.019 |
| [8] | Infante R E, Wang M L, Radhakrishnan A, et al. NPC2 facilitates bidirectional transfer of cholesterol between NPC1 and lipid bilayers, astep in cholesterol egress from lysosomes[J]. Proc Natl Acad Sci U S A, 2008, 105(40): 15287–15292. DOI:10.1073/pnas.0807328105 |
| [9] | Kyriakakis E, Maslova K, Frachet A, et al. Cross-talk between EGFR and T-cadherin: EGFR activation promotes T-cadherin localization to intercellular contacts[J]. Cell Signal, 2013, 25(5): 1044–1053. DOI:10.1016/j.cellsig.2013.02.001 |
| [10] | Shirvaikar N, Marquez-Curtis L A, Shaw A R, et al. MT1-MMP association with membrane lipid rafts facilitates G-CSF:induced hematopoietic stem/progenitor cell mobilization[J]. Exp Hematol, 2010, 38(9): 823–835. DOI:10.1016/j.exphem.2010.05.002 |
| [11] | Nacev B A, Grassi P, Dell A, et al. The antifungal drug itraconazole inhibits vascular endothelial growth factor receptor 2 (VEGFR2) glycosylation, trafficking, and signaling in endothelial cells[J].J Biol Chem, 2011 Dec 23, 286(51): 44045-44056. DOI:10.1074/jbc.M111.278754. Epub 2011 Oct 24. |
| [12] | Ye Z J, Gulcicek E, Stone K, et al. Complex interactions in EML cell stimulation by stem cell factor and IL-3[J]. Proc Natl Acad SciUS A, 2011, 108(12): 4882–4887. DOI:10.1073/pnas.1018002108 |
| [13] | Ye Z J, Kluger Y, Lian Z, et al. Two types of precursor cells inamultipotential hematopoietic cell line[J]. Proc Natl Acad Sci U S A, 2005, 102(51): 18461–18466. DOI:10.1073/pnas.0509314102 |
| [14] | Weston W, Zayas J, Perez R, et al. Dynamic equilibrium of heterogeneous and interconvertible multipotent hematopoietic cell subsets[J]. Sci Rep, 2014, 4: 5199. DOI:10.1038/srep05199 |
| [15] | Weiler S R, Gooya J M, Ortiz M, et al. D3:agene induced during myeloid cell differentiation of Linlo c-Kit+ Sca-1(+) progenitor cells[J]. Blood, 1999, 93(2): 527–536. |
| [16] | Chang H H, Hemberg M, Barahona M, et al. Transcriptome-wide noise controls lineage choice in mammalian progenitor cells[J]. Nature, 2008, 453(7194): 544–547. DOI:10.1038/nature06965 |
| [17] | Lee H M, Zhang H, Schulz V, et al. Downstream targets of HOXB4 inacell line model of primitive hematopoietic progenitor cells[J]. Blood, 2010, 116(5): 720–730. DOI:10.1182/blood-2009-11-253872 |
| [18] | Jahn T, Leifheit E, Gooch S, et al. Lipid rafts are required for Kit survival and proliferation signals[J]. Blood, 2007, 110(6): 1739–1747. DOI:10.1182/blood-2006-05-020925 |
| [19] | Xu J, Dang Y, Ren Y R, et al. Cholesterol trafficking is required for mTOR activation in endothelial cells[J]. Proc Natl Acad Sci USA, 2010, 107(10): 4764–4769. DOI:10.1073/pnas.0910872107 |



