2. 400038 重庆,第三军医大学:西南医院病理研究所;
3. 400042 重庆,第三军医大学大坪医院野战外科研究所肝胆外科
2. Institute of Pathology, Southwest Hospital, Third Military Medical University, Chongqing, 400038;
3. Department of Hepatobiliary Surgery, Institute of Surgery Research, Daping Hospital, Third Military Medical University, Chongqing, 400042, China
随着物质生活水平的提高,非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)的发病率剧增,并呈现年轻化的趋势[1-2]。辅助T细胞17(T helper 17 cells,Th17) 细胞数量在多种肝病患者中显著升高,包括病毒性肝炎、原发性胆汁性肝硬化、自身免疫性肝炎、酒精性肝病和非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)[3-4]。白介素17A(interleukin 17A,IL-17A)是Th17细胞分泌的特征性细胞因子,在脂多糖(lipopolysaccharide,LPS)诱导的急性肝损伤及NASH动物模型中均发现IL-17A的水平升高,并与肝损伤程度相关[5]。IL-17A或其特异性受体IL-17RA的基因敲除能显著减轻高脂诱导小鼠NASH的进展,采用IL-17A抗体中和内源性IL-17A能有效减轻LPS诱导的肝损伤[6]。但IL-17A基因敲除如何减轻肝损伤的机制并未阐明。本研究以IL-17A基因敲除小鼠为对象,通过高脂膳食诱导脂肪肝,并给予低剂量LPS刺激诱导肝损伤为模型,观察IL-17A基因敲除在NAFLD相关肝损伤发生中的作用和机制。
1 材料与方法 1.1 实验动物IL-17A基因敲除(gene knockout,KO)C57BL/6小鼠由第三军医大学邹全明教授馈赠,野生型(wild type,WT)C57BL/6小鼠购自第三军医大学实验动物中心。实验采用完全随机分组法,其中野生型正常膳食组7只,野生型高脂膳食组7只,IL-17A基因敲除型正常膳食组5只,IL-17A基因敲除型高脂组5只。
1.2 主要试剂高脂饲料(MD12032,江苏美迪森);LPS(美国Sigma公司);TRIzol(CW0580,北京康为世纪公司);M-MLV逆转录试剂盒(C28025023,美国Life公司);实时定量PCR试剂盒(DRR820,大连TaKaRa公司);多种细胞因子测定试剂盒(德国Merck millipore公司);HE染色试剂盒(C0105,南京碧云天公司);丙二醛(malondialdehyde,MDA)、过氧化氢酶(catalase,CAT)活性、总抗氧化能力(total antioxidativecapability, T-AOC)和尼克酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)测定试剂盒(A003-2、A007-1、A015、A111-1,南京建成公司);TUNEL细胞凋亡检测试剂盒(TUN11684817,瑞士Roche公司);DAB显色液(ZLI-9017,北京中杉金桥公司)。
1.3 方法 1.3.1 脂肪肝急性肝损伤模型构建采用正常膳食及长程高脂膳食(high fat diet, HF)分别喂养的野生型C57BL/6小鼠(n=14) 和背景相同的IL-17A基因敲除的小鼠(n=10),3个月后,辅之以腹腔一次性注射LPS(4 mg/kg),注射16 h后取血浆并处死动物。
1.3.2 细胞因子检测取小鼠血液并立刻置于已加抗凝剂的离心管中,400×g离心5 min(离心半径0.5 cm),取上层淡黄色血浆,之后严格按照Milipore多种细胞因子测定试剂盒说明书操作。
1.3.3 血浆谷丙转氨酶(alanine transaminase,ALT)和谷草转氨酶(aspartate transaminase,AST)测定参考第三军医大学西南医院检验科操作标准执行。
1.3.4 肝脏HE染色取新鲜小鼠肝脏,置于4%多聚甲醛固定30 min后,制作成石蜡切片。石蜡切片脱蜡并水化后,严格按照HE染色试剂盒说明书操作,封片后在光学显微镜下,100倍视野观察取景。
1.3.5 肝脏总RNA提取及实时定量PCR(quantitative Real-time PCR,qPCR)取小鼠新鲜肝脏,按照TRIzol提取肝脏总RNA,详细操作参照说明书进行。然后用适量DEPC水溶解提取到的总RNA,置于冰上,立即定量定性,标化。最后以总RNA为模板,严格按照M-MLV逆转录试剂盒说明书操作进行cDNA的第1链的合成。然后严格按照实时定量PCR试剂盒说明书操作,检测相关靶基因的mRNA表达水平。每孔反应体系如下:靶基因上下游引物(10 μmol/L)各0.8 μL,cDNA 1 μL,SYBR premix Ex Taq 10 μL,DEPC水补至20 μL。之后,避光置于实时荧光定量PCR仪,按照预变性95 ℃ 30 s, 95 ℃ 5 s,60 ℃ 34 s,40个循环进行PCR扩增。取Ct值,使用相对定量方法2-△△Ct法计算。基因的mRNA相对表达水平。各小鼠靶基因引物序列如下:β-actin上游引物5′-CTGTCC-CTGTATGCCTCTG-3′,下游引物5′-ATGTCACGCACG-ATTTCC-3′;IL-17A上游引物5′-GGACTCTCCACCGC-AATGAA-3′,下游引物5′-TTTCCCTCCGCATTGACAC-A-3′;CAT上游引物5′-GGTGCCCCCAACTATTACCC-3′,下游引物5′-GAATGTCCGCACCTGAGTGA-3′;GPX1上游引物5′-AGTTCGGACACCAGGAGAATG-3′,下游引物5′-TAAAGAGCGGGTGAGCCTTC-3′;IDH1上游引物5′-ATG-CAAGGAGATGAAATGACACG-3′,下游引物5′-GCATCACGATTCTCTATGCCTAA-3′;IDH2上游引物5′-GACAGTCACCCGCCATTACC-3′,下游引物5′-AGCGTCTGTGCAAACCTGATA-3′;ME1上游引物5′-ACCCGCAT-CTCAACAAGGACT-3′,下游引物5′-GATGCAGGGCGGCAACAATC-3′。实验重复3次。
1.3.6 TUNEL细胞凋亡检测取新鲜小鼠肝脏制作成石蜡切片。切片脱蜡并水化后,置于柠檬酸溶液中(0.1 mol/L,pH 6.0),700 W微波煮沸加热1 min,转入20~25 ℃ PBS中,擦干后用封闭液(含3%牛血清白蛋白和20%正常牛血清的0.1 mol/L,pH 7.5 Tris-HCl),室温封闭30 min,PBS浸洗3遍,滴加TUNEL反应混合液(对照组滴加PBS),37 ℃避光孵育60 min,PBS浸洗3遍,擦干样品周围液体,滴加Converter-POD,37 ℃避光孵育30 min,PBS浸洗3遍,滴加DAB显色液,光学显微镜观察,适时插入PBS终止反应,苏木精复染,封片。光学显微镜下,400倍视野计数。
1.3.7 肝脏转录组学分析转录组学分析参照上海康成生物公司操作标准执行。
1.4 统计学分析采用SPSS 18.0统计软件进行统计分析,计量资料以x±s表示,多个样本均数比较采用方差齐性检验,组间比较采用方差分析和t检验。检验水准:α=0.05。
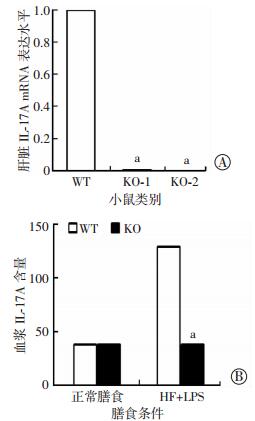
2 结果 2.1 IL-17A基因敲除小鼠的鉴定采用qPCR检测KO小鼠及野生型对照小鼠肝组织IL-17A的mRNA表达水平,结果显示野生型小鼠存在低水平IL-17A表达,而KO小鼠肝脏中几乎检测不到IL-17A的mRNA(P < 0.05,图 1A)。进一步通过ELISA检测血浆中IL-17A的含量,发现在正常膳食条件下,血浆中IL-17A的水平在WT及KO小鼠中并不显著改变(P>0.05,图 1B),而在高脂膳食联合LPS(HF+LPS)的刺激下,WT小鼠中IL-17A的水平显著升高(P < 0.05),而KO小鼠中仍然维持在基线水平(图 1B)。这些结果显示IL-17A是HF+LPS刺激下肝脏高表达的炎症介质分子,KO小鼠已经被成功地敲除了IL-17A分子。
|
|
A:肝脏IL-17A mRNA表达水平;B:血浆IL-17A含量 a:P < 0.05,与WT小鼠比较 图 1 O和WT小鼠在不同喂养条件下肝脏和血清IL-17A表达水平(n=3,x±s) |
2.2 IL-17A基因敲除减轻HF+LPS诱导的急性肝损伤
通过测定4组小鼠的血浆ALT与AST水平发现,在正常膳食条件下,IL-17A基因敲除对小鼠血浆ALT与AST水平均无显著影响(P>0.05);但在HF+LPS刺激下,KO小鼠血浆ALT和AST含量则较WT小鼠显著降低(P < 0.05,图 2A、B)。HE染色结果显示,在正常膳食条件下,KO和WT小鼠肝组织中的炎症细胞数量差异无统计学意义,但在HF+LPS条件下,IL-17A基因敲除可以减轻肝脏炎症细胞浸润(图 2C)。ELISA检测肝组织匀浆中TNF-α、IL-1β和IL-6炎症因子含量,结果显示,在正常膳食条件下,WT小鼠和KO小鼠炎症因子差异均无统计学意义(P>0.05);但在HF+LPS刺激下,相对于WT小鼠,KO小鼠肝脏浸润的3种炎症因子含量显著减少(P < 0.05,图 2D、E、F)。这些结果表明,IL-17A基因敲除可以减轻HF+LPS诱导的急性肝损伤。

|
| A:血浆ALT水平;B:血浆AST水平;C:分别为正常膳食WT小鼠、KO小鼠,HF+LPS WT小鼠、KO小鼠肝脏HE染色(LM ×200);D~F:分别为肝脏TNF-α、IL-1β、IL-6炎症因子水平 a:P < 0.05,与WT小鼠比较 图 2 KO和WT小鼠在不同喂养条件下血清转氨酶和肝脏炎症因子水平(n=3,x±s) |
2.3 IL-17A基因敲除小鼠肝脏基因转录芯片分析
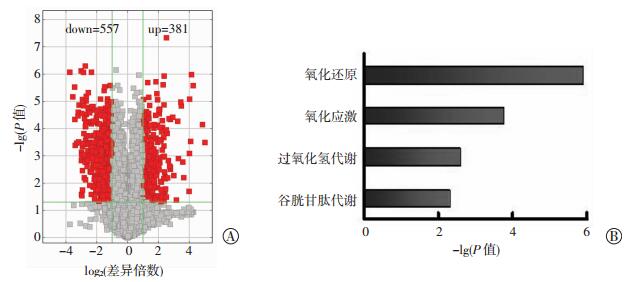
通过对肝脏表达mRNA进行转录组学分析,结果显示:在HF+LPS刺激下,WT和KO小鼠肝脏间中共有20 235个差异基因(灰色,图 3A),包括938个显著差异基因(P < 0.05,红色,图 3A),其中381个为显著上调基因(WT vs KO),557个为显著下调基因(WT vs KO)。经GO功能分析后发现显著差异基因的功能主要富集于氧化应激(P < 0.01)、过氧化氢代谢途径(P < 0.01) 以及谷胱甘肽代谢途径(P < 0.01,图 3B)。
|
| A:在HF+LPS刺激下KO小鼠肝脏中的20 235个差异基因(方格),其中938个基因显著变化(红色方格),而显著下调的有557个(Y轴以左),显著上调的有381个(Y轴以右);B:显著下调基因富集的生物过程 图 3 在HF+LPS刺激下KO小鼠肝脏转录组变化 |
2.4 IL-17A基因敲除小鼠肝脏参与代谢转化过氧化氢的酶表达增强
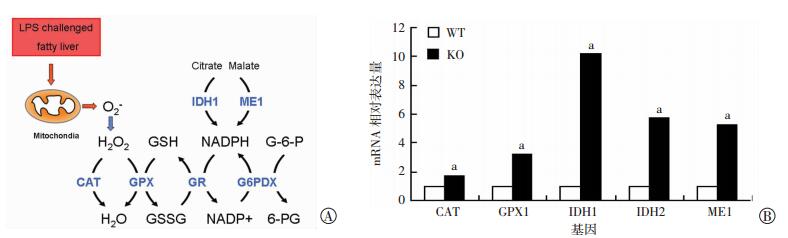
过氧化氢堆积是炎症反应导致肝脏氧化应激损伤的重要机制,其代谢转化途径与肝细胞内还原性物质谷胱甘肽(glutathione,GSH)及NADPH的生成与转化密切相关(图 4A)。我们对HF+LPS刺激后的WT及KO小鼠肝组织的相关酶基因mRNA进行qPCR定量分析,结果显示,参与过氧化氢代谢转化的多个酶基因表达水平升高,如CAT、谷胱甘肽过氧化物酶1(glutathione peroxidase 1,GPX1)、异柠檬酸脱氢酶1(isocitratedehydrogenase1,IDH1)、IHD2以及苹果酸酶1(malic enzyme 1,ME1,图 4B)。
|
| A:肝脏过氧化氢代谢途径;B:肝脏过氧化氢代谢相关基因mRNA表达水平(n=3,x±s) a:P < 0.05,与WT小鼠比较 图 4 肝脏过氧化氢代谢途径及其相关基因mRNA表达水平 |
2.5 IL-17A基因敲除小鼠降低肝脏氧化应激水平
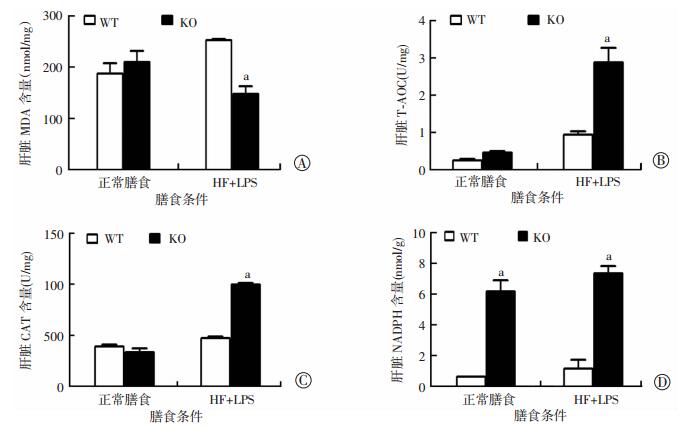
对小鼠肝脏氧化应激产物MDA含量、T-AOC、CAT活性及NADPH水平测定结果显示,在正常膳食喂养条件下,敲除IL-17A基因对肝脏MDA、T-AOC、CAT活性与WT小鼠比较差异无统计学意义(P>0.05);但在HF+LPS条件下,敲除IL-17A基因显著减少肝脏MDA含量(P < 0.05),CAT、NADPH及T-AOC均显著提高(P < 0.05)。无论是正常膳食还是HF+LPS条件下,IL-17A基因敲除可以显著上调NADPH水平(P < 0.05)。这表明IL-17A基因的敲除能显著降低肝脏氧化应激水平(图 5)。
|
| A:MDA;B:T-AOC;C:CAT;D:NADPH a:P < 0.05,与WT比较 图 5 KO和WT小鼠在不同喂养条件下肝脏氧化应激水平变化(n=3,x±s) |
2.6 IL-17A基因敲除减少HF+LPS诱导的肝脏细胞凋亡
通过TUNEL检测肝脏细胞凋亡数量,结果显示,在正常膳食条件下,WT与KO小鼠肝组织凋亡细胞无显著变化(P>0.05);但在HF+LPS刺激下,KO小鼠肝脏凋亡细胞数量较WT小鼠显著减少(P < 0.05)。这表明IL-17A基因敲除显著减少HF+LPS诱导的肝脏细胞凋亡(图 6)。

|
| A:TUNEL检测肝脏细胞凋亡(LM ×200);B:凋亡细胞数量(n=3,x±s) a:P < 0.05,与WT小鼠比较 图 6 TUNEL检测KO和WT小鼠在不同喂养条件下肝脏细胞凋亡情况 |
3 讨论
NAFLD是全球第一大非感染性肝病,我国发病率为12%~15%[2],该病可进一步进展为肝硬化、肝癌,还是糖尿病、心血管疾病的重要诱因[7]。但目前NAFLD发病机制不清。目前被广泛接受的是由DAY等[8]提出的“二次打击”假说。“二次打击”假说认为首先是胰岛素抵抗等因素引起肝脏脂质的过度堆积,从而导致单纯脂肪肝的发生[8-10],在脂质过度堆积所引起的氧化应激、免疫炎症损伤、线粒体功能损伤、内质网应激以及肠道毒素等二次打击因素作用下[11-18],肝脏代偿机制被破坏,单纯脂肪肝进展为非酒精性脂肪性肝炎、肝纤维化和肝硬化。近年发现,免疫炎症反应在NAFLD发生、发展中起重要作用[19]。IL-17A是Th17细胞分泌的特征性炎症介质,在多种急、慢性肝病包括NASH动物模型及临床肝病患者中表达升高[3-4, 20-21]。本研究采用的长程高脂膳食诱导脂肪肝,给予LPS急性炎症刺激的小鼠为模型,能够较好地模拟临床上以肝脂肪变性为基础的炎性损伤状态。
本研究揭示IL-17A基因缺陷能显著降低HF+LPS诱导的肝损伤,该结果与TANG等[5]报道一致。也与近期有关IL-17A受体基因敲除(IL-17RA-/-)小鼠NAFLD进展及肝损伤减轻的报道相一致[6]。
氧化应激损伤在脂肪性肝病肝损伤中具有重要作用[8]。本实验结果进一步表明IL-17A基因敲除降低HF+LPS诱导的肝脏氧化应激损伤,并且主要与过氧化氢代谢转化相关,支持该结论的证据来自4个方面:① mRNA芯片显示,KO小鼠肝脏氧化应激反应及过氧化氢代谢较WT小鼠显著降低;② qPCR检测结果证实,KO小鼠肝组织中多个参与过氧化氢代谢转化的酶表达水平升高(CAT、GPX1、IDH1、IDH2、ME1);③ 肝脏氧化应激指标检测结果证实,KO小鼠MDA水平降低,抗氧化产物CAT、NADPH、T-AOC水平显著升高;④ TUNEL染色结果显示,KO小鼠肝脏凋亡细胞较WT小鼠显著降低。这将IL-17A与过氧化氢代谢转化联系起来。
本研究从过氧化氢代谢转化及其相关抗氧化酶表达的角度比较深入地剖析了IL-17A在NAFLD相关肝损伤中的作用。至于IL-17A基因敲除如何上调肝脏抗氧化应激相关酶的表达,根据当前已有数据并结合部分体外实验结果,我们猜测IL-17A可能是间接或直接影响关键转录因子的活性来发挥作用,而其中机制尚待进一步阐明。
| [1] | LI Z, XUE J, CHEN P, et al. Prevalence of nonalcoholic fatty liver disease in mainland of China: a meta-analysis of published studies[J]. J Gastroenterol Hepatol, 2014, 29(1): 42–51. DOI:10.1111/jgh.12428 |
| [2] | FAN J G. Epidemiology of alcoholic and nonalcoholic fatty liver disease in China[J]. J Gastroenterol Hepatol, 2013, 28(Suppl 1): 11–17. DOI:10.1111/jgh.12036 |
| [3] | OO Y H, BANZ V, KAVANAGH D, et al. CXCR3-dependent recruitment and CCR6-mediated positioning of Th-17 cells in the inflamed liver[J]. J Hepatol, 2012, 57(5): 1044–1051. DOI:10.1016/j.jhep.2012.07.008 |
| [4] | ZHANG J Y, ZHANG Z, LIN F, et al. Interleukin-17-producing CD4(+) T cells increase with severity of liver damage in patients with chronic hepatitis B[J]. Hepatology, 2010, 51(1): 81–91. DOI:10.1002/hep.23273 |
| [5] | TANG Y, BIAN Z, ZHAO L, et al. Interleukin-17 exacerbates hepatic steatosis and inflammation in non-alcoholic fatty liver disease[J]. Clin Exp Immunol, 2011, 166(2): 281–290. DOI:10.1111/j.1365-2249.2011.04471.x |
| [6] | HARLEY I T, STANKIEWICZ T E, GILES D A, et al. IL-17 signaling accelerates the progression of nonalcoholic fatty liver disease in mice[J]. Hepatology, 2014, 59(5): 1830–1839. DOI:10.1002/hep.26746 |
| [7] | ZHANG L, ZHANG F K. Advances in research of nonalcoholic fatty liver disease[J]. World Chin J Digestol, 2016(27): 3860–3869. DOI:10.11569/wcjd.v24.i27.3860 |
| [8] | DAY C P, JAMES O F. Steatohepatitis: a tale of two "hits"?[J]. Gastroenterology, 1998, 114(4): 842–845. DOI:10.1016/S0016-5085(98)70599-2 |
| [9] | TESSARI P, CORACINA A, COSMA A, et al. Hepatic lipid metabolism and non-alcoholic fatty liver disease[J]. Nutr Metab Cardiovasc Dis, 2009, 19(4): 291–302. DOI:10.1016/j.numecd.2008.12.015 |
| [10] | LAMBERT J E, RAMOS-ROMAN M A, Browning J D, et al. Increased de novo lipogenesis is a distinct characteristic of individuals with nonalcoholic fatty liver disease[J]. Gastroenterology, 2014, 146(3): 726–735. DOI:10.1053/j.gastro.2013.11.049 |
| [11] | KOUKIAS N, BUZZETTI E, TSOCHATZIS E A. Intestinal hormones, gut microbiota and nonalcoholic fatty liver disease[J]. Minerva Endocrinologica, 2017, 42(2): 184–194. |
| [12] | PATTERSON R E, KALAVALAPALLI S, WILLIAMS C M, et al. Lipotoxicity in steatohepatitis occurs despite an increase in tricarboxylic acid cycle activity[J]. Am J Physiol Endocrinol Metab, 2016, 310(7): E484–E494. DOI:10.1152/ajpendo.00492.2015 |
| [13] | SUNNY N E, BRIL F, CUSI K. Mitochondrial adaptation in nonalcoholic fatty liver disease: novel mechanisms and treatment strategies[J]. Trends Endocrinol Metab, 2016, 28(4): 250–260. DOI:10.1016/j.tem.2016.11.006 |
| [14] | BOZAYKUT P, SAHIN A, KARADEMIR B, et al. Endoplasmic reticulum stress related molecular mechanisms in nonalcoholic steatohepatitis[J]. Mech Ageing Dev, 2016, 157: 17–29. DOI:10.1016/j.mad.2016.07.001 |
| [15] | KIRPICH I A, MARSANO L S, MCCLAIN C J. Gut-liver axis, nutrition, and non-alcoholic fatty liver disease[J]. Clin Biochem, 2015, 48(13/14): 923–930. |
| [16] | LEAMY A K, EGNATCHIK R A, SHIOTA M, et al. Enhanced synthesis of saturated phospholipids is associated with ER stress and lipotoxicity in palmitate treated hepatic cells[J]. J Lipid Res, 2014, 55(7): 1478–1488. DOI:10.1194/jlr.M050237 |
| [17] | DOWMAN J K, TOMLINSON J W, Newsome P N. Pathogenesis of non-alcoholic fatty liver disease[J]. QJM, 2010, 103(2): 71–83. DOI:10.1093/qjmed/hcp158 |
| [18] | TSUKAMOTO H, RIPPE R, NIEMELA O, et al. Roles of oxidative stress in activation of Kupffer and Ito cells in liver fibrogenesis[J]. J Gastroenterol Hepatol, 1995, 10(Suppl 1): S50–S53. |
| [19] | TILG H, DIEHL A M. Cytokines in alcoholic and nonalcoholic steatohepatitis[J]. N Engl J Med, 2000, 343(20): 1467–1476. DOI:10.1056/NEJM200011163432007 |
| [20] | LEMMERS A, MORENO C, GUSTOT T, et al. The interleukin-17 pathway is involved in human alcoholic liver disease[J]. Hepatology, 2009, 49(2): 646–657. DOI:10.1002/hep.22680 |
| [21] | WEAVER C T, HARRINGTON L E, MANGAN P R, et al. Th17: an effector CD4 T cell lineage with regulatory T cell ties[J]. Immunity, 2006, 24(6): 677–688. DOI:10.1016/j.immuni.2006.06.002 |



