缺血性脑卒中治疗后,血液再灌注引起的炎症扩展会对梗死周围组织造成损伤,这被称为脑缺血再灌注损伤(cerebral ischemia-reperfusion injury,CIRI)。引起CIRI的主要原因与炎症扩展有关。近年来,在药物防治CIRI的研究中,作为传统抗凝药物的低分子肝素(low molecular weight heparins,LMWH)因其逐渐被肯定的抗炎效果对脑保护的作用而得到关注。研究发现在CIRI早期使用低剂量LMWH,不仅能减小脑梗死体积[1-2],而且能够降低神经细胞中NF-κB活化及炎症因子(如TNF-α、IL-1β等)表达[3],减少炎症扩展。尽管近年来类似研究很多,但大多都停留在现象研究上,对LMWH调节抗炎过程具体涉及哪些环节,至今仍未见研究报道。一些研究[4-5]推测LMWH可能通过物理结合方式阻止NF-κB核易位活化从而减少炎症介质生成,虽然这种说法在一定程度上能解释现象,但理论依据不足,无法得到普遍认可。然而在CIRI的其他研究中发现SUMO2/3蛋白修饰能够提高神经细胞对CIRI的耐受性,对梗死边缘组织有保护作用[6]。另一方面,SUMO2/3修饰是NF-κB活化过程的重要调控环节[7]。SUMO2/3能竞争性结合NF-κB活化过程的抑制性蛋白IκBα,使其免于被蛋白酶体降解而引起NF-κB P65被释放进入核内活化[8]。鉴于此,在CIRI中LMWH能否对SUMO2/3修饰产生影响?SUMO2/3修饰是否是LMWH调节NF-κB活化及炎症因子表达的中间环节?这有待研究证实。
本研究以脑缺血再灌注大鼠为模型,以LMWH为研究对象,以NF-κB活化及炎症因子IL-1β生成为切入点,重点探讨了LMWH对脑缺血再灌注后SUMO2/3蛋白表达及细胞内核质分布的影响,从实验角度揭示了CIRI中LMWH能否对SUMO2/3修饰产生影响,为研究SUMO2/3修饰在LMWH调节NF-κB活化过程的中间环节作用提供了初步的实验依据。
1 材料与方法 1.1 实验动物与材料 1.1.1 实验动物与分组健康成年雄性SD大鼠60只,体质量200~220 g,标准环境饲养,由第三军医大学大坪医院实验动物中心提供。采用随机数字表法将大鼠完全随机分为3组:假手术组(Sham,n=20)、缺血再灌注组(I/R,n=20) 和低分子肝素干预组(LMWH,n=20)。根据缺血后再灌注时间不同,于再灌注3 h和24 h分别取材进行相关检测。
1.1.2 药品和试剂A5级硅胶包被MCAO栓线(北京西浓科技有限公司);依诺肝素钠注射液(Sanofi公司,法国);中性RIPA组织裂解液(上海碧云天生物技术公司);兔抗SUMO2/3单克隆抗体(Abcam公司,美国),兔抗NF-κB P65单克隆抗体(CST公司,美国),兔抗IL-1β多克隆抗体(Abcam公司,美国),鼠抗β-actin单克隆内参抗体(武汉三鹰生物技术有限公司),驴抗兔荧光二抗(LI-COR公司,美国);2, 3, 5-氯化三苯基四氮唑,TTC(Sigma公司,美国);免疫组化染色试剂盒(中杉金桥生物技术有限公司);驴抗兔荧光二抗Light594(Thermo公司,美国),驴抗鼠荧光二抗Light488(Abcam公司,美国)。
1.1.3 实验器材低温离心机(Thermo scientific,美国);Western blot电泳设备(Bio-Rad公司,美国);红外荧光扫描成像系统(Odyssey公司,美国);石蜡切片设备(Leica公司,德国)。
1.2 方法 1.2.1 大鼠局灶性脑缺血再灌注模型的建立采用线栓法制备大鼠大脑中动脉缺血再灌注(middle cerebral artery occlusion,MCAO)模型。栓线直径为0.25~0.28 mm,经大鼠左侧颈外动脉置入,栓塞至大脑中动脉起始部,置入深度约18 mm。大脑中动脉缺血1 h后,轻轻抽提栓线实现再灌注。Sham组仅分离血管,不留置线栓。手术过程均保持无菌操作。
1.2.2 给药方式与时间LMWH组于再灌注前5 min经大鼠左侧颈内静脉给予1.5 mg/kg的依诺肝素钠注射液,I/R组以相同方式注射等容积生理盐水。
1.2.3 神经功能评分以Garcia等[9]提出的神经功能评分方法为标准,从大鼠自主运动、体态对称性、前肢伸展功能、网屏实验、身体双侧触觉、双侧胡须反射等6个方面评价大鼠神经功能损伤程度,最高为18分,最低为3分,得分越低神经功能损伤越重。手术时出血较多,呼吸困难,取材时发现蛛网膜下腔出血或提前死亡的大鼠予以剔除,从同批次模型中随机补充。
1.2.4 脑梗死体积测定各组于再灌注结束时将大鼠麻醉,开胸经心脏灌注37 ℃生理盐水,至右心耳流出液清亮为止,而后断头取脑,沿冠状面将大脑均匀切成6片(约2.5 mm/片),放入2%的TTC溶液中37 ℃摇动孵育15 min,然后置于4%多聚甲醛固定24 h。TTC染色后正常组织呈红色,梗死组织呈白色,由于脑梗死后梗死组织会出现脑水肿现象,为了减少其影响,梗死体积测定按照如下公式计算:梗死体积(mm3)=梗死面积(mm2)×厚度(mm);梗侧半球梗死体积百分比=[总梗死体积-(梗侧半球体积-非梗侧半球体积)]/非梗侧半球体积×100%;梗侧半球剩余正常体积百分比=(1-梗侧半球梗死体积)×100%。
1.2.5 Western blot检测大鼠处死、灌注、取脑后于梗侧大脑半球距前囟点-1~+3 mm之间冠状切取约4 mm厚脑组织块,分离顶叶皮层作为标本,经裂解液研磨裂解后离心取上清液获取脑组织总蛋白。取50 μg蛋白样品采用Western blot法经电泳、转膜、封闭后孵育抗体,而后将膜在红外荧光扫描成像系统进行曝光成像,并采用Image J图像分析系统进行条带灰度分析。实验中应用的抗体包括兔抗IL-1β多克隆抗体(1∶500),兔抗NF-κB P65单克隆抗体(1∶500),兔抗SUMO2/3单克隆抗体(1∶500),兔抗β-actin单克隆内参抗体(1∶1 000),驴抗兔荧光二抗(1∶15 000)。以IL-1β、NF-κB P65以及SUMO2/3蛋白分别与内参β-actin蛋白条带灰度值之比表示3种蛋白的表达量。
1.2.6 免疫组化及免疫荧光大鼠处死及灌注方法同上,灌注生理盐水至右心耳流出液清亮后换用4%多聚甲醛灌注至四肢抽搐,取脑后切取同样范围脑组织块置于4%多聚甲醛中固定24 h。经脱水、石蜡包埋后连续切片成厚5 μm贴片。进行免疫组化染色的切片经烘干脱蜡、抗原修复、去除内源性氧化物、封闭后加一抗SUMO2/3(1∶100) 孵育过夜,经山羊抗兔二抗孵育、辣根过氧化物酶反应、DAB染色加苏木精复染,最后中性树胶封片,显微镜下拍照。进行免疫荧光染色的切片封闭后进行一抗SUMO2/3(1∶50)、NeuN(1∶500) 孵育过夜,经驴抗兔荧光二抗Light594(1∶50)、驴抗鼠荧光二抗Light488(1∶50) 避光孵育、DAPI染色后中性树胶封片,激光共聚焦显微镜扫描拍照。免疫组化结果,以连续5个视野中阳性细胞占总细胞数百分比表示各组SUMO2/3蛋白细胞表达定位情况。免疫荧光结果以SUMO2/3荧光的核质分布表示各组SUMO2/3蛋白核质转移情况。
1.3 统计学分析计量资料以x±s表示,采用SPSS 24.0统计软件,多组间比较采用单因素方差分析,方差齐时两两比较行LSD检验,方差不齐时行Mann-Whitney U检验。检验水准α=0.05。
2 结果 2.1 大鼠脑缺血再灌注模型建立及神经功能评价参照Garcia评分法对术后大鼠进行神经功能评价,模型成功者术后活动减少,梗死对侧前肢肌力减弱,呈转圈运动。各组大鼠经脑缺血再灌注后出现不同程度神经功能损伤症状,并随着再灌注时间延长呈加重趋势,以再灌注24 h最重,经LMWH干预后大鼠神经功能损伤症状得到缓解。Sham组、I/R组、LMWH组Garcia评分分别为(17.80±0.42)、(8.90±1.10)、(13.10±1.20),LMWH组与I/R组比较,差异具有统计学意义(P<0.01)。
2.2 LMWH降低脑缺血再灌注大鼠脑梗死体积脑缺血再灌注24 h后,I/R组和LMWH组大鼠均出现了不同程度的脑梗死,其中I/R组梗死最重,而经LMWH干预后的大鼠脑梗死体积相对减少(图 1A)。对应地,LMWH组梗侧半球剩余正常组织体积百分比高于I/R组(P<0.01,图 1B)。此外,每个脑切片梗死体积也呈现出了不同变化,LMWH组与I/R组相比,在前囟点后0~2.5 mm及2.5~5 mm范围(即纹状体区域)的两个脑片,梗死体积组间相差最大(P<0.01,图 1C),此结果说明LMWH能够有效改善MCAO模型梗死敏感区纹状体的损伤程度。
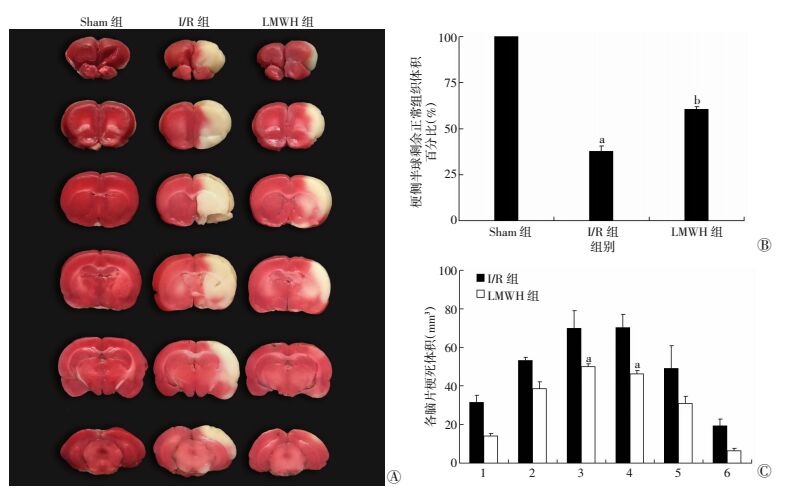
|
| A:再灌注24 h后TTC染色结果;B:梗侧半球剩余正常组织体积百分比对比分析(n=5) a: P<0.01, 与Sham组比较;b: P<0.01, 与I/R组比较;C:I/R组与LMWH组各脑片梗死体积对比分析(n=5) 1∶梗侧大脑半球距前囟点前+5~+2.5 mm;2:梗侧大脑半球距前囟点前+2.5~0 mm;3:梗侧大脑半球距前囟点后0~-2.5 mm;4:梗侧大脑半球距前囟点后-2.5~-5 mm;5:梗侧大脑半球距前囟点后-5~-7.5 mm;6:梗侧大脑半球距前囟点后-7.5~-10 mm;a: P<0.01, 与I/R组比较 图 1 TTC染色检测各组大鼠脑梗死体积、梗侧半球剩余正常组织体积百分比及各脑片梗死体积变化趋势 |
2.3 LMWH降低脑缺血再灌注大鼠IL-1β的生成
Western blot检测结果显示:再灌注24 h后I/R组大鼠脑组织中IL-1β蛋白表达明显高于Sham组(P<0.01),而LMWH干预组相比I/R组IL-1β蛋白表达相对降低(P<0.01)。提示LMWH在大鼠脑缺血再灌注损伤模型中能抑制炎症因子IL-1β蛋白的产生(图 2)。
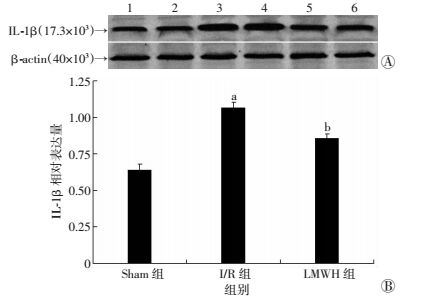
|
| A:Western blot检测结果1、2:Sham组;3、4:I/R组;5、6:LMWH组;B:半定量分析(n=5) a: P<0.01, 与Sham组比较;b: P<0.01, 与I/R组比较 图 2 Western blot检测各组IL-1β蛋白表达 |
2.4 LMWH降低脑缺血再灌注大鼠NF-κB P65的活化
Western blot检测结果显示:再灌注24 h后I/R组大鼠脑组织中NF-κB P65蛋白表达高于Sham组(P<0.01),而经LMWH干预后的大鼠NF-κB P65蛋白表达相比I/R组下降(P<0.01)。说明LMWH在大鼠脑缺血再灌注损伤模型中能抑制NF-κB P65蛋白的活化与表达(图 3)。
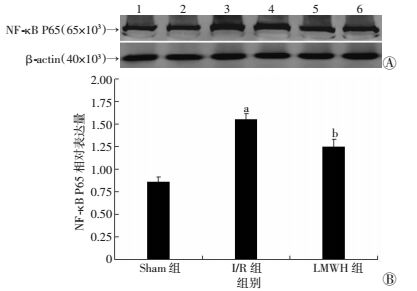
|
| A:Western blot检测结果1、2:Sham组;3、4:I/R组;5、6:LMWH组;B:半定量分析(n=5) a: P<0.01, 与Sham组比较;b: P<0.01, 与I/R组比较 图 3 Western blot检测各组NF-κB P65蛋白表达 |
2.5 LMWH增强脑缺血再灌注大鼠SUMO2/3的表达
再灌注3 h后,与Sham组相比,I/R组大鼠脑组织中蛋白SUMO化水平增加,SUMO2/3蛋白表达增强(P<0.01),而LMWH干预后脑组织中蛋白SUMO化水平进一步增加,SUMO2/3蛋白表达进一步增强(P<0.01)。说明LMWH在脑缺血再灌注早期可能会上调蛋白SUMO化水平,提高SUMO2/3蛋白的表达(图 4)。
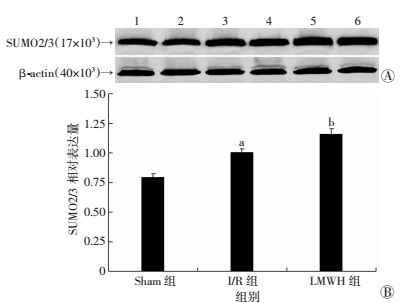
|
| A:Western blot检测结果1、2:Sham组;3、4:I/R组;5、6:LMWH组;B:半定量分析(n=5) a: P<0.01, 与Sham组比较; b: P<0.01, 与I/R组比较 图 4 Western blot检测各组SUMO2/3蛋白表达的变化趋势 |
2.6 LMWH促进脑缺血再灌注大鼠神经元细胞SUMO2/3的核内移
再灌注3 h后,与Sham组相比,I/R组大鼠脑组织中蛋白SUMO2/3水平增加,出现核内移现象,并且主要发生在神经元细胞内。而LMWH干预后发生SUMO2/3核内移现象的神经元细胞进一步增多。Sham组、I/R组、LMWH组SUMO2/3阳性细胞占比(%)分别为(12.51±4.53)、(54.78±6.22)、(87.12±5.31),LMWH组与I/R组比较,差异有统计学意义(P<0.01)。说明LMWH在脑缺血再灌注早期在提高SUMO2/3蛋白表达的同时,还有效地促进了其在神经元细胞内向核的转移(图 5、6)。
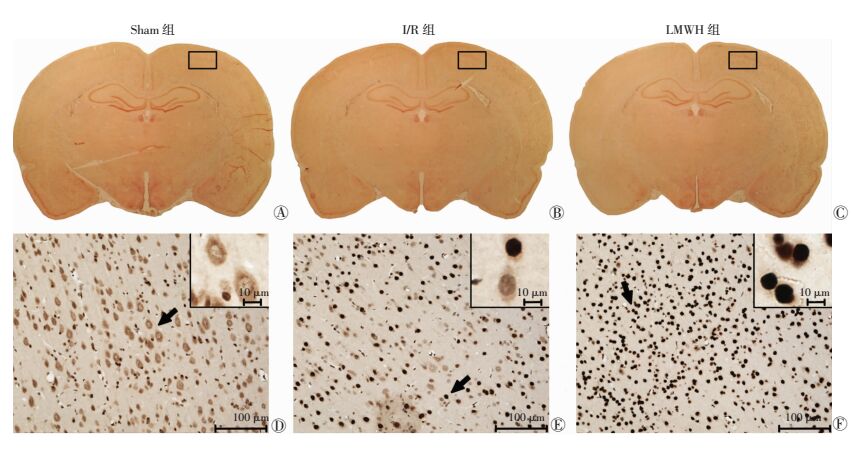
|
| A~C:各组全脑显示,框选区域所示为梗侧大脑皮层的梗死边缘区;D~F:各组免疫组化检测结果(SABC ×200),为框选区域的局部放大图,其中箭头所示为SUMO2/3蛋白表达的细胞,右上角为箭头所示细胞的放大显示图;Sham组显示SUMO2/3蛋白仅表达于细胞质中,而I/R组和LMWH组显示SUMO2/3蛋白大量表达于细胞核,且LMWH组核内表达更多 图 5 免疫组化检测各组SUMO2/3蛋白细胞定位及核内移的变化趋势 |
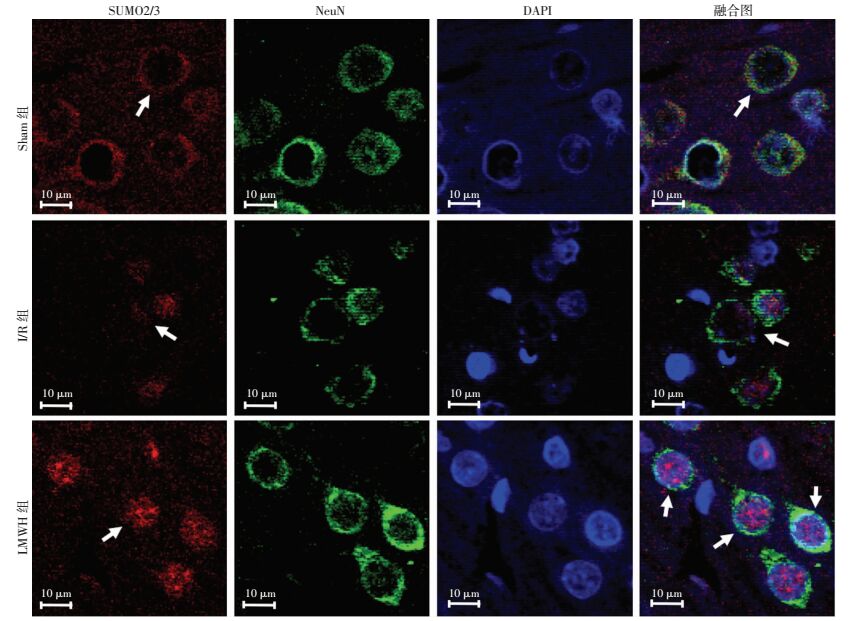
|
| 箭头示SUMO2/3蛋白表达的神经元细胞,Sham组显示SUMO2/3蛋白表达于细胞质中,而I/R组和LMWH组显示SUMO2/3蛋白转移入细胞核内,且LMWH组核内移现象更多 图 6 激光共聚焦显微镜观察各组SUMO2/3蛋白在神经元细胞发生核内移的变化趋势 |
3 讨论
LMWH抑制NF-κB活化,降低炎症因子生成,通过抗炎表现出脑保护效应,这为其在缺血性脑卒中对CIRI的治疗提供了现象依据。尽管近年来对此的研究取得了很多进展,但大多数都仅停留在现象研究上,对于调节过程的具体环节一直少有研究报道。而在CIRI研究领域,近年来发现蛋白的SUMO化修饰能够提高脑缺血耐受性,对损伤周围组织神经元有保护作用[6],且主要效应蛋白为SUMO2/3。并且Yang等[10-12]进一步研究发现短暂脑缺血后顶叶皮层、海马区和纹状体的缺血边缘区SUMO2/3均反应性增加,但以顶叶皮层增加最为显著,海马区其次,纹状体最少。且相比缺血,再灌注过程对SUMO2/3升高更关键。再灌注开始后SUMO2/3即刻升高,1~3 h达高峰,6 h后逐渐下降,24 h后恢复正常水平。SUMO2/3修饰作为NF-κB活化过程的重要调控环节,其是否在LMWH调节NF-κB活化及炎症因子表达中发挥中间环节作用?对此问题,本研究进行了实验探索。本研究以炎症因子IL-1β的生成以及NF-κB的活化为切入点,重点关注了在CIRI中LMWH干预对SUMO2/3的影响。取脑缺血再灌注大鼠梗死边缘区的顶叶皮层,对各相关蛋白在对应时间点进行Western blot、免疫组化及免疫荧光检测,探索LMWH对SUMO2/3蛋白的表达及细胞内核质转移的影响。研究结果显示,LMWH能够有效缓解MCAO大鼠脑梗死程度,有效降低炎症因子生成以及NF-κB的活化,与Quartermain等[1-3]的研究相一致。同时,Western blot、免疫组化及免疫荧光检测发现在脑缺血再灌注早期使用LMWH会进一步提高SUMO2/3蛋白的表达,促进其在神经元细胞内由质向核的转移,增强下游抑制NF-κB P65活化及IL-1β生成的脑保护效应。这一结果提示了LMWH在大鼠CIRI模型中抑制NF-κB活化减少炎症因子生成的调节作用可能与其能够促进SUMO2/3表达及核内移效应有关。
综上所述,本研究提出LMWH抑制脑缺血再灌注大鼠NF-κB活化降低炎症因子生成过程可能涉及SUMO2/3调节环节,并认为SUMO2/3可能作为低分子肝素抗炎效应的潜在靶点。这可能会对LMWH脑保护作用提出新的解释,同时也是对LMWH抗炎机制新的补充,可以为其应用于缺血性脑卒中防治再灌注损伤提供理论依据和实验支撑。同时在药物干预影响新靶点SUMO2/3的研究领域,本研究为脑血管疾病的药物防治拓展新途径奠定了理论和实验基础。但有限的是本研究目前仅初步阐释了LMWH促进SUMO2/3表达及核内移现象,至于其如何影响SUMO2/3的变化没有做进一步探索。下一步我们将对SUMO2/3修饰过程的关键性酶UBC9和SENP3与LMWH的关系进行深入研究,并通过抑制性实验探索抑制SUMO2/3对LMWH发挥抗炎作用的影响。
| [1] | Quartermain D, Li Y S, Jonas S. The low molecular weight heparin enoxaparin reduces infarct size in a rat model of temporary focal ischemia[J]. Cerebrovasc Dis, 2003, 16(4): 346–355. DOI:10.1159/000072556 |
| [2] | Stutzmann J M, Mary V, Wahl F, et al. Neuroprotective profile of enoxaparin, a low molecular weight heparin, in in vivo models of cerebral ischemia or traumatic brain injury in rats: a review[J]. CNS Drug Rev, 2002, 8(1): 1–30. DOI:10.1111/j.1527-3458.2002.tb00213.x |
| [3] | Stephenson D, Yin T, Smalstig E B, et al. Transcription factor nuclear factor-kappa B is activated in neurons after focal cerebral ischemia[J]. J Cereb Blood Flow Metab, 2000, 20(3): 592–603. DOI:10.1097/00004647-200003000-00017 |
| [4] | Zhao D, Ding R, Mao Y, et al. Heparin rescues sepsis-associated acute lung injury and lethality through the suppression of inflammatory responses[J]. Inflammation, 2012, 35(6): 1825–1832. DOI:10.1007/s10753-012-9503-0 |
| [5] | Li X, Zheng Z, Li X, et al. Unfractionated heparin inhibits lipopolysaccharide-induced inflammatory response through blocking p38 MAPK and NF-κB activation on endothelial cell[J]. Cytokine, 2012, 60(1): 114–121. DOI:10.1016/j.cyto.2012.06.008 |
| [6] | Lee Y J, Hallenbeck J M. SUMO and ischemic tolerance[J]. Neuromolecular Med, 2013, 15(4): 771–781. DOI:10.1007/s12017-013-8239-9 |
| [7] | Aillet F, Lopitz-Otsoa F, Egaña I, et al. Heterologous SUMO-2/3-ubiquitin chains optimize IκBα degradation and NF-κB activity[J]. PLoS ONE, 2012, 7(12): e51672. DOI:10.1371/journal.pone.0051672 |
| [8] | Huang W, Xu L, Zhou X, et al. High glucose induces activation of NF-κB inflammatory signaling through IκBα sumoylation in rat mesangial cells[J]. Biochem Biophys Res Commun, 2013, 438(3): 568–574. DOI:10.1016/j.bbrc.2013.07.065 |
| [9] | Garcia J H, Wagner S, Liu K F, et al. Neurological deficit and extent of neuronal necrosis attributable to middle cerebral artery occlusion in rats. Statistical validation[J]. Stroke, 1995, 26(4): 627–634. DOI:10.1161/01.str.26.4.627 |
| [10] | Datwyler A L, Lättig-Tünnemann G, Yang W, et al. SUMO2/3 conjugation is an endogenous neuroprotective mechanism[J]. J Cereb Blood Flow Metab, 2011, 31(11): 2152–2159. DOI:10.1038/jcbfm.2011.112 |
| [11] | Wang L, Ma Q, Yang W, et al. Moderate hypothermia induces marked increase in levels and nuclear accumulation of SUMO2/3-conjugated proteins in neurons[J]. J Neurochem, 2012, 123(3): 349–359. DOI:10.1111/j.1471-4159.2012.07916.x |
| [12] | Iwabuchi M, Sheng H, Thompson J W, et al. Characterization of the ubiquitin-modified proteome regulated by transient forebrain ischemia[J]. J Cereb Blood Flow Metab, 2014, 34(3): 425–432. DOI:10.1038/jcbfm.2013.210 |



