结肠癌是常见的消化道恶性肿瘤之一,其发病率逐年上升[1]。恶性肿瘤的生长需要充足的营养和能量供应,在正常细胞向恶性肿瘤细胞转化的过程中常伴随着能量代谢途径的重编程,包括糖酵解、谷氨酸依赖的合成代谢和脂质生成等[2]。20世纪初,Warburg首次提出大多数肿瘤细胞即使在氧气充足的情况下仍然优先选择利用糖酵解作为主要的产能方式去满足其快速增殖的能量需求。这种能量代谢的重编程可能是导致肿瘤的重要原因。丙酮酸脱氢酶复合物(pyruvate dehydrogenase complex,PDC)的活性抑制是启动肿瘤细胞Warburg代谢的重要分子事件[3]。PDC是一种位于线粒体基质内催化丙酮酸脱羧反应的多酶复合体,可催化丙酮酸转化成乙酰辅酶A。PDC作为细胞内有氧氧化的限速酶,是连接糖酵解与脂代谢、糖异生及三羧酸循环的重要媒介。在高等生物体内,PDC的活性主要受丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinase,PDK)和磷酸激酶实行磷酸化和去磷酸化调控。PDK是PDC的重要负性调节因子,能磷酸化PDC蛋白抑制其活性[4],PDK蛋白的异常表达和调控在肿瘤发生、发展过程中的作用越来越受到重视[5-6]。研究表明,在肿瘤组织中抑制PDK的表达后,促进三羧酸循环,导致NFAT、HIF1α等促增殖因子活性降低,p53等肿瘤抑制蛋白的活性增强,从而抑制肿瘤的转移和增殖[7]。在哺乳动物中PDK存在4种异构体PDK1、PDK2、PDK3和PDK4,PDK1主要在心脏中表达,PDK2在多种组织广泛表达,PDK3主要在睾丸中表达,PDK4主要在骨骼肌、肝脏、肾脏等具有高度的脂肪酸氧化能力和高表达脂质氧化转录因子PPARα或者PPARγ的组织中高丰度表达[3]。其中PDK4已被证实是PDC调控物质代谢的中心[8-9]。目前,PDK4在结肠癌组织中的表达及其与结肠癌临床预后的关系尚不明确。因此,本研究采用组织芯片及免疫组化染色的方法检测PDK4蛋白在结肠癌组织及癌旁肠黏膜组织中的表达情况,并对检测结果及临床病理参数进行统计分析,初步探讨PDK4的临床意义。
1 资料与方法 1.1 临床标本收集第三军医大学西南医院2005-2010年经外科手术切除并经病理证实的结肠癌标本172例,均为结肠腺癌,其中86例标本包含癌旁结肠黏膜组织(距肿瘤边缘3 cm以内)。172例中男性90例,女性82例,年龄为27~90岁,平均65岁。根据AJCC/TNM分期法进行手术病理分期,其中Ⅰ期22例,Ⅱ期88例,Ⅲ期56例,Ⅳ期6例。标本经常规脱水、4%多聚甲醛固定、石蜡包埋后,制成5 μm厚切片供定位染色。172例组织标本由病理医师做病理学诊断并标记癌组织、癌旁结肠黏膜组织部位。在切片上典型位置做好标志后将相应供体蜡块对应部位确定为取材位点。将空白受体蜡块上对应位置用微阵列仪打孔(深度0.2~ 0.3 cm,直径约0.1 cm,间距约0.1 cm),在之前标记好的供体蜡块上采用组织芯片制作仪器(美国Beecher公司)制作结肠癌组织芯片(采样针直径1.5 mm,组织采样长度约0.8 cm),轻轻推动金属内芯,将组织蜡芯放在受体蜡块对应的小孔上,并准确记录阵列中每个样本所在的确切微阵,每例结肠癌组织采取1~2个位点,重复上述操作。将组织芯片蜡块排列好后向下置于55 ℃恒温铜板上30 min,然后将其嵌入至另一蜡块,待蜡块与组织芯片融合之后,重复上述步骤。共制作蜡块3个, 包含172例结肠癌组织和86例癌旁肠黏膜组织,分别标记为1、2、3。待蜡块变硬后切片。
1.2 试剂兔多克隆抗体PDK4(Abcam,ab71240),免疫组化染色试剂盒(SP-9001,北京中杉金桥公司),DAB试剂盒(ZLI-9017,北京中杉金桥公司),EDTA缓冲液(ZLI-9069,北京中杉金桥公司),中性树胶(G8590,Solarbio公司)。
1.3 实验方法采用免疫组化染色,按S-P法检测步骤严格进行操作:石蜡组织芯片经常规60 ℃烤片、脱蜡、水化;3%过氧化氢室温孵育10 min;EDTA缓冲液高温抗原修复15 min;山羊血清室温封闭20 min后滴加PDK4一抗(浓度为1 :500),放入湿盒中,室温孵育1 h后,4 ℃冰箱孵育过夜;次日取出湿盒于室温下复温,滴加二抗室温孵育20 min;辣根酶标记链霉卵白素室温孵育20 min;DAB工作液显色40 s;苏木精复染细胞核24 s;温水反蓝10 min;脱水;风干后中性树胶封片。
1.4 结果判定参照上海医科大学病理教研室许良中等[10]关于免疫组织化学反应结果的判断标准,PDK4免疫组化染色主要定位于细胞浆,偶可见于细胞核和细胞膜,阳性呈棕黄色或棕褐色颗粒。结果采用半定量的方法,根据各染色强度和阳性细胞数百分比计分:无任何黄色、淡黄色、棕黄色、深棕褐色分别记为0、1、2、3分;阳性细胞数百分比0%、10%及以下、11%~50%、51%~ 75%、75%以上分别记为0、1、2、3、4分。染色强度强弱与阳性细胞百分比得分相乘,0~6分为低表达,7~12分为高表达。
1.5 统计学分析采用SPSS 17.0统计软件,计量资料正态分布以x±s表示,采用t检验;计数资料采用χ2检验;PDK4蛋白表达与结肠癌患者术后生存时间的关系采用Kaplan-Meier生存分析;采用COX比例风险回归模型进行多因素分析。检验水准α=0.05。
2 结果 2.1 结肠癌组织及癌旁肠黏膜组织PDK4蛋白的表达经免疫组化染色显色证实,PDK4蛋白的表达以细胞胞浆表达为主,偶可见于细胞核和细胞膜,呈灶状和弥漫性分布(图 1)。在172例结肠癌组织标本中有98例PDK4蛋白为高表达,占总例数的57.0%,86例癌旁肠黏膜组织标本中有23例PDK4蛋白为高表达,占总例数的26.7%,二者之间表达差异有统计学意义(P < 0.01),即PDK4在癌旁肠黏膜组织标本中低表达或表达缺失,而在结肠癌组织标本中高表达。
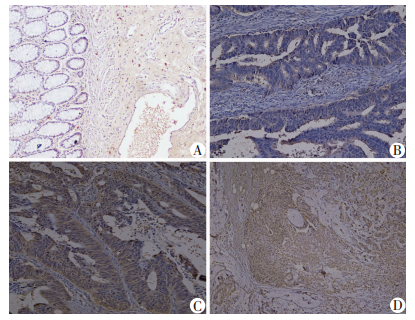
|
| A:癌旁肠黏膜;B:高分化;C:中分化;D:低分化 图 1 PDK4在不同临床分期结肠癌标本和正常肠黏膜中的表达(S-P×100) |
2.2 PDK4蛋白表达与结肠癌患者临床病理参数的关系
结肠癌组织标本中PDK4蛋白表达显著高于癌旁肠黏膜组织(P < 0.01)。PDK4蛋白高表达与肿瘤分化程度(P < 0.01)、临床分期(P < 0.01)、淋巴结转移(P < 0.01) 及患者预后(P < 0.01) 密切相关,即PDK4蛋白表达越高,结肠癌分化程度越低,临床分期越晚,越易发生淋巴结转移,预后越差;但与患者性别、年龄、肿瘤位置、肿瘤最大径等无明显关系(P>0.05,表 1)。
| 临床病理参数 | n | PDK4的表达[例(%)] | P值 | |
| 低表达 | 高表达 | |||
| 癌旁肠黏膜 | 86 | 63(73.3) | 23(26.7) | < 0.001 |
| 癌组织 | 172 | 74(43.0) | 98(57.0) | |
| 年龄(岁) | ||||
| < 60 | 56 | 18(32.1) | 38(67.9) | 0.620 |
| ≥60 | 116 | 56(48.3) | 60(51.7) | |
| 性别 | ||||
| 男 | 90 | 44(48.9) | 46(51.1) | 0.471 |
| 女 | 82 | 30(36.6) | 52(63.4) | |
| 肿瘤最大径(cm) | ||||
| ≤5 | 94 | 42(44.7) | 52(55.3) | 0.081 |
| > 5 | 78 | 32(41.0) | 46(59.0) | |
| 肿瘤位置 | ||||
| 右半结肠 | 76 | 26(34.2) | 50(65.8) | 0.222 |
| 左半结肠 | 96 | 48(50.0) | 48(50.0) | |
| 分化程度 | ||||
| 高分化 | 38 | 30(78.9) | 8(21.1) | < 0.001 |
| 中分化 | 106 | 38(35.8) | 68(64.2) | |
| 低分化 | 28 | 6(21.4) | 22(78.6) | |
| 淋巴结转移 | ||||
| 无 | 114 | 58(50.9) | 56(49.1) | < 0.001 |
| 有 | 58 | 16(27.6) | 42(72.4) | |
| T分期 | ||||
| T1 | 4 | 2(50.0) | 2(50.0) | 0.010 |
| T2 | 20 | 10(50.0) | 10(50.0) | |
| T3 | 96 | 46(47.9) | 50(52.1) | |
| T4 | 52 | 16(30.8) | 36(69.2) | |
| N分期 | ||||
| N0 | 114 | 58(50.9) | 56(49.1) | < 0.001 |
| N1 | 58 | 16(27.6) | 42(72.4) | |
| M分期 | ||||
| M0 | 166 | 72(43.4) | 94(56.6) | 0.541 |
| M1 | 6 | 2(33.3) | 4(66.7) | |
| 临床分期 | ||||
| Ⅰ | 22 | 12(54.5) | 10(45.5) | 0.001 |
| Ⅱ | 88 | 44(50.0) | 44(50.0) | |
| Ⅲ | 56 | 16(28.6) | 40(71.4) | |
| Ⅳ | 6 | 2(33.3) | 4(66.7) | |
| 预后 | ||||
| 生存 | 98 | 56(57.1) | 42(42.9) | 0.006 |
| 死亡 | 74 | 18(24.3) | 56(75.7) | |
2.3 PDK4蛋白表达与结肠癌患者术后生存时间的关系
对172例结肠癌组织中PDK4蛋白表达与患者术后生存时间进行Kaplan-Meier生存分析,结果见图 2。在结肠癌患者中,PDK4蛋白高表达组与低表达组结肠癌患者的生存曲线分布差异有统计学意义(P < 0.01),表现为PDK4高表达患者的生存时间显著低于PDK4低表达患者生存时间[(44.824±3.151) 个月vs (68.672±1.755) 个月,P < 0.01]。进一步将患者按照临床分期、分化程度、肿瘤最大径、是否发生淋巴结转移分组后进行生存分析,发现在临床分期Ⅰ、Ⅱ期(P=0.01),无淋巴结转移(P < 0.01),有淋巴结转移(P < 0.05),肿瘤最大径>5 cm(P < 0.01),高分化(P < 0.01) 及低分化(P < 0.01) 的结肠癌患者中PDK4的高表达组与低表达组的生存曲线分布差异有统计学意义,表现为PDK4高表达组的结肠癌患者术后生存时间显著低于PDK4低表达组的患者;而在临床分期Ⅲ、Ⅳ期(P=0.075) 及肿瘤最大径≤5 cm(P=0.396) 的结肠癌患者中,PDK4高表达组与低表达组的生存曲线分布差异无统计学意义(P>0.05)。表明在临床分期Ⅰ期和Ⅱ期及肿瘤最大径>5 cm的肿瘤患者中PDK4蛋白高表达具有预测不良预后的重要意义。
2.4 COX比例风险回归模型多因素分析应用COX比例风险回归模型进行多因素分析,结果显示结肠癌患者临床分期(P=0.016) 和PDK4蛋白表达(P < 0.01) 对患者术后生存时间有影响,表现为临床高分期和PDK4高表达是结肠癌患者术后生存时间的危险因素(表 2),表明结肠癌的临床分期和PDK4蛋白表达均可作为结肠癌的预后指标。
| 因素 | HR(95% CI) | P值 |
| 男性 | 1.381(0.806~2.105) | 0.186 |
| 年龄 < 60岁 | 0.935(0.560~1.562) | 0.798 |
| 肿瘤位于右半结肠 | 0.675(0.403~1.130) | 0.135 |
| 高分化 | 0.639(0.353~1.158) | 0.140 |
| 临床Ⅲ期和Ⅳ期 | 0.354(0.127~0.982) | 0.016 |
| 无淋巴结转移 | 1.014(0.383~2.686) | 0.987 |
| 肿瘤最大径 > 5 cm | 0.469(0.284~0.774) | 0.123 |
| PDK4蛋白高表达 | 2.917(1.664~5.115) | <0.01 |
3 讨论
肿瘤的发生、发展与能量代谢密切相关,肿瘤细胞代谢异常是肿瘤组织区别于正常组织的重要特征[2]。近年来,研究最深入的是肿瘤细胞内异常的糖代谢途径[11]。PDK作为控制糖酵解和氧化磷酸化途径的关键节点激酶,在肿瘤细胞增殖、迁移等过程中发挥重要作用[3]。肿瘤中持续被激活的生长因子信号通过调控糖酵解途径中PDK的活性,使葡萄糖进入磷酸戊糖通路,促进5-磷酸核糖的产生,为核苷酸辅酶及核苷酸的合成提供原料,并生成大量的NADPH,作为脂质合成代谢的供氢体,这些反应为肿瘤细胞提供大量的中间产物来满足其快速增殖[12]。PDK4作为调节PDC影响糖酵解的重要分子媒介[3],在结肠癌组织中的表达及其与结肠癌发生、发展的关系尚不明确。本研究应用高通量组织芯片及免疫组化技术检测了172例结肠癌组织及86例癌旁肠黏膜组织中PDK4蛋白表达,结果发现PDK4蛋白在癌旁肠黏膜组织中低表达,而在结肠癌组织中高表达;且癌组织内PDK4蛋白表达高低与临床分期、淋巴结转移、分化程度及预后显著相关,与患者性别、年龄、肿瘤位置、肿瘤最大径等无明显关系(表 1)。生存分析结果提示PDK4蛋白高表达的结肠癌患者术后生存时间低于PDK4蛋白低表达患者,并且这种差异在临床分期Ⅰ和Ⅱ期或者肿瘤最大径>5 cm的结肠癌患者中尤为明显(图 2)。这种分组后的差异可能是由于PDK4蛋白表达与临床分期、肿瘤最大径、淋巴结转移的相关性导致。COX多因素回归分析显示结肠癌患者的临床分期和PDK4蛋白表达可作为结肠癌的预后指标(表 2)。因此,我们认为PDK4蛋白在结肠癌组织中较癌旁肠黏膜组织中高表达,该蛋白可能参与促进结肠癌的发生、发展。

|
| A:全部患者;B:临床分期Ⅰ期和Ⅱ期;C:临床分期Ⅲ期和Ⅳ期;D:无淋巴结转移;E:有淋巴结转移;F:肿瘤最大径≤5 cm;G:肿瘤最大径>5 cm;H:低分化;I:高分化 图 2 结肠癌患者Kaplan-Meier生存分析 |
目前的观点普遍认为PDK4蛋白表达异常与原癌基因、生长因子及转录因子等密切相关,此外,PDK4还参与了多种细胞信号通路、脂代谢、糖代谢等。近年来有报道PDK4可以受糖皮质激素、胰岛素、雌激素受体、催乳素/STAT5A、甲状腺素和PPARγ等的调控,进一步影响PDC的活性,导致糖脂代谢紊乱[13-16]。有研究提出PDC/PDK4可作为多种代谢疾病的治疗靶向,通过抑制PDK4,增加PDC活性,抑制糖异生,可为肝源性糖尿病提供治疗思路[17]。相反,上调PDK4后,阻断了丙酮酸生成乙酰辅酶A,脂质合成减少,也可成为治疗肥胖症的靶点[3]。何诗依等[18]发现在低氧刺激下除了HIF-1α通路抑制葡萄糖有氧代谢外,还存在着HIF-1α-EERα/PDK4信号通路;Park等[15]证实PDK4可作为炎症和脓毒症的治疗靶点;王喆等[4]表明PDK4可以作为肿瘤治疗的潜在靶点;Kim等[19]证明PDK4蛋白在胶质母细胞瘤中较正常组织中高表达,抑制裸鼠体内PDK4蛋白表达后,移植瘤的生长减少;Liu等[20]的实验结果与Kim等[19]的实验结果类似,并证明了PDK4蛋白受抑制的荷瘤小鼠无瘤生存率增加。本研究结果也提示PDK4在结肠癌中发挥促癌因子的作用,参与促进结肠癌的发生、发展,这也与Grassian等[6]的研究结果相似。
综上所述,本研究显示,PDK4蛋白在结肠癌组织中表达高于癌旁肠黏膜组织,可能参与促进结肠癌的发生、发展。今后我们将进行更深入的研究,扩大临床样本量来检测在结肠癌组织中PDK4 mRNA及蛋白水平的表达,并通过体外细胞实验及体内动物实验,进一步明确PDK4与结肠癌发生、发展的关系及具体的分子调控机制,以期证实PDK4能否作为临床治疗结肠癌的一个潜在靶点,为结肠癌的临床治疗提供新的途径。
| [1] | Siegel R L, Miller K D, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65(1): 5–29. DOI:10.3322/caac.21254 |
| [2] | Ward P S, Thompson C B. Metabolic reprogramming: a cancer hallmark even warburg did not anticipate[J]. Cancer Cell, 2012, 21(3): 297–308. DOI:10.1016/j.ccr.2012.02.014 |
| [3] |
吴淑超. 丙酮酸脱氢酶激酶抑制剂的筛选及抗肿瘤作用研究[D]. 南昌: 南昌大学医学院, 2014.
Wu S C.Pyruvate Dehydrogenase Kinase Inhibitions Discovery and Antitumor Studies[D].Nanchang: Medical College of Nanchang University, 2014. |
| [4] |
王喆, 袁禧先, 赵璐, 等. 糖皮质激素和胰岛素对人肝癌细胞株丙酮酸脱氢酶激酶4在转录水平上的调节[J].
中国糖尿病杂志, 2010, 18(10): 790–792.
Wang Z, Yuan X X, Zhao L, et al. Effect of dexamethason and insulin on the regulation of transcriptional activity of pyruvate dehydrogenase kinase-4 gene in HepG2[J]. Chin J Diabetes, 2010, 18(10): 790–792. DOI:10.3969/j.issn.1006-6187.2010.10.019 |
| [5] | Contractor T, Harris C R. p53 negatively regulates transcription of the pyruvate dehydrogenase kinase Pdk2[J]. Cancer Res, 2012, 72(2): 560–567. DOI:10.1158/0008-5472.CAN-11-1215 |
| [6] | Grassian A R, Metallo C M, Coloff J L, et al. Erk regulation of pyruvate dehydrogenase flux through PDK4 modulates cell proliferation[J]. Genes Dev, 2011, 25(16): 1716–1733. DOI:10.1101/gad.16771811 |
| [7] | Sutendra G, Michelakis E D. Pyruvate dehydrogenase kinase as a novel therapeutic target in oncology[J]. Front Oncol, 2013, 3: 38. DOI:10.3389/fonc.2013.00038 |
| [8] | Abounader R, Laterra J. Scatter factor/hepatocyte growth factor in brain tumor growth and angiogenesis[J]. Neuro Oncol, 2005, 7(4): 436–451. DOI:10.1215/S1152851705000050 |
| [9] | Herbst E A, Dunford E C, Harris R A, et al. Role of pyruvate dehydrogenase kinase 4 in regulating PDH activation during acute muscle contraction[J]. Appl Physiol Nutr Metab, 2012, 37(1): 48–52. DOI:10.1139/h11-136 |
| [10] |
许良中, 杨文涛. 免疫组织化学反应结果的判断标准[J].
中国癌症杂志, 1996, 6(4): 229–231.
Xu L Z, Yang W T. Criteria for judging the results of immunohistochemistry[J]. China Oncology, 1996, 6(4): 229–231. |
| [11] | Schulze A, Harris A L. How cancer metabolism is turned for proliferation and vulnerable to disruption[J]. Nature, 2012, 491(7424): 364–373. DOI:10.1038/nature11706 |
| [12] | Lunt S Y, Vander Heiden M G. Aerobic glycolysis: meeting the metabolic requirements of cell proliferation[J]. Annu Rev Cell Dev Biol, 2011, 27: 441–464. DOI:10.1146/annurev-cellbio-092910-154237 |
| [13] | Dixit D, Ahmad F, Ghildiyal R, et al. CK2 inhibition induced PDK4-AMPK axis regulates metabolic adaptation and survival responses in glioma[J]. Exp Cell Res, 2016, 344(1): 132–142. DOI:10.1016/j.yexcr.2016.03.017 |
| [14] | Zhang X, Wu J, Choiniere J, et al. Arsenic silences hepatic PDK4 expression through activation of histone H3K9 methylatransferase G9a[J]. Toxicol Appl Pharmacol, 2016, 304: 42–47. DOI:10.1016/j.taap.2016.05.015 |
| [15] | Park H, Jeoung N H. Inflammation increases pyruvate dehydrogenase kinase 4 (PDK4) expression via the Jun N-Terminal Kinase (JNK) pathway in C2C12 cells[J]. Biochem Biophys Res Commun, 2016, 469(4): 1049–1054. DOI:10.1016/j.bbrc.2015.12.113 |
| [16] | Hsieh M C, Das D, Sambandam N, et al. Regulation of the PDK4 isozyme by the Rb-E2F1 complex[J]. J Biol Chem, 2008, 283(41): 27410–27417. DOI:10.1074/jbc.M802418200 |
| [17] | Sugden M C, Holness M J. Mechanisms underlying regulation of the expression and activities of the mammalian pyruvate dehydrogenase kinases[J]. Arch Physiol Biochem, 2006, 112(3): 139–149. DOI:10.1080/13813450600935263 |
| [18] |
何诗依, 陈婷, 孙海洋, 等. 不同低氧暴露时间对小鼠骨骼肌ERRα/PDK4调节的影响[J].
体育科学, 2014, 34(2): 75–78.
He S Y, Chen T, Sun H Y, et al. Effect of Hypoxia with Different Time on Regulations of ERRα Binding to the PDK4 Promoter in Skeletal Muscle of Mice[J]. China Sport Science, 2014, 34(2): 75–78. DOI:10.3969/j.issn.1000-677X.2014.02.010 |
| [19] | Kim M Y, Koh D I, Choi W I, et al. ZBTB2 increases PDK4 expression by transcriptional repression of RelA/p65[J]. Nucleic Acids Res, 2015, 43(3): 1609–1625. DOI:10.1093/nar/gkv026 |
| [20] | Liu Z, Chen X, Wang Y, et al. PDK4 protein promotes tumorigenesis through activation of cAMP-response element-binding protein (CREB)-Ras homolog enriched in brain (RHEB)-mTORC1 signaling cascade[J]. J Biol Chem, 2014, 289(43): 29739–29749. DOI:10.1074/jbc.M114.584821 |



