肺癌是我国最常见的恶性肿瘤,其发病率和死亡率均位于恶性肿瘤之首[1]。目前,肺癌患者的5年生存率均不足20%,肺癌细胞对化疗及放疗的耐受是肺癌患者低生存率的直接原因[2]。因此,探索肺癌细胞耐药机制,发现潜在药理学靶点,进而逆转肺癌耐药,是提高晚期肺癌患者生存期的重要途径。CA916798是我们在前期研究中发现并证实的肺癌耐药相关基因[3],高表达CA916798基因的肺癌细胞株对多种化疗药物耐药[4];相关机制研究表明:CA916798基因通过PI3K/AKT通路参与肺癌顺铂耐药[5-6],但缺乏临床证据。本研究拟在前期工作的基础上,采用化疗前后的临床肺癌组织标本探索CA916798基因表达与肺癌化疗耐药的关系。
1 资料与方法 1.1 研究对象在2016年3-12月于我科经纤支镜检查确诊的肺癌患者中,选取符合如下纳入标准的患者为研究对象:① 临床病理确诊为肺癌患者,包括肺鳞癌、肺腺癌和小细胞肺癌等;② 非小细胞肺癌患者按WHO临床分期为中晚期肺癌患者,包括ⅢA期、ⅢB期和Ⅳ期患者;③ 首次在本院进行并完成至少2周期化疗;④ 无放疗史;⑤ 无合并其他恶性肿瘤。排除手术治疗肺癌、拒绝治疗中途出院和有院外化疗史者。根据纳入和排除标准,共纳入17例患者作为研究对象。
1.2 方法所有病例采集相应病史及临床资料,纤支镜下收取患者化疗前后相应的肺癌组织,利用CA916798多克隆抗体,采用qRT-PCR和免疫组化的方法检测CA916798 mRNA及蛋白表达。
共收集肺癌患者237例,根据纳入标准,纳入17例患者作为研究对象。17例肺癌患者均接受2个周期规范的前期化疗,前期化疗前后分别采用纤支镜取肺癌组织样本,运用qRT-PCR和免疫组化检测CA916798 mRNA及蛋白的表达。针对前期化疗后病灶稳定(stable disease, SD)的7例患者,应用原化疗方案继续化疗,并随访化疗效果。
1.2.1 qRT-PCR检测采用RNAiso plus试剂盒(日本TaKaRa公司)抽提新鲜肺癌组织总RNA,分光光度计法对RNA进行纯度检测及定量,取1 μL总RNA进行琼脂糖凝胶电泳,检查RNA是否降解。采用逆转录试剂盒GoScriptTM Reverse Transcription System (Promega中国公司)将总RNA合成为cDNA,取1 μL cDNA作为模板采用荧光定量试剂盒SYBR® Premix Ex TaqTM (日本TaKaRa公司)进行qPCR反应,以GAPDH作为内参。CA916798基因上、下游引物:5′-GCTTCCTCCTCAACCTCGTCCT-3′和5′-GTAGCCCAC-TTATCCACCTTCTCC-3′(265 bp)。GAPDH上、下游引物:5′-AAGGTGAAGGTCGGAGTCAAC-3′和5′-GGG-GTCATTGATGGCAACAATA-3′(102 bp)。引物由重庆泽恒生物技术有限公司合成。每个基因设3个复孔,反应结束后,观察扩增曲线及熔解曲线,记录反应管中的荧光信号到达所设定的阈值时所经历的循环数即Ct值,根据Ct值计算目的基因的相对表达量:△Ct=CtCA916798-CtGAPDH,△△Ct =△Ct化疗后-△Ct化疗前。化疗后目的基因mRNA的表达量即为化疗前的2(-△△Ct)倍,定义2(-△△Ct)>1为表达上调,2(-△△Ct)<1为表达下调。
1.2.2 免疫组化检测肺癌标本于10%甲醛中浸泡固定,石蜡包埋,连续3~ 4 μm切片。切片完全浸入pH值为6.0的枸橼酸溶液内,高压、高温修复,一抗CA916798多克隆抗体用磷酸盐缓冲液(PBS)1:200稀释,4 ℃孵育过夜。DAB显色,苏木精复染,封片观察。用预实验得到的阳性反应切片作阳性对照,用PBS代替CA916798一抗作为阴性对照。每例均同时行常规HE染色,由2人采用双盲法对染色结果进行判断计分,观察化疗前后肺癌组织中CA916798蛋白的阳性表达差异。CA916798蛋白阳性表达反应为棕黄色,位于细胞质内; 光学显微镜(×400) 下随机观察5个高倍镜视野细胞的阳性率。以阳性细胞百分率作为最终判定标准:阳性细胞数<10%为阴性,10%~25%为+,>25%~75%为++,>75%为+++。
1.3 治疗方案本研究中入院患者均按照肺癌诊治指南的规范进行规范化疗,非小细胞肺癌中紫杉醇脂质体联合铂类方案8例;吉西他滨联合顺铂方案(GP)1例,多西他赛联合顺铂方案(TP)1例;小细胞肺癌中伊立替康联合铂类方案7例。
1.4 化疗疗效判定及分组参照WHO实体瘤近期疗效评价标准[7],疗效分为完全缓解(complete response, CR),指所有已知病灶消失并保持最少4周;部分缓解(partial response, PR),指肿瘤双径乘积之和减少50%,并保持至少4周;疾病进展(progressive disease, PD),指双径乘积之和增加25%或出现新病灶;其余病情为病灶稳定(SD)。本研究中定义CR+PR为化疗有效,纳入化疗有效组;SD+PD为化疗无效,纳入化疗无效组。
1.5 统计学分析采用SPSS 19.0统计软件。计量资料两组间比较采用t检验或Mann-Whitney U非参数检验;计数资料采用χ2检验,P<0.05为差异具有统计学意义。
2 结果 2.1 一般人口学特征及组间均衡性检验本研究共纳入17例肺癌患者,年龄为(59.88±7.62) 岁。经过入院前期化疗,10例患者病灶完全缓解(CR)或部分缓解(PR),有效率为58.82%,纳入前期化疗有效组;7例患者病灶趋于稳定(SD),纳入前期化疗无效组(图 1)。患者的年龄、性别、组织学类型、肿瘤最大径在两组间均衡分布,差异无统计学意义(P>0.05,表 1)。
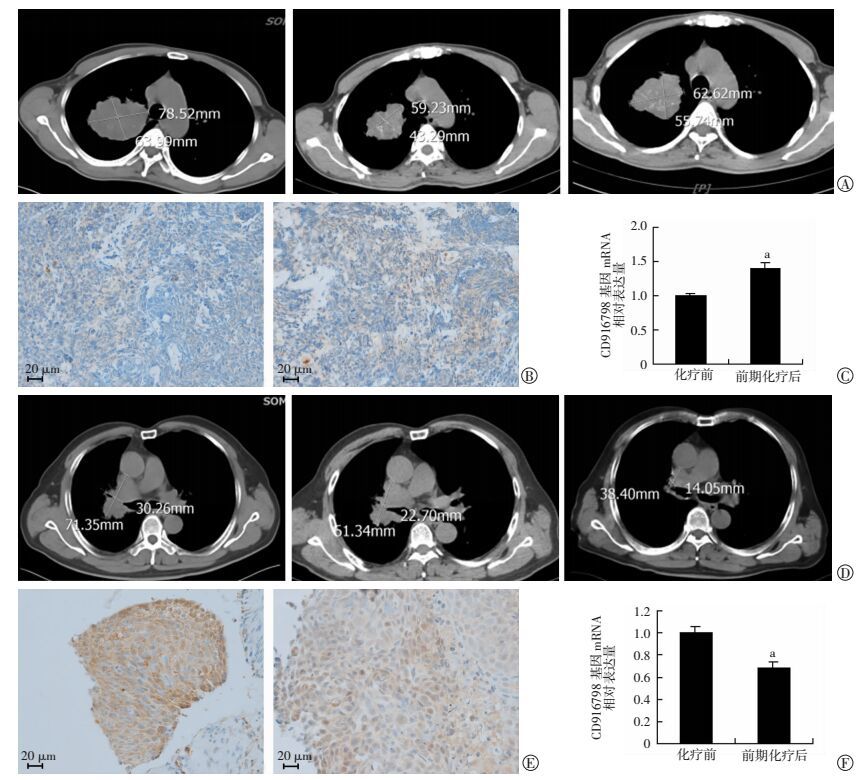
|
| A~C:患者1; D~F:患者2;A、D:患者随访CT表现左、中、右分别为化疗前、前期化疗后和继续化疗后;B、E:免疫组化观察化疗前(左)和前期化疗后(右)肺癌组织中CA916798蛋白表达(S-P);C、F:qRT-PCR检测肺癌组织中CA916798基因mRNA表达a:P<0.01,与化疗前比较 图 1 2例代表性患者的随访CT表现及肺癌组织中CA916798蛋白、mRNA的表达 |
| 组别 | n | 年龄(岁,x±s) | 性别[例(%)] | 组织学类型[例(%)] | 肿瘤最大径>(mm,x±s) | ||
| 男性 | 女性 | 非小细胞肺癌 | 小细胞肺癌 | ||||
| 前期化疗有效组 | 10 | 59.30±8.34 | 8(80.00) | 2(20.00) | 4(40.00) | 6(60.00) | 53.98±11.83 |
| 前期化疗无效组 | 7 | 60.71±7.02 | 7(100.00) | 0(0.00) | 6(85.71) | 1(14.29) | 60.68±0.86 |
| P值 | 0.719 | 0.485a | 0.134a | 0.556b | |||
| a:样本量小于40,采用四格表Fisher精确概率法计算P值;b:肿瘤最大径数据方差不齐,采用Mann-Whitney U检验方法计算P值 | |||||||
2.2 前期化疗前后肺癌组织中CA916798基因mRNA表达的变化
10例化疗有效组中,1例患者(10.00%)CA916798基因表达上调,9例(90.00%)下调;7例化疗无效组中,5例患者(71.43%)出现表达上调,2例(28.47%)下调。两组比较差异具有统计学意义(P=0.035)。
2.3 前期化疗前后肺癌组织中CA916798基因蛋白表达变化前期化疗前,化疗无效组和化疗有效组CA916798蛋白表达阳性率差异无统计学意义(P>0.05);前期化疗后,化疗无效组CA916798蛋白的表达阳性率[7/7(100%)]高于化疗有效组[4/10(40.00%), P<0.05]。在CA916798蛋白表达变化趋势方面,前期化疗无效组蛋白表达上调比例显著高于化疗有效组(P<0.05),并且与mRNA表达一致(表 2)。
| 组别 | n | 化疗前蛋白表达a | 化疗后蛋白表达a | 化疗后蛋白表达相对变化趋势b | ||||
| + | - | + | - | 表达上调 | 表达下调 | 不变 | ||
| 前期化疗有效组 | 10 | 9(90.00) | 1(10.00) | 4(40.00) | 6(60.00) | 0(0.00) | 9(90.00) | 1(10.00) |
| 前期化疗无效组 | 7 | 6(85.71) | 1(14.29) | 7(100.00) | 0(0.00) | 5(71.43) | 1(14.29) | 1(14.29) |
| P值 | 1.000c | 0.035c | 0.001 | |||||
| a:将化疗前和化疗后CA916798蛋白表达评分结果“+++、++、+”合并为“+”;b:化疗后CA916798蛋白表达阳性率评分大于化疗前,定义为表达上调;化疗后CA916798蛋白表达阳性率评分小于化疗前,定义为表达下调;化疗前后蛋白表达阳性率评分相同,定义为表达趋势不变;c:由于样本量小于40,故采用四格表Fisher精确概率法计算P值 | ||||||||
2.4 前期化疗后CA916798基因表达趋势对SD患者继续化疗效果的影响
经过2个周期的前期化疗,7例肺癌患者病灶稳定。针对这7例患者,应用原化疗方案继续进行化疗并随访。继续化疗后有2例患者病灶部分缓解,纳入继续化疗有效组;5例患者病灶部分仍趋于稳定甚至出现进展,纳入继续化疗无效组。继续化疗仍然无效的5例患者,CA916798基因mRNA和蛋白表达在前期化疗后均上调,差异有统计学意义(P<0.05,表 3)。具有代表性的患者随访资料见图 1。
| 组别 | n | mRNA表达 | 蛋白表达 | |||
| 上调 | 下调 | 上调 | 下调 | 趋势不变 | ||
| 继续化疗有效组 | 2 | 0(0.00) | 2(100.00) | 0(0.00) | 1(50.00) | 1(50.00) |
| 继续化疗无效组 | 5 | 5(100.00) | 0(0.00) | 5(100.00) | 0(0.00) | 0(0.00) |
| P值 | 0.048a | 0.015 | ||||
| a:由于样本量小于40,故采用四格表Fisher精确概率法计算P值 | ||||||
3 讨论
临床上针对肺癌的治疗方法主要包括手术治疗、化疗和放疗。由于缺乏有效的早期筛查手段,大多数肺癌患者诊断时已经是肺癌晚期,因此,化疗成为最常用的治疗手段[8]。多药耐药(multiolrug resistance, MDR)是指肿瘤细胞长期接触某一化疗药物,产生的不仅对此种化疗药物耐药性,而且可对其他结构和功能不同的多种化疗药物产生交叉耐药性,MDR是引起肺癌化疗失败的重要因素[9]。MDR的产生是一个由多基因参与的复杂事件,尽管目前发现P-gp[10]、GST-π[11]、TOPO Ⅱα[12]等基因与MDR相关,但这些基因并不能完全阐明肺癌MDR的机制。因此,寻找新的肺癌化疗耐药基因, 可以为肺癌的治疗提供新的策略。
CA916798基因是本课题组采用抑制消减杂交技术从人肺腺癌多药耐药细胞系SPC-A-1/CDDP中克隆表达的新基因[13],随后研究发现肺癌组织中CA916798基因的表达显著高于癌旁组织[14];过表达CA916798基因的肺癌细胞能增加肺癌细胞株对顺铂的耐药性,反之,抑制CA916798基因的表达则可部分逆转肺癌细胞株对顺铂的耐药性[3-4];在相关机制研究方面,本课题组发现CA916798基因对顺铂的耐药机制与PI3K/AKT通路有关[5-6]。表明CA916798基因是一个新的顺铂耐药相关基因。目前仍不清楚CA916798基因在肺癌化疗耐药预测中的作用。
本研究中,17例肺癌患者均接受规范的化疗,经过前期1~2周期化疗,10例患者临床效果良好,总有效率为58.82%。不同疗效组中,CA916798基因在mRNA水平的变化趋势显著不同(P<0.05)。前期化疗无效组中,71.43%的患者CA916798基因mRNA表达上调,上调比例显著高于化疗有效组。同样地,在蛋白表达水平,化疗前,CA916798基因蛋白表达阳性率在化疗有效组和化疗无效组间无统计学差异;化疗后,前期化疗无效组CA916798基因蛋白阳性率显著高于化疗有效组。此结果表明:在化疗无效患者中,化疗可诱导CA916798基因表达上调,CA916798基因表达上调与较差的化疗疗效相关。该结果也提示:CA916798基因的表达在肺癌的耐药预测中也可能存在一定的临床价值,例如在肺癌患者进行化疗前进行CA916798基因的mRNA表达检测可能成为预测化疗敏感性的新的参考指标。
临床中于化疗2周期后病灶无明显缩小的SD患者,下一步治疗方案中是选择采取原方案继续化疗还是更换其他新的治疗方案,往往难以抉择。本研究进一步针对前期化疗后病灶稳定的7例SD患者继续进行原方案化疗,并随访观察。结果发现:继续化疗后2例患者临床效果较好,病灶明显缩小;但仍有5例患者对该化疗方案不敏感,病灶无缩小甚至增大。分析继续化疗疗效与前期化疗后CA916798基因表达趋势的关系发现: CA916798基因mRNA与蛋白表达上调的5例患者,继续化疗均无效;CA916798基因mRNA下调的2例患者,经过继续化疗后病灶明显缩小。该结果提示:前期化疗后CA916798基因在肿瘤组织中的表达变化趋势,尤其是mRNA表达变化趋势可作为继续化疗疗效的预测指标。针对前期化疗SD患者,如果CA916798基因经过化疗后表达下调,患者化疗耐药的可能性小,继续化疗可能有效;反之,如果CA916798基因表达上调,则患者可能对化疗耐药,继续化疗可能依然无效,需要更换治疗方案。
本研究存在一定局限性,首先由于符合本研究纳入标准且自愿加入研究的研究对象较少,因此样本量较少。其次,本研究中研究对象的组织学类型较为复杂,包含了非小细胞肺癌(肺腺癌、肺鳞癌)和小细胞肺癌。不同组织类型的肺癌对化疗的敏感性可能不同,尽管组织学类型在两组间均衡分配,但仍有可能对结果造成一定的偏倚,因此,在样本量扩大的基础上,还需针对肺癌不同组织类型进行亚组分析。
综上所述,肺癌患者肺癌组织中CA916798基因的表达变化与化疗效果显著相关,CA916798基因是一个新的化疗耐药相关基因,可能成为预测肺癌化疗敏感性的新的参考指标。
| [1] | Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [2] | Zhang J, Gold K A, Lin H Y, et al. Relationship between tumor size and survival in non-small-cell lung cancer (NSCLC): an analysis of the surveillance, epidemiology, and end results (SEER) registry[J]. J Thorac Oncol, 2015, 10(4): 682–690. DOI:10.1097/JTO.0000000000000456 |
| [3] |
王海晶, 杨和平, 周向东. MDR相关新基因CA916798真核表达载体的构建及其对H446细胞增殖的影响[J].
第三军医大学学报, 2007, 29(24): 2315–2318.
Wang H J, Yang H P, Zhou X D. Construction of eukaryotic expression vector of CA916798 and its effect on proliferation of H446 cells[J]. J Third Mil Med Univ, 2007, 29(24): 2315–2318. DOI:10.3321/j.issn:1000-5404.2007.24.005 |
| [4] | Wang H J, Yang H P, Zhou X D, et al. CA916798 regulates multidrug resistance of lung cancer cells[J]. Asian Pac J Cancer Prev, 2011, 12(12): 3403–3408. |
| [5] | Wang Y L, Zhu B J, Qi Z Z, et al. Akt1 enhances CA916798 expression through mTOR pathway[J]. PLoS One, 2013, 8(5): e62327. DOI:10.1371/journal.pone.0062327 |
| [6] |
祝冰晶, 王宇亮, 罗虎, 等. CA916798基因通过PI3K/AKT通路参与肺癌顺铂耐药[J].
第三军医大学学报, 2013, 35(7): 618–621.
Zhu B J, Wang Y L, Luo H, et al. CA916798 gene is involved in cisplatin resistance in human lung cancer through PI3K/AKT pathway[J]. J Third Mil Med Univ, 2013, 35(7): 618–621. |
| [7] |
陈智伟, 廖美琳, 陈玉蓉, 等. WHO标准和RECIST标准评价肺癌化疗疗效的比较[J].
循证医学, 2004, 4(2): 83–84, 106.
Chen Z W, Liao M L, Chen Y R, et al. Measuring response of chemotherapy in lung cancer:WHO versus RECIST criteria[J]. J Evid-Based Med, 2004, 4(2): 83–84, 106. DOI:10.3969/j.issn.1671-5144.2004.02.011 |
| [8] |
于滨, 于慧, 肖菊香, 等. Fz1基因及多药耐药相关基因在肺癌组织中的表达[J].
广西医学, 2015, 37(11): 1583–1586.
Yu B, Yu H, Xiao J X, et al. Expression of Fz1 gene and multidrug resistance-related genes in lung cancer tissue[J]. Guangxi Med J, 2015, 37(11): 1583–1586. DOI:10.11675/j.issn.0253-4304.2015.11.16 |
| [9] | Li Y, Ma C, Shi X, et al. Effect of nitric oxide synthase on multiple drug resistance is related to Wnt signaling in non-small cell lung cancer[J]. Oncol Rep, 2014, 32(4): 1703–1708. DOI:10.3892/or.2014.3351 |
| [10] | Amiri-Kordestani L, Basseville A, Kurdziel K, et al. Targeting MDR in breast and lung cancer: discriminating its potential importance from the failure of drug resistance reversal studies[J]. Drug Resist Updat, 2012, 15(1-2): 50–61. DOI:10.1016/j.drup.2012.02.002 |
| [11] | Rocha Gda G, Oliveira R R, Kaplan M A, et al. 3β-Acetyl tormentic acid reverts MRP1/ABCC1 mediated cancer resistance through modulation of intracellular levels of GSH and inhibition of GST activity[J]. Eur J Pharmacol, 2014, 741: 140–149. DOI:10.1016/j.ejphar.2014.07.054 |
| [12] | Li Y, Ma C, Shi X, et al. Effect of nitric oxide synthase on multiple drug resistance is related to Wnt signaling in non-small cell lung cancer[J]. Oncol Rep, 2014, 32(4): 1703–1708. DOI:10.3892/or.2014.3351 |
| [13] |
周向东, 刘凌志, 钱桂生, 等. 一条新的人肺腺癌耐药相关基因全长cDNA片段的克隆及序列分析[J].
癌症, 2002, 21(4): 341–345.
Zhou X D, Liu L Z, Qian G S, et al. Cloning and sequence analysis of a new, full length cDNA fragment of drug resistance related gene in human lung adenocarcinoma[J]. Chin J Cancer, 2002, 21(4): 341–345. DOI:10.3321/j.issn:1000-467X.2002.04.002 |
| [14] |
刘凌志, 钱桂生, 周向东. 肺癌耐药相关基因在肺癌组织和肺癌细胞株中的表达[J].
癌症, 2003, 22(2): 171–174.
Liu L Z, Qian G S, Zhou X D. Expression of a new lung cancer drug resistance-related gene in lung cancer tissues and lung cancer cell strains[J]. Chin J Cancer, 2003, 22(2): 171–174. DOI:10.3321/j.issn:1000-467X.2003.02.014 |



