视网膜色素变性(retinitis pigmentosa, RP)是一种遗传性进行性退行性视网膜病变,目前认为RP的发生是由于RPE吞噬感光细胞脱落的外节膜盘的功能下降,致使膜盘在视网膜外层堆积,最终至感光细胞变性死亡[1]。RP目前尚无有效的治疗方法。研究显示间充质干细胞可以通过形成细胞间隧道纳米管(tunneling nanotubes, TNT)向心肌细胞转运线粒体而改善心肌细胞、血管平滑肌细胞、气管上皮细胞等细胞功能[2-5]。目前已有研究证实线粒体功能异常是年龄相关性黄斑变性、糖尿病视网膜病变等视网膜退行性疾病的重要致病因素[6-7],这类眼病的干细胞治疗已进入临床试验阶段[8]。目前尚不清楚干细胞是否通过线粒体转运对视网膜变性RPE细胞发挥治疗作用。本研究主要观察NSCs与视网膜色素变性遗传模型RCS大鼠RPE细胞能否形成TNT结构和线粒体转运方式,以及线粒体转运之后对RPE细胞功能有何影响,为视网膜变性疾病的干细胞治疗提供思路。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级视网膜色素变性遗传模型皇家外科学院(Royal College of Surgeons, RCS)大鼠,鼠龄14 d,4批,每批8~10只,由第三军医大学实验动物中心提供。本研究实验动物的使用和喂养遵循中华人民共和国卫生部令第55号发布的《医学实验动物管理实施细则》和国家科学技术委员会第2号令发布的《实验动物管理条例》。
1.1.2 主要试剂及仪器胎牛血清(fetal bovine serum, FBS)、DMEM/F12细胞培养基(美国Gibco公司);PBS、Hank平衡盐缓冲液(HyClone中国公司);0.25%胰蛋白酶-EDTA、Ⅰ/Ⅳ型胶原酶、Mitotracker-red、Mitotracker-green(美国Lifetechnology公司);RPE65、Bestrophin抗体(美国Abcam公司);细胞凋亡检测试剂盒(美国BD公司);2′, 7′-二氯二氢荧光素二乙酯(2′, 7′-Dichlorofluorescin diacetate,DCFH-DA,美国Sigma公司);Hoechst 33342(美国Lifetechnology公司);细胞周期检测试剂盒(中国跃亚公司);三气细胞培养箱(美国Thermo Fisher公司);BD FACS Calibur流式细胞仪(美国BD Biosciences公司)。
1.2 方法 1.2.1 原代大鼠RPE细胞的分离及培养大鼠RPE细胞原代培养参照改良的Edwards大鼠RPE细胞培养方法[9-10]。大鼠以断颈法处死,无菌条件下摘取眼球,PBS清洗后,Hank液于4 ℃浸泡避光过夜,用混合消化液于37 ℃下消化45 min,消化液含0.1 mmol/L EDTA、0.1%胰蛋白酶和质量分数1%的Ⅰ型胶原酶、1%Ⅳ型胶原酶。去前节后分离神经视网膜,于培养基中用200 μL移液枪轻轻吹打分离RPE细胞。用0.1%胰蛋白酶消化5 min,终止消化,离心弃上清后,加入含体积分数10%FBS的DMEM/F12细胞培养液,接种于细胞培养皿中。在37 ℃、体积分数5%CO2条件下培养,每隔3天换1次液,根据细胞密度7 d后传代,传至第3代用于后续实验。
1.2.2 免疫荧光细胞化学法检测RPE细胞RPE65、Bestrophin蛋白表达将第3代RPE细胞爬片用质量分数为4%多聚甲醛室温固定15 min,PBS洗涤3次,用质量分数0.1%Triton X-100室温下破膜10 min,加入封闭液(体积分数10%山羊血清、质量分数1%牛血清蛋白)室温封闭1 h,分别用兔抗大鼠Bestrophin抗体(1:500)、小鼠抗大鼠RPE65抗体(1:500)4 ℃孵育过夜,再分别用FITC标记的羊抗兔IgG二抗(1:500)、Cy3标记的羊抗鼠IgG二抗(1:500) 室温避光孵育1 h,PBS洗涤3次后,再加Hoechst 33342细胞核染色,PBS洗涤后晾干封片,于共聚焦显微镜下观察并拍照。各组均设未加一抗的阴性对照(PBS代替一抗)。信噪比大于1:5判定为阳性细胞。
1.2.3 细胞线粒体的标记分别用含100 nmol/L线粒体特异性标记物Mitotracker-red及Mitotracker-green的培养液标记RPE细胞与NSCs,37 ℃避光孵育45 min,弃标志液,用Hank平衡盐溶液漂洗5 min,重复5次,将标志液彻底洗净。
1.2.4 细胞间线粒体的交换分别用Mitotracker-green、Mitotracker-red标记RPE细胞和NSCs等量共培养,细胞密度为1×104/cm2,24 h后细胞核用Hoechst标记,于激光扫描共聚焦显微镜下观察并拍摄结果。
1.2.5 流式细胞分选收集共培养48 h的RPE细胞和NSCs,进行流式细胞分选,共培养的细胞按照是否有GFP标记分为阳性和阴性2群,收集GFP阴性的细胞群,将其用于后续实验。
1.2.6 细胞内活性氧水平检测分别收集第3代单独培养的RCS大鼠的RPE细胞和共培养后分选的RPE细胞,用荧光探针DCFH-DA检测细胞内活性氧(reactive oxygen species, ROS)水平。向待测细胞的培养皿中加入1 mL浓度为10 μmol/L的DCFH-DA,37 ℃条件下孵育30 min,用PBS洗3次,消化细胞后离心弃上清,1 mL培养基重悬细胞,计数后调整细胞量为5×105/mL,离心后弃上清,用500 μL PBS重悬,上机检测。
1.2.7 细胞凋亡检测分别收集第3代RCS大鼠的RPE细胞和共培养分选后的RPE细胞,采用Annexin V-FITC和碘化丙啶(PI)双染方法检测细胞凋亡率。将细胞消化成单个细胞,加入1×Binding Buffer将细胞密度调整至1×106/mL,取100 μL加入5 μL Annexin V-FITC和5 μL PI混匀,室温避光孵育抗体15 min,同时设置空白对照和单阳对照,加入400 μL 1×Binding Buffer,上机检测。
1.2.8 细胞周期检测收集第3代RPE细胞和共培养分选后的RPE细胞,用PBS以5×105的密度重悬,取100 μL加入细胞周期检测试剂盒A液(胰蛋白酶等)100 μL室温孵育15 min,加入B液(RNA酶、胰酶抑制剂等)室温孵育15 min,加入细胞周期试剂盒C液(碘化丙啶等)室温下避光孵育20 min,上机检测,每个样本至少收集10 000个细胞,记录激发波长为488 nm处的红色荧光。
1.3 统计学分析采用SPSS 14.0 Statistics统计软件。本研究测量指标的数据资料经Kolmogorov-Smirnov检验呈正态分布,以x±s表示,组间均数经Levene检验方差齐。采用平行分组单因素干预两水平实验设计,均采用独立样本t检验。采用双尾检测法,检验水准:α=0.05。
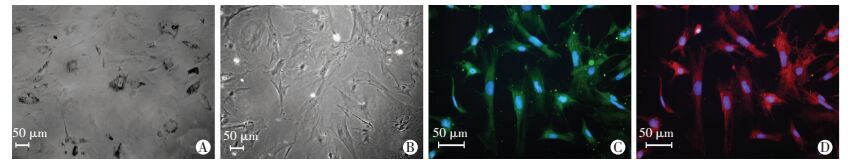
2 结果 2.1 RCS大鼠RPE细胞的鉴定原代分离的RCS大鼠RPE细胞接种后7 d,部分细胞伸展,呈不规则形多边形,色素分布于核周(图 1A)。随着传代数量的增加,细胞质中色素逐渐减少。第3代RPE细胞色素较明显(图 1B),细胞纯度较高,Bestrophin染色阳性率为(92.38±0.05)%(图 1C),RPE65染色阳性率为(92.24±0.03)%(图 1D)。
|
| A:原代RPE细胞培养7 d后,细胞呈多边形,胞内可见色素;B:第3代RPE细胞色素减少,细胞呈不规则多边形;C:第3代RPE细胞对Bestrophin抗体呈现阳性反应,细胞质对FITC呈现绿色荧光,细胞核对Hoechst呈现蓝色荧光;D:第3代RPE细胞对RPE65抗体呈现阳性反应,细胞质对Cy3呈现红色荧光,细胞核对Hoechst呈现蓝色荧光 图 1 原代RPE的培养及鉴定 |
2.2 RPE细胞、NSCs的线粒体标记以及TNT形成和线粒体交换
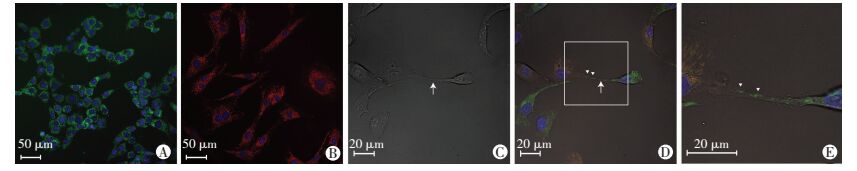
线粒体特异性染料Mitotracker-green标记NSCs细胞后,线粒体标记阳性细胞超过95%(图 2A),Mitotracker-red标记RPE细胞后,线粒体标记阳性细胞超过95%(图 2B);证实线粒体特异性标志Mitotracker-red和Mitotracker-green在该实验条件下标记细胞线粒体满足实验要求。标记Mitotracker-green的NSCs与标记Mitotracker-red的RPE细胞共培养后24 h,明场下可见RPE细胞与NSCs间形成细长的膜性结构(图 2C),即TNT。随着时间的推移,NSCs中呈绿色荧光的线粒体通过TNT进入呈红色荧光的RPE细胞中(图 2D、E)。NSCs与RPE细胞间线粒体呈直线单向转运,符合TNT的特点。
|
| A: mNSC细胞标记线粒体特异性标记物Mitotracker-green后,阳性细胞的线粒体呈绿色;B:RPE细胞标记线粒体特异性标记物Mitotracker-red后, 阳性细胞的线粒体呈红色;C:共培养24 h后,明场下可见RPE细胞与NSCs间形成TNT(↑示);D:NSCs Mitotracker-green标记阳性,RPE细胞Mitotracker-red标记阳性,RPE细胞与NSCs间形成TNT(↑示)中可见绿色标记的NSCs线粒体(△示)从NSCs中向REP细胞转运;E:将图D白色线框区域放大,可见绿色标记的NSCs线粒体(△示)通过TNT从NSCs中向REP细胞转运;红色:线粒体特异性染色剂Mitotracker-red;绿色:线粒体特异性标记液Mitotracker-green;蓝色:Hoechst 33342 图 2 线粒体特异性标记以及TNT形成和线粒体转运 |
2.3 与NSCs共培养前后RPE细胞ROS的变化
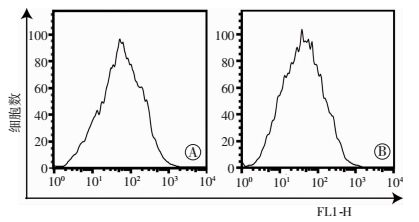
共培养组的ROS荧光强度(73.56±3.49) 明显低于单独培养组(106.00±2.65),差异具有统计学意义(P<0.01,图 3)。提示与NSCs共培养后通过线粒体转运,RPE细胞的抗氧化水平得到改善。
|
| 中文注解 图 3 流式细胞仪检测RCS-RPE单独培养组(A)和RCS-RPE/NSCs共培养组(B) ROS水平(n=3) |
2.4 与NSCs共培养后对RPE细胞周期的影响
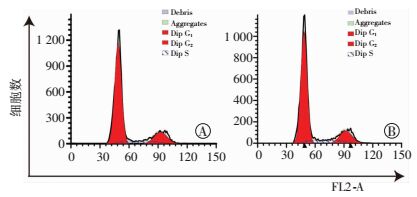
单独培养组RPE细胞与共培养后RPE处于G1期细胞分别为(75.11±0.44)%和(73.36±0.83)%(P=0.010),S期分别为(9.20±0.41)%和(10.28±0.34)%(P=0.007),G2/M期分别为(15.69±0.61)%和(16.34±0.57)%(P=0.169),增殖指数(prolifera-tion index, PI)分别为(24.89±0.38)%和(26.62±0.72)%(P=0.011)。结果显示:与单独培养组相比,共培养组RPE细胞处于S期比例及增殖指数均升高(图 4)。提示与NSCs共培养后通过线粒体转运,RPE细胞的增殖能力增加。
|
| 图 4 流式细胞仪检测RCS-RPE单独培养组(A)及RCS-RPE/NSCs共培养组(B)细胞周期(n=4) |
2.5 与NSCs共培养后对RPE细胞凋亡水平的改变
共培养后早期凋亡细胞比例为(0.82±0.08)%,单独培养组早期凋亡细胞比例为(1.13±0.15)%(P=0.011,图 5)。提示NSCs共培养后通过线粒体转运,RPE细胞的凋亡水平降低。
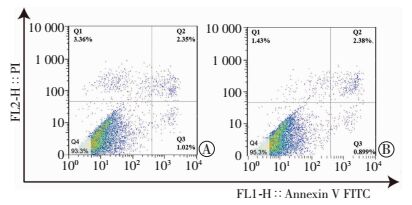
|
| 图 5 流式细胞仪检测RCS-RPE单独培养组(A)和RCS-RPE/NSCs共培养组(B)细胞凋亡(n=4) |
3 讨论
干细胞治疗视网膜变性疾病逐渐成为眼科领域的研究热点之一,其治疗机制有细胞替代、营养支持和移植区微环境的免疫调控作用[11]。已有研究表明间充质干细胞可以通过线粒体转运机制改善心肌细胞、血管平滑肌细胞、气管上皮细胞等细胞功能[2-5]。由此提出假设:干细胞可将自身线粒体转运至视网膜色素变性RPE细胞,并改善其细胞特性。
TNT是Rustom等[12]首次在PC12细胞(大鼠肾上腺髓质嗜铬细胞瘤分化细胞株)之间观察到的一种细胞间的连接结构,是一种新发现的动物细胞间连接形式。本研究通过共聚焦显微镜观察小鼠NSCs与RPE细胞之间TNT的形成,观察到NSCs与RPE细胞之间可形成TNT,为细长的管状结构,连接两相邻但不直接接触的细胞。关于TNT如何形成及形成特点目前尚不清楚。
目前已发现多种细胞间均可形成类似该结构[13-15],并且发现通过TNT不仅可以转运小分子物质、质膜成分,还可以转运线粒体等细胞器[16]。本研究将小鼠NSCs和原代分离的视网膜色素变性模型大鼠RPE细胞体外共培养24 h,发现线粒体从小鼠NSCs细胞内通过TNT转运到原代分离的RPE内,提示小鼠NSCs可将自身线粒体转运到视网膜色素变性模型大鼠的RPE细胞中,证实了NSCs可向RPE细胞进行线粒体转运。关于为何线粒体转运方向是从NSCs到RPE细胞的问题仍有待探讨。
RCS大鼠是经典的视网膜色素变性模型,其主要是因为MERTK基因突变,导致RPE吞噬感光细胞脱落的外节膜盘的功能下降,致使其在视网膜外层堆积,结构紊乱,继发性感光细胞变性死亡[17-18]。本研究结果已证实NSCs可通过TNT向RPE细胞转运线粒体,并且发现体外NSCs与RPE细胞直接共培养体系下,共培养组相比单独培养组RPE细胞的ROS水平有所降低,细胞增殖能力提高并且凋亡水平降低。提示NSCs可能通过将线粒体转运的机制,降低变性视网膜RPE细胞的ROS水平,并且改善其细胞增殖能力和凋亡水平,其具体通过何种机制实现改善RPE细胞的增殖和凋亡仍有待进一步研究。
| [1] | Barot M, Gokulgandhi M R, Mitra A K. Mitochondrial dysfunction in retinal diseases[J]. Curr Eye Res, 2011, 36(12): 1069–1077. DOI:10.3109/02713683.2011.607536 |
| [2] | Han H, Hu J, Yan Q, et al. Bone marrow-derived mesenchymal stem cells rescue injured H9c2 cells via transferring intact mitochondria through tunneling nanotubes in an in vitro simulated ischemia/reperfusion model[J]. Mol Med Rep, 2016, 13(2): 1517–1524. DOI:10.3892/mmr.2015.4726 |
| [3] | Li X, Zhang Y, Yeung S C, et al. Mitochondrial transfer of induced pluripotent stem cell-derived mesenchymal stem cells to airway epithelial cells attenuates cigarette smoke-induced damage[J]. Am J Respir Cell Mol Biol, 2014, 51(3): 455–465. DOI:10.1165/rcmb.2013-0529OC |
| [4] | Liu K, Ji K, Guo L, et al. Mesenchymal stem cells rescue injured endothelial cells in an in vitro ischemia-reperfusion model via tunneling nanotube like structure-mediated mitochondrial transfer[J]. Microvasc Res, 2014, 92: 10–18. DOI:10.1016/j.mvr.2014.01.008 |
| [5] | Vallabhaneni K C, Haller H, Dumler I. Vascular smooth muscle cells initiate proliferation of mesenchymal stem cells by mitochondrial transfer via tunneling nanotubes[J]. Stem CellDev, 2012, 21(17): 3104–3113. DOI:10.1089/scd.2011.0691 |
| [6] | Blake R, Trounce I A. Mitochondrial dysfunction and complications associated with diabetes[J]. Biochim Biophys Acta, 2014, 1840(4): 1404–1412. DOI:10.1016/j.bbagen.2013.11.007 |
| [7] | Terluk M R, Kapphahn R J, Soukup L M, et al. Investigating mitochondria as a target for treating age-related macular degeneration[J]. J Neurosci, 2015, 35(18): 7304–7311. DOI:10.1523/jneurosci.0190-15.2015 |
| [8] | Schwartz S D, Hubschman J P, Heilwell G, et al. Embryonic stem cell trials for macular degeneration: a preliminary report[J]. Lancet, 2012, 379(9817): 713–720. DOI:10.1016/s0140-6736(12)60028-2 |
| [9] | Edwards R B. The isolation and culturing of retinal pigment epithelium of the rat[J]. Vision Res, 1981, 21(1): 147–150. DOI:10.1016/0042-6989(81)90149-8 |
| [10] | Nash M S, Osborne N N. Pertussis toxin-sensitive melatonin receptors negatively coupled to adenylate cyclase associated with cultured human and rat retinal pigment epithelial cells[J]. Invest Ophthalmol Vis Sci, 1995, 36(1): 95–102. |
| [11] | De FeoD, Merlini A, Laterza C, et al. Neural stem cell transplantation in central nervous system disorders: from cell replacement to neuroprotection[J]. Curr Opin Neurol, 2012, 25(3): 322–333. DOI:10.1097/WCO.0b013e328352ec45 |
| [12] | Rustom A, Saffrich R, Markovic I, et al. Nanotubular highways for intercellular organelle transport[J]. Science, 2004, 303(5660): 1007–1010. DOI:10.1126/science.1093133 |
| [13] | Austefjord M W, Gerdes H H, Wang X. Tunneling nanotubes: Diversity in morphology and structure[J]. Commun Integr Biol, 2014, 7(1): e27934. DOI:10.4161/cib.27934 |
| [14] | Hase K, Kimura S, Takatsu H, et al. M-Sec promotes membrane nanotube formation by interacting with Ral and the exocyst complex[J]. Nat Cell Biol, 2009, 11(12): 1427–1432. DOI:10.1038/ncb1990 |
| [15] | Onfelt B, Nedvetzki S, Yanagi K, et al. Cutting edge: Membrane nanotubes connect immune cells[J]. J Immunol, 2004, 173(3): 1511–1513. DOI:10.4049/jimmunol.173.3.1511 |
| [16] | Gurke S, Barroso J F, Gerdes H H. The art of cellular communication: tunneling nanotubes bridge the divide[J]. Histochem Cell Biol, 2008, 129(5): 539–550. DOI:10.1007/s00418-008-0412-0 |
| [17] | D'Cruz P M, Yasumura D, Weir J, et al. Mutation of the receptor tyrosine kinase gene Mertk in the retinal dystrophic RCS rat[J]. Hum Mol Genet, 2000, 9(4): 645–651. DOI:10.1093/hmg/9.4.645 |
| [18] | Nandrot E F, Dufour E M. Mertk in daily retinal phagocytosis: a history in the making[J]. Adv Exp Med Biol, 2010, 664: 133–140. DOI:10.1007/978-1-4419-1399-9_16 |



