2. Department of Epidemiology, School of Public Health, University of Michigan, 1415 Washington Heights, Ann Arbor, MI 48109-2029, USA
2. Department of Epidemiology, School of Public Health, University of Michigan, MI 48109-2029, USA
结核病(tuberculosis,TB)作为威胁全人类健康的慢性传染病,仍然是全球性的公共卫生问题。全球有1/3的人口感染了结核分枝杆菌(Mycobacterium tuberculosis,MTB),而临床唯一使用的卡介苗(Bacille Calmette-Guérin,BCG)保护效力有限[1],且随着耐多药、广泛耐药以及HIV/AIDS合并感染的出现,使得结核病的防控形势更加严峻[2]。因此,研发新疫苗成了减轻全球结核负担的关键措施。H56作为新型抗结核疫苗,是一种亚单位蛋白疫苗,在动物实验中表现出良好的免疫保护效能[3]。但动物实验并不能等同于人体复杂的体液内环境,在投入临床使用之前,仍然需要大量的临床前试验来验证其有效性。基于此,本实验选取了135株重庆地区的儿童MTB临床分离株,对esxA、fbpB、Rv2660c进行基因测序,了解目的基因多态性,评估基因多态性对疫苗H56效能的影响。
1 材料与方法 1.1 菌株来源从重庆医科大学附属儿童医院感染科化验室保存的MTB临床分离株标本中选取135株菌株,严格按照《结核病诊断实验室检验规程》对标本菌株进行复苏、培养、保存。前期研究已完成了菌株基因分型,包括北京基因型菌株87株和非北京型菌株48株,北京型菌株分为北京现代型52株和北京古老型35株,本实验的阳性对照菌株H37Rv由重庆市结核病防治所提供。
1.2 DNA的提取用接种环取一菌环培养阳性的结核分枝杆菌菌落溶于100 μL的TE缓冲液中,用95 ℃沸水浴灭活15 min,经12 000×g离心3 min,取上清液保存至负20 ℃冰箱备用。用紫外分光光度仪测D(260)/D(280) 比值确定其纯度。
1.3 PCR扩增反应用于基因esxA、fbpB、Rv2660cPCR扩增的引物均参照文献[4]报道的引物序列设计,esxA、fbpB、Rv2660c正反向引物分别为5′-GCAATCCGGCGGCTCCACCAG-3′和5′-TCGGCCGCCATGACAACCTCTC-3′、5′-ACTCGGCTAACTGGCTGGTGC-3′和5′-CATACCGCCATACCGTTTGTGAGC-3′、5′-TTGAAGGTTTTGGGGG-CGAT-3′和5′-CTCAACGACCGTTTGCAGC-3′,由上海嘉根生物公司合成。PCR扩增条件:扩增体系25 μL,包含上下游引物各0.5 μL,2×Taq MasterMix 12.5 μL,ddH2O 6.5 μL,DNA模板5 μL。用于esxA、fbpB PCR扩增条件为:94 ℃预变性1 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸2.5 min,共30个循环;72 ℃终末延伸10 min。用于Rv2660cPCR扩增条件:94 ℃预变性1 min;94 ℃变性30 s,65 ℃退火30 s,70 ℃延伸3 min,共33个循环;72 ℃终末延伸10 min。
1.4 PCR产物的检测取5 μL PCR产物于2%的琼脂糖凝胶样孔中,经130 V稳压电泳30 min,完成电泳后将胶带置于凝胶成像仪进行成像分析。
1.5 DNA测序将纯化后的PCR产物送往上海嘉根生物科技有限公司进行测序,测序结果经峰图质量确认合格后,运用ContigExpress软件将正反向结果进行拼接,登录NCBI网站(http://www.ncbi.nlm.nih.gov/BLAST)将拼接结果与标准菌株H37Rv序列进行比对。
1.6 目的基因中T/B细胞表位区的确定检索免疫表位数据库(immune epitope database,IEDB)[5],获得结核分枝杆菌中存在的人T/B细胞表位序列,再与H37Rv株的目的基因序列进行比对,最终获得在该基因中存在的人T/B细胞表位信息。
1.7 统计学方法采用SPSS 21.0统计软件进行统计学分析,对计数资料进行χ2检验,对计量资料进行t检验。检验水准:α=0.05。
2 结果 2.1 病例对象地区分布情况135例病例对象来源于2006-2013年的重庆市儿童医院结核病住院患儿,主要反映重庆及周边地区儿童结核病患病情况,见表 1。在135例病例中,男性占62.22%(84/135),女性占37.78%(51/135);<2岁占30.37%(41/135),2~14岁占69.63%(94/135);57.04%(77/135) 有卡介苗接种史,37.78%(51/135) 无卡介苗接种史,剩下7例卡介苗接种史不详;31.85% (43/135) 有TB接触史,68.15%(92/135) 否认TB接触史。135例患儿中有87例做了结核菌素试验检测,其中阳性占49.43%(43/87),阴性占50.57%(44/87)。在所有的病例中,无HIV感染者。
| 年份 | 重庆 | 四川 | 贵州 | 云南 | 陕西 | 河南 | 合计 |
| 2006 | 2 | 1 | 0 | 0 | 0 | 0 | 3 |
| 2007 | 7 | 2 | 0 | 0 | 0 | 0 | 9 |
| 2008 | 1 | 4 | 1 | 0 | 1 | 0 | 7 |
| 2009 | 15 | 14 | 0 | 0 | 1 | 0 | 30 |
| 2010 | 23 | 10 | 3 | 1 | 0 | 0 | 37 |
| 2011 | 12 | 5 | 4 | 0 | 0 | 1 | 22 |
| 2012 | 7 | 7 | 2 | 0 | 0 | 0 | 16 |
| 2013 | 5 | 3 | 3 | 0 | 0 | 0 | 11 |
| 合计 | 72 | 46 | 13 | 1 | 2 | 1 | 135 |
2.2 目的基因的PCR结果
3个目的基因的PCR扩增结果分别见图 1,其中位于610、945、1 345 bp位点的亮带分别代表Rv2660c、esxA、fbpB扩增片段。
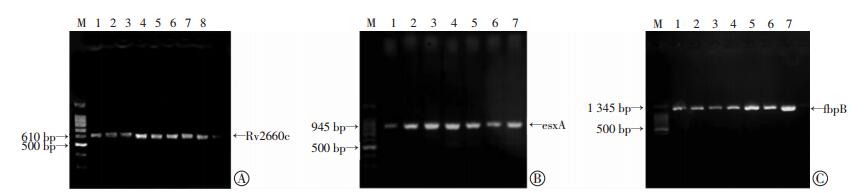
|
| M:标准1 500 bp Ladder;1:结核标准株H37Rv,2~7: Rv2660c、esxA、fbpB DNA扩增片段,8:Rv2660c的PCR扩增的目的条带 图 1 结核分枝杆菌内Rv2660c(A)、esxA(B)、fbpB(C)基因的扩增表达 |
2.3 目的基因中的多态性分析
在135株MTB临床分离株中,esxA、Rv2660c暂未发现突变,基因序列较保守。fbpB有66株(48.89%,66/135) 发生了变异,变异在2006-2013年的菌株中差异无统计学意义(P=0.692)。在北京型和非北京型菌株中fbpB突变率分别为70.11%(61/87) 和10.42% (5/48),差异具有统计学意义(P<0.01),fbpB在北京现代型和古老型菌株中的突变率分别为69.23%(36/52) 和71.43%(25/35),差异无统计学意义(P=0.927)。
2.4 fbpB基因突变引起的氨基酸改变在变异的66株MTB中,有61株(92.42%)发生同义突变,5株(7.58%)发生异义突变,变异类型均为单核苷酸碱基置换。5株异义突变的菌株中,2株为特异性的GCG113GTG突变,使得该密码子编码的氨基酸由精氨酸(Arg)变为缬氨酸(Val),2株为特异性的TTC418CTC突变,使得氨基酸由苯丙氨酸(Phe)变为亮氨酸(Leu),1株为特异性的AAG836ACG突变,使得氨基酸由赖氨酸(Lys)变为苏氨酸(Thr),具体的氨基酸改变见表 2。
| 核酸位置 | 碱基改变 | 氨基酸位置 | 氨基酸变异类型 |
| 5 | A→G | 2 | 同义突变 |
| 113 | C→T | 38 | Arg→Val |
| 418 | T→C | 140 | Phe→Leu |
| 714 | C→A | 238 | 同义突变 |
| 836 | A→C | 279 | Lys→Thr |
| NA:核酸;AA:氨基酸 | |||
2.5 fbpB中的T/B细胞抗原表位区的变异
在IEDB中,经检索发现H37Rv株中fbpB共有68个T/B细胞抗原表位序列(包括54个T细胞抗原表位序列、37个B细胞抗原表位序列、23个T和B细胞共同抗原表位)。fbpB的单核苷酸多态性(single nucleotide polymorphism,SNP)引起了17个T、B细胞抗原表位存在多态性,见表 3,包括T细胞抗原表位8个(14.81%),B细胞抗原表位9个(24.32%)。整个fbpB基因的dN值为0.000 120,dS为0.002 126,其中T细胞表位区与非T细胞表位区的dN值分别为0.000 067和0.000 408,dS分别为0.002 382和0.000 470,B细胞表位区的dN和dS值分别为0.000 063和0.002 380,非B细胞表位区dN和dS均为0(表 4)。
| 表位 | ID编号 | 表位位置 | 表位序列 |
| T表位 | 10841 | 121~140 | DWYSPACGKAGCQTYKWETL |
| 18898 | 131~150 | GCQTYKWETLLTSELPQWLS | |
| 16924 | 140~148 | LLTSELPQW | |
| 21797 | 221~240 | GPSSDPAWERNDPTQQIPKL | |
| 27901 | 237~245 | IPKLVANNT | |
| 18700 | 261~280 | GANIPAEFLENFVRSSNLKF | |
| 43950 | 271~290 | NFVRSSNLTFQDAYNAAGGH | |
| 18276 | 272~280 | FVRSSNLTF | |
| B表位 | 42790 | 1~20 | MTDVSRKIRAWGRRLMIGTA |
| 503 | 21~40 | AAVVLPGLVGLAGGAATVGA | |
| 34776 | 31~50 | LAGGAATVGAFSRRGLPVEF | |
| 10841 | 121~140 | DWYSPACGKAGCQTYKWETL | |
| 18898 | 131~150 | GCQTYKWETLLTSELPQWLS | |
| 21797 | 221~240 | GPSSDPAWERNDPTQQIPKL | |
| 43514 | 231~250 | NDPTQQIPKLVANNTRLWVY | |
| 18700 | 261~280 | GANIPAEFLENFVRSSNLTF | |
| 103457 | 265~279 | PAEFLENFVRSSNLT | |
| ID编号为IEDB数据库中的表位编号;变化的氨基酸由下划线标注 | |||
| 序列类型 | 长度(bp) | SNPS | dN | dS | dN/dS | ||
| 异义 | 同义 | 全部 | |||||
| 全长基因 | 975 | 3 | 2 | 5 | 0.000 120 | 0.002 126 | 0.056 |
| T细胞表位抗原区 | 897 | 2 | 1 | 3 | 0.000 067 | 0.002 382 | 0.028 |
| 非T细胞表位抗原区 | 78 | 1 | 1 | 2 | 0.000 408 | 0.000 470 | 0.868 |
| B细胞表位抗原区 | 930 | 3 | 2 | 5 | 0.000 063 | 0.002 380 | 0.026 |
| 非B细胞表位抗原区 | 45 | 0 | 0 | 0 | 0 | 0 | 0 |
3 讨论
结核菌潜隐性感染(latent tuberculosis infection,LTBI)是MTB抗原导致的一种持续的免疫反应状态,5%~10%的LTBI会发展成活动性结核病[6],是结核病潜在的发病源。近期流行病学模型强调在结核菌暴露前和暴露后接种疫苗可防止LTBI发展成活动性结核病,对于降低结核发病率非常重要[7]。H56作为多相疫苗(multistage vaccine),由抗原蛋白ESAT-6、Ag85B、Rv2660c融合而成,在动物实验中能诱发强烈的多功能CD4+T细胞免疫应答,不仅能加强BCG的效能,并对LTBI有明显的抑制作用,可防止其进展成活动性结核病,具有很好的应用前景[3]。
但MTB和人类宿主均在不断的进化,不同地区的宿主人群和流行的MTB存在遗传差异性[8],且既往的研究表明对人类致病的病毒、细菌及各种寄生虫等,在与人体免疫系统相互作用过程中,编码其抗原性物质的基因具有高度的变异性[9-11]。而常规动物实验往往忽略了宿主和MTB存在的遗传变异性,虽然目前已经有很多使用ESAT6、Ag85A/B等蛋白抗原进行重组BCG的报道,但是相关疫苗的免疫保护效果仍然不理想,需要投入更多的研究来降低重组疫苗可能出现的毒性并提高其免疫保护性能[12-13]。因此,详细评估新疫苗在不同人群中表现的多样性的免疫保护效果以及临床实验结果之间的相互关系是非常关键的[14]。
本研究中135株MTB均来源于儿童结核临床分离株,儿童结核病的传染源主要为家庭中排菌的成人肺结核成员,儿童活动范围窄、相互传染概率小且多为原发性结核病,因此儿童结核病的流行情况可反映当地结核病的传播情况以及成人结核病的控制水平[15]。2015年儿童结核新发病例为1 040万,占总人数的10%,儿童结核病的防控对控制结核总体疫情也十分关键。结合本实验流行病学资料,135株MTB对应的患儿就诊时间和来源地区都较分散,能较好代表重庆及周边地区流行的结核菌株。本实验中esxA、Rv2660c均未发现基因多态性。既往国内外研究发现esxA基因序列保守[16-18],本研究也再次证实esxA不存在基因多态性,表明在不同地区流行的MTB菌株中esxA基因序列均较保守。本实验对Rv2660c进行基因多态性研究,其编码的抗原蛋白是含有75个氨基酸的小分子蛋白,在结核菌感染的早期和晚期都持续稳定地表达[19],称为LTBI相关抗原,介导了H56持久抗结核感染的免疫保护作用[20]。Ag85B编码基因fbpB有48.89%存在基因多态性,fbpB的突变率与其他研究报道结果相当[16, 21-22],突变类型包括2个同义突变和3个异义突变,其中发生在113、418以及836位点的基因变异引起了相应氨基酸的改变。国外研究报道fbpB只发现了同义突变,我们发现的fbpB突变类型与目前国内JIANG等[21]、CHUANG等[22]报道较一致,且突变位点增加了新的AAG836ACG位点,考虑国外北京型菌株较少,而我国是北京型菌株高度流行的地区,所以fbpB的变异主要发生在北京型菌株中。新位点的AAG836ACG突变,使得氨基酸由Lys变为Thr,且突变位点在T、B细胞共同表位区,可能会对抗原蛋白的功能以及引发的细胞免疫应答造成影响。北京基因型菌株和非北京基因型菌株fbpB突变率分别为70.11%和10.42%,差异具有统计学意义(P<0.01),表明fbpB在北京型菌株中表现出高度变异性。北京基因型菌株是MTB一个重要的分支,在亚洲地区流行及传播,占全球MTB流行菌株的33.2%[23]。北京家族菌株的强毒力、高致病性及耐药性与结核病的暴发流行、复燃密切相关,导致了结核病的低治愈率、高发病率和高死亡率[24]。抗结核疫苗作为全球性使用疫苗,新疫苗在北京型菌株中的有效性研究必不可少,同时对其在全球不同地区的推广应用具有重要意义。本研究发现疫苗H56对感染北京基因型菌株的人群可能达不到满意的免疫保护作用,未来对新疫苗候选抗原的选择以及疫苗的有效评价应该纳入北京基因型菌株这个特殊的家族。此外,北京基因型菌株存在着在高度变异的CCC714CCA基因,不会造成蛋白功能的改变,与其他研究一致,CCC714CCA可作为北京型菌株的系统发育标志。fbpB中有17个T、B细胞抗原表位存在变异,5个位点的SNP引起了14.81%的T细胞表位以及24.32%的B细胞表位存在多态性,但整个基因编码区以及其中的人T/B细胞抗原表位区和非细胞抗原表位区的dN/dS值均小于1,提示fbpB在菌株生长过程中为纯化选择,其细胞表位不存在免疫逃逸,与COMAS等[25]报道一致。因此结核分枝杆菌基因组中的人T、B细胞抗原表位高度保守,可能在与宿主免疫系统相互作用的过程中受益,MTB抗原引发T细胞免疫应答只会对部分结核菌有效,所以对疫苗候选抗原的选择除了考虑其引起保护性免疫应答外,还应注意其引起的特异性反应。
综上所述,基因esxA、Rv2660c序列保守,fbpB在重庆地区的MTB菌株中存在基因多态性,且不同地域流行的MTB菌株中fbpB变异存在差异,尤其在北京型结核菌株中fbpB存在大量的基因变异,发生的基因变异可能会对该基因所编码的蛋白结构和功能造成影响,fbpB作为疫苗候选抗原的免疫效能仍需进一步的研究。fbpB中T、B细胞表位也存在多态性,但以同义替换率为主,所以结核菌的表位序列总体较保守。这将有利于结核菌在宿主内的存活。因此,在北京基因型菌株流行的地区H56对患者的保护效果可能不甚理想,新疫苗的临床试验评价需考虑到覆盖北京型菌株。鉴于本研究标本量有限,后续研究需继续扩大样本量、菌种来源来进一步验证抗原编码基因的多态性对H56效能的影响。
| [1] | AAGAARD C, DIETRICH J, Doherty M. TB vaccines: current status and future perspectives[J]. Immunol Cell Biol, 2009, 87(4): 279–286. DOI:10.1038/icb.2009.14 |
| [2] | MARAIS B J, ZUMLA A. History of tuberculosis and drug resistance[J]. N Engl J Med, 2013, 368(1): 88. DOI:10.1056/NEJMc1212308#SA1 |
| [3] | LIN P L, DIETRICH J, TAN E, et al. The multistage vaccine H56 boosts the effects of BCG to protect cynomolgus macaques against active tuberculosis and reactivation of latent Mycobacterium tuberculosis infection[J]. J Clin Invest, 2012, 122(1): 303–314. DOI:10.1172/JCI46252 |
| [4] | HERSHBERG R, LIPATOV M, SMALL P M, et al. High functional diversity in Mycobacterium tuberculosis driven by genetic drift and human demography[J]. PLoS Biol, 2008, 6(12): e311. DOI:10.1371/journal.pbio.0060311 |
| [5] | SALIMI N, FLERI W, PETERS B, et al. The immune epitope database: a historical retrospective of the first decade[J]. Immunology, 2012, 137(2): 117–123. DOI:10.1111/j.1365-2567.2012.03611.x |
| [6] | COMSTOCK G W, LIVESAY V T, WOOLPERT S F. The prognosis of a positive tuberculin reaction in childhood and adolescence[J]. Am J Epidemiol, 1974, 99(2): 131–138. DOI:10.1093/oxfordjournals.aje.a121593 |
| [7] | DYE C. Global epidemiology of tuberculosis[J]. Lancet, 2006, 367(9514): 938–940. DOI:10.1016/S0140-6736(06)68384-0 |
| [8] | FILLIOL I, MOTIWALA A S, CAVATORE M, et al. Global phylogeny of Mycobacterium tuberculosis based on single nucleotide polymorphism (SNP) analysis: insights into tuberculosis evolution, phylogenetic accuracy of other DNA fingerprinting systems, and recommendations for a minimal standard SNP set[J]. J Bacteriol, 2006, 188(2): 759–772. DOI:10.1128/JB.188.2.759-772.2006 |
| [9] | KAWASHIMA Y, PFAFFEROTT K, FRATER J, et al. Adaptation ofHIV-1 to human leukocyte antigen class Ⅰ[J]. Nature, 2009, 458(7238): 641–645. DOI:10.1038/nature07746 |
| [10] | JEFFARES D C, PAIN A, BERRY A, et al. Genome variation and evolution of the malaria parasite Plasmodium falciparum[J]. Nat Genet, 2007, 39(1): 120–125. DOI:10.1038/ng1931 |
| [11] | URWIN R, RUSSELL J E, THOMPSON E A L, et al. Distribution of surface protein variants among hyperinvasive meningococci: Implications for vaccine design[J]. Infect Immun, 2004, 72(10): 5955–5962. DOI:10.1128/IAI.72.10.5955-5962.2004 |
| [12] | WANG J L, QIE Y Q, ZHU B D, et al. Evaluation of a recombinant BCG expressing antigen Ag85B and PPE protein Rv3425 from DNA segment RD11 of Mycobacterium tuberculosis in C57BL/6 mice[J]. Med Microbiol Immunol, 2009, 198(1): 5–11. DOI:10.1007/s00430-008-0098-x |
| [13] | BAO L, CHEN W, ZHANG H D, et al. Virulence, immunogenicity and protective efficacy of two recombinant Mycobacterium bovis bacillus Calmette-Guérin strains expressing the antigen ESAT-6 from Mycobacterium tuberculosis[J]. Infect Immun, 2003, 71(4): 1656–1661. DOI:10.1128/IAI.71.4.1656-1661.2003 |
| [14] | ESMAIL H, BARRY C E 3RD, YOUNG D B, et al. The ongoing challenge of latent tuberculosis[J]. Philos Trans R Soc Lond B Biol Sci, 2014, 369(1645): 20130437. DOI:10.1098/rstb.2013.0437 |
| [15] |
田建岭, 吴喜蓉, 申阿东. 儿童结核病现状[J].
标记免疫分析与临床, 2013, 20(6): 458–462.
TIAN J L, WU X R, SHEN A D. Status of Pediatric Tuberculosis[J]. Labeled Immunoassays & Clin Med, 2013, 20(6): 458–462. DOI:10.11748/bjmy.issn.1006-1703.2013.06.028 |
| [16] | DAVILA J, ZHANG L, MARRS C F, et al. Assessment of the Genetic Diversity of Mycobacterium tuberculosis esxA, esxH, and fbpB Genes among Clinical Isolates and Its Implication for the Future Immunization by New Tuberculosis Subunit Vaccines Ag85B-ESAT-6 and Ag85B-TB10.4[J]. J Biomed Biotechnol, 2010, 2010: 208371. DOI:10.1155/2010/208371 |
| [17] | MERTANIASIH N M, HANDIJATNO D, PERWITASARI A D S, et al. Sequence Analysis of the Gene Region Encoding ESAT-6, Ag85B, and Ag85 C Proteins from Clinical Isolates of Mycobacterium tuberculosis[J]. Procedia Chem, 2016(18): 225–230. DOI:10.1016/j.proche.2016.01.035 |
| [18] | UPLEKAR S, HEYM B, FRIOCOURT V, et al. Comparative genomics of esx genes from clinical isolates of Mycobacterium tuberculosis provides evidence for gene conversion and epitope variation[J]. Infect Immun, 2011, 79(10): 4042–4049. DOI:10.1128/IAI.05344-11 |
| [19] | VERNON A. Treatment of latent tuberculosis infection[J]. Semin Respir Crit Care Med, 2013, 34(1): 67–86. DOI:10.1055/s-0032-1333544 |
| [20] | AAGAARD C, HOANG T, DIETRICH J. A multistage tuberculosis vaccine that confers efficient protection before and after exposure[J]. Nat Med, 2011, 17(2): 189–194. DOI:10.1038/nm.2285 |
| [21] | JIANG Y, LIU H, Li M, et al. Single Nucleotide Polymorphism in Ag85 Genes of Mycobacterium Tuberculosis Complex: Analysis of 178 Clinical Isolates from China and 13 BCG strains[J]. Int J Med Sci, 2015, 12(2): 126–134. DOI:10.7150/ijms.9951 |
| [22] | CHUANG P C, CHEN Y M, CHEN H Y, et al. Single nucleotide polymorphisms in cell wall biosynthesis-associated genes and phylogeny of Mycobacterium tuberculosis lineages[J]. Infect Genet Evol, 2010, 10(4): 459–466. DOI:10.1016/j.meegid.2010.03.003 |
| [23] | RAMAZANZADEH R, SAYHEMIRI K. Prevalence of Beijing family in Mycobacterium tuberculosis in world population: Systematic Review and Meta-Analysis[J]. Int J Mycobacteriol, 2014, 3(1): 41–45. DOI:10.1016/j.ijmyco.2014.01.001 |
| [24] | LIU M, JIANG W, LIU Y, et al. Increased genetic diversity of the Mycobacterium tuberculosis W-Beijing genotype that predominates in eastern China[J]. Infect Genet Evol, 2014, 22: 23–29. DOI:10.1016/j.meegid.2013.12.023 |
| [25] | COMAS I, CHAKRAVARTTI J, SMALL P M, et al. Human T cell epitopes of Mycobacterium tuberculosis are evolutionarily hyperconserved[J]. Nat Genet, 2010, 42(6): 498–503. DOI:10.1038/ng.590 |



