2. 510060 广州,中山大学:生命科学学院,有害生物控制与资源利用国家重点实验室
2. State Key Laboratory of Biocontrol and Resource Utilization, School of Life Sciences, Sun Yat-sen University, Guangzhou, Guangdong Province, 510060, China
肝癌是最常见的恶性肿瘤之一,在各种肿瘤相关死亡病因中位居第二[1]。我国是肝癌高发病区,约占世界总病例的一半[2]。我国肝癌大多起源于HBV感染相关的慢性炎症[3-4],组织中浸润的多种免疫细胞可显著影响并调控肝癌的发生、发展过程[5-6]。其中,髓系细胞是肿瘤浸润免疫细胞的主要成分。在肝癌癌巢及其癌旁间质组织中浸润的髓系免疫细胞主要包括了单核/巨噬细胞[7]、粒细胞[8]以及髓系树突状细胞[9]等。这些髓系细胞参与了肿瘤发展的各个过程,在介导肿瘤免疫逃逸以及促进肿瘤的血管生成、侵袭和转移中发挥着重要作用[10-12]。
粒细胞是一类在抵抗病原体侵袭、机体防御和创伤修复过程中发挥重要功能的髓系细胞,根据其胞内颗粒对瑞氏染色(Wright staining)的着色差异可分为3个亚群:中性粒细胞、嗜酸性粒细胞以及嗜碱性粒细胞。近年来,关于粒细胞在肿瘤发生、发展过程中的作用日益得到关注,但对于它们所扮演的角色仍存在争议[13-14]。一方面,有研究表明粒细胞能够通过分泌趋化因子、细胞因子、生长因子以及基质金属蛋白酶等效应分子促进肿瘤的血管生成和转移[13-14];粒细胞亚群也可介导肿瘤免疫逃逸[15-16]。而另一方面,多项研究发现粒细胞能够通过直接杀伤肿瘤细胞,或者通过抗体依赖的细胞毒反应间接抑制肿瘤的生长和转移[17-19]。目前的大部分报道主要是集中于中性粒细胞,而关于其他的粒细胞亚群在肿瘤(特别是人体肿瘤)进展中的作用尚不清楚。
本研究以肝癌为模型,发现除了经典的中性粒细胞亚群外,在肝癌患者外周血和肿瘤组织中还富集了一群CD33low CD11b low粒细胞。本研究初步鉴定了该群细胞的表型、形态(核型)以及功能,提示其为一群能够介导抗肿瘤免疫反应的类嗜碱性粒细胞。这些发现为更全面了解肝癌组织微环境中髓系细胞的表型和功能提供了新的认知,也为开发新型肿瘤治疗策略提供了新线索。
1 资料与方法 1.1 肝癌组织标本及血液标本本研究中采用的组织标本及对应外周血来自2015-2016年中山大学肿瘤防治中心(中山大学附属肿瘤医院)肝胆科行肝癌根治手术切除的16例患者,所有患者均经术后病理确认为原发性肝细胞癌,无梅毒或HIV感染,且术前未接受任何治疗。除肿瘤组织(癌巢)外,对应癌旁正常肝组织(距肿瘤边缘超过2 cm)也用作对照。13例健康人外周血白膜来自广州血液中心,均为肝炎病毒、HIV及梅毒螺旋体阴性。以上新鲜标本均用于白细胞的分离纯化。实验遵循1975年赫尔辛基宣言相关规定,并获得中山大学伦理委员会批准(伦理审批号:YB2016-052)。
1.2 主要试剂及仪器组织消化酶,包括Ⅰ、Ⅳ、Ⅺ型胶原酶,DNA酶;瑞士染色液和Giemsa染色液(美国Sigma公司);荧光标记的CD11b、CD33、CD14、CD15、CD16、CD11c、CD45、CD66b、CD80、CD45RA、CD62L、CD4、CD8以及同型对照抗体(美国BD PharMingen公司);荧光标记的CD3、CD19、CD56、HLA-DR、CD123、CD38以及同型对照抗体(美国Biolegend公司);CD11b阳选磁珠、pan T阴选磁珠(德国Miltenyi公司);红细胞裂解液(中国灏洋公司)。流式细胞仪(美国Beckman公司,MoFlo XDP和Gallios);细胞离心涂片机(美国Wescor公司);普通光学显微镜[日本OLYMPUS公司(BX41TF)]。
1.3 外周血白细胞的分离采用Ficoll梯度密度离心法分离健康人外周单个核细胞(peripheral blood mononuclear cell,PBMC)和中性粒细胞,得到的类嗜碱性粒细胞位于单个核细胞层,中性粒细胞位于底部红细胞层,经红细胞裂解液除去红细胞后,PBS重悬细胞用于之后的表型检测及流式分选等。肿瘤患者外周血处理方式同上。
1.4 肝癌癌旁和癌巢组织单细胞悬液制备Hank’s平衡盐溶液(Hank’s balanced salt solution,HBSS)清洗组织表面血污并去除血块和坏死组织,用手术剪将组织剪碎,加入适量消化液,于恒温摇床(37 ℃,85 r/min)震荡消化30 min。200目筛网过滤消化所得组织,收集滤液离心8 min(4 ℃,450×g)。弃上清并收集底部细胞,用HBSS重悬,低速离心1 min(20 ℃,50×g),沉降组织碎块,收集上层单细胞悬液,裂解红细胞,离心收集细胞,计数,待用。
1.5 肿瘤细胞系培养上清(tumor supernatant,TSN)的制备肝癌细胞系HepG2从美国ATCC获得,经PCR检测为支原体阴性。将细胞复苏后传代1次,以106/mL的浓度贴壁培养2 d后收集上清,分装保存于-80 ℃。
1.6 细胞表型的检测和流式细胞术分选来自外周血和组织的单细胞悬液在PBS洗过后在含有1%人AB血清的PBS中进行血清封闭,计数,取2×106细胞,离心8 min(4 ℃,380×g),负压吸弃上清,剩约40 μL液体于管底部,轻柔打散细胞;加入荧光抗体,4 ℃避光孵育30 min,间隔15 min振荡1次,同时设空白对照和补偿对照管。用1 mL上样缓冲液终止染色,离心8 min(4 ℃,380×g),吸弃上清,重悬至300 μL,用流式细胞仪进行检测。来自外周血和组织分离得到的细胞在进行表面染色后,用无菌0.9% NaCl溶液重悬至1×108/mL。用Moflow流式细胞分选仪对细胞悬液中的CD33lowCD11bhighCD123-中性粒细胞(亚群Ⅰ)和CD33lowCD11blowCD123+的类嗜碱性粒细胞(亚群Ⅱ)分别进行分选。分选纯度经流式细胞仪检测均超过90%。
1.7 细胞形态学检测对流式分选所得嗜碱性样细胞进行计数,取适当细胞进行离心涂片,用4%多聚甲醛室温固定20 min,用PBS洗去固定液,用瑞氏染液染1 min,用PBS洗去染液,用1 :20双蒸水稀释的Giemsa室温染色30 min。
1.8 T细胞的分离及增殖实验用pan T阴选磁珠纯化患者及健康人外周血单个核细胞悬液中的T细胞,冻存备用。T细胞复苏后,用羧基荧光素双乙酸盐琥珀酰亚胺酯(carboxyfluorescein diacetate, succinimidyl ester,CFSE)标记。将组织或外周血分选的CD33lowCD11blow髓系细胞以1 :1的比例分别与自体的2×105 T细胞共培养(以单独培养的T细胞作为对照),并加入0.5 μg/mL的Anti-CD3、1 μg/mL的Anti-CD28和5 U/mL的重组人IL-2。在实体瘤细胞培养上清刺激实验中,来自健康人外周血的CD33lowCD11blow髓系细胞在DMEM完全培养基或加入10% TSN的DMEM完全培养基中预刺激3 d,然后再与同源T细胞共培养。共培养5 d后,收集细胞用流式细胞仪检测T细胞增殖情况,强荧光细胞比例越高,提示T细胞增殖比例越小。
1.9 统计学分析采用SPSS 18.0统计软件,计量数据以x±s表示,组间的差异分析使用Wilcoxon非参数检验(双侧)。检验水准α=0.05。
2 结果 2.1 肝癌患者外周血和肿瘤中存在一群CD33lowCD11blow类嗜碱性粒细胞在肝癌患者外周血及肿瘤组织中,髓系细胞(CD33+CD45+CD19- CD56- CD3-7-AAD-)可以根据其CD33的表达量分为两个群体:CD33high单核/巨噬细胞和CD33low粒细胞,其中CD33low粒细胞可根据CD11b的表达进一步分为CD33lowCD11blow和CD33lowCD11bhigh两个群体(图 1)。首先检测了这两群粒细胞的表型特征,发现CD45+CD19-CD56-CD3-7-AAD-CD33lowCD11bhigh(以下简称为CD33lowCD11bhigh,图 1中以亚群Ⅰ表示)具有较大的侧向角信号,提示其胞内具有较多的颗粒;而7-AAD-CD45+CD19-CD56-CD3-CD33lowCD11blow(以下简称为CD33lowCD11blow,图 1中以亚群Ⅱ表示)的侧向角信号与淋巴细胞相近。虽然外周血中CD33lowCD11bhigh与CD33lowCD11blow细胞均呈现经典的粒细胞核型,但进一步的鉴定发现:与CD33lowCD11bhigh细胞呈现CD15+CD16+CD66b+的经典中性粒细胞表型不同,CD33lowCD11blow细胞并不表达中性粒细胞的特征性标记CD15、CD16和CD66b,但高表达CD123(IL-3受体α)和CD38,低表达HLA-DR,该表型与嗜碱性粒细胞相类似。然而,Wright-Giemsa染色并未能在该群细胞中展现嗜碱性颗粒的存在。提示在肝癌患者外周血和肿瘤粒细胞中,根据其CD11b的表达可将其划分为CD33lowCD11bhigh中性粒细胞以及CD33lowCD11blow类嗜碱性粒细胞两个亚群。

|
| A:CD33lowCD11bhigh细胞(亚群Ⅰ)与CD33lowCD11blow细胞(亚群Ⅱ)的划分和前向角、侧向角信号对比;B:两个亚群的基本核型;C:CD33lowCD11bhigh细胞(亚群Ⅰ)与CD33lowCD11blow细胞(亚群Ⅱ)的表面标记表达 图 1 流式细胞仪及Wright-Giemsa染色检测肝癌患者中两个粒细胞亚群的表型 |
2.2 CD33lowCD11blow细胞在肝癌患者外周血和肿瘤组织中富集
流式细胞仪检测结果显示:健康人外周血中也存在着CD33lowCD11blow细胞,但其比例显著低于肝癌患者[(1.23±0.20)% vs (8.19±1.51)%,P < 0.001]。为探究CD33lowCD11blow细胞在肝癌组织中的分布情况,本研究检测了13例配对的肝癌癌巢与癌旁正常组织样本中CD33lowCD11blow的比例。结果显示:CD33lowCD11blow细胞在肿瘤癌巢中富集,其丰度显著高于癌旁正常组织[(1.41±0.26)% vs (0.73±0.20)%,P < 0.001,图 2]。
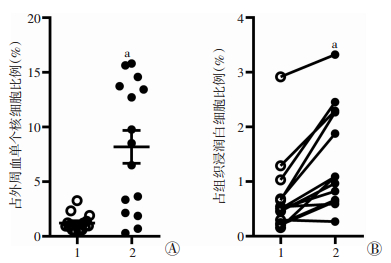
|
| A:CD33lowCD11blow细胞在外周血中的比例1:健康人外周血,2:肝癌患者外周血;a:P < 0.001,与健康人外周血比较;B:CD33lowCD11blow细胞在肝组织中的比例1:癌旁正常组织,2:癌巢;a:P < 0.001,与癌旁正常组织比较 图 2 流式细胞仪检测CD33lowCD11blow细胞在外周血和肿瘤组织中的富集 |
2.3 肝癌患者外周血与肿瘤中CD33lowCD11blow细胞呈未成熟粒细胞核型
为了探究CD33lowCD11blow细胞在肝癌患者中的富集是否得益于“应急造血”所产生的未成熟髓系细胞,我们通过流式细胞仪分选健康人外周血、肝癌患者外周血以及肝癌中的CD33lowCD11blow细胞,并通过Wright-Giemsa染色观察其核型。结果显示,CD33lowCD11blow细胞在健康人外周血中基本呈现经典粒细胞的核形态[(73.31±4.74)%]:多叶核(多为3~4叶),核叶之间以染色质相连。在肝癌患者外周血中,多叶核CD33lowCD11blow细胞显著降低[(34.27±1.47)%,P < 0.001],出现大量马蹄状或不规则形态的单个核细胞。而在肝癌组织中,多叶核的比例进一步降低[(12.48±4.26)%,P < 0.001,图 3]。
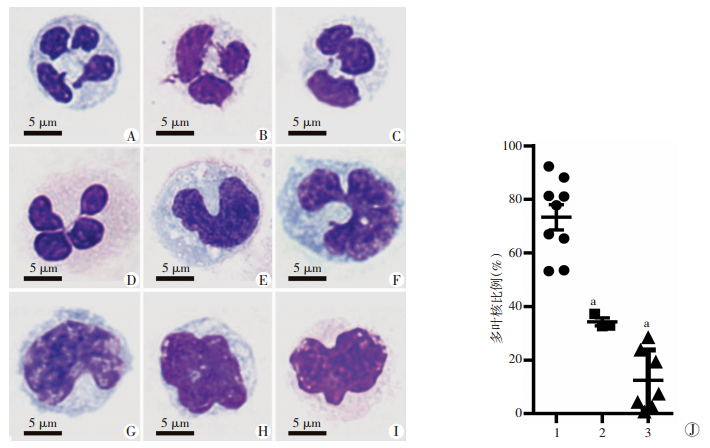
|
| A~C:健康人外周血CD33lowCD11blow细胞核型代表图(多叶核型);D:肝癌患者外周血CD33lowCD11blow细胞核型代表图(多叶核型);E~F:肝癌患者外周血CD33lowCD11blow细胞核型代表图(马蹄状或不规则核型);G~I:肝癌患者外周血CD33lowCD11blow细胞核型代表图(马蹄状或不规则核型);J:多叶核CD33lowCD11blow细胞的比例分析1:健康人外周血;2:肝癌患者外周血;3:肝癌癌巢;a:P < 0.001,与健康人外周血比较 图 3 Wright-Giemsa染色观察健康人外周血、肝癌患者外周血和肝癌癌巢中CD33lowCD11blow细胞的核型变化 |
2.4 肿瘤微环境激活CD33lowCD11blow细胞具有促免疫反应功能
利用流式细胞仪从3例肝癌患者肿瘤组织中分选出CD33lowCD11blow细胞,并与同源外周血T细胞共培养,从而检测CD33lowCD11blow细胞对T细胞增殖的影响。结果显示,与单独T细胞培养相比,与CD33lowCD11blow细胞共培养的T细胞增殖比例上升(图 4A)。为了进一步证明肿瘤细胞所分泌的可溶性因子能够激活CD33lowCD11blow细胞的促免疫反应功能,
在体外利用TSN处理从健康人外周血中分离得到的CD33lowCD11blow细胞,然后与同源T细胞共培养。结果如图 4B所示:与对照组和未经TSN处理的CD33lowCD11blow细胞相比,TSN处理后的CD33lowCD11blow细胞具有更强的促进T细胞增殖的能力。
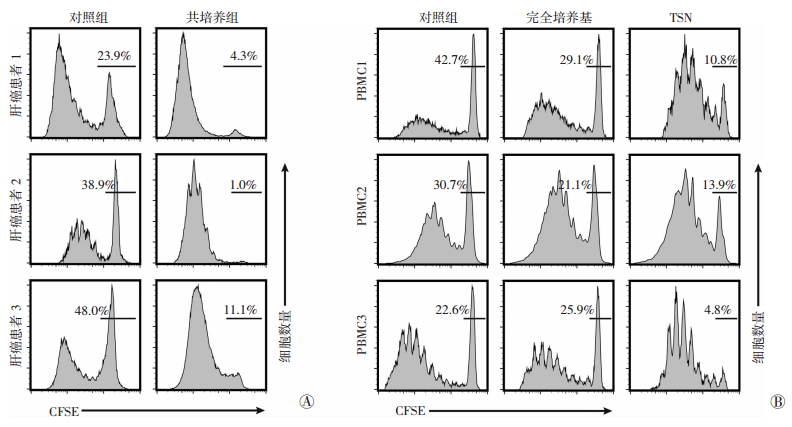
|
| A:肝癌组织中CD33lowCD11blow细胞的功能;B:健康人PBMC中分选得到的CD33lowCD11blow细胞经TSN刺激后的功能变化 图 4 流式细胞仪检测CD33lowCD11blow细胞促进T细胞增殖的功能 |
3 讨论
尽管关于粒细胞在肿瘤发生、发展过程中的作用日益得到关注,但以往的大部分研究主要是集中于中性粒细胞[20]。关于其它的粒细胞亚群在人体肿瘤进展中的作用尚不清楚。本研究鉴定了一群CD45+CD19-CD56-CD3-CD33lowCD11blow髓系细胞,其表型类似嗜碱性粒细胞[21];该亚群在肝癌患者外周血和肿瘤组织中富集,呈现出未成熟粒细胞的核型,并具有促进T细胞增殖功能。这些结果对于深入了解粒细胞亚群的表型与功能,进一步探讨肿瘤与不同髓系细胞亚群的相互关系提供了新的认识。
尽管在小鼠研究中,根据粒细胞的功能可以将其分为N1型(抗肿瘤)和N2型(促肿瘤)粒细胞,在肿瘤患者中是否存在这样的分型目前仍存在争议[13]。Singhal等[22]近期发现,在肺癌中存在一群HLA-DR+CD11b+CD15highCD10-CD16low的粒细胞,兼有粒细胞与抗原递呈细胞的特征,并能起到介导抗肿瘤免疫反应的功能。Condamine等[23]和Sagiv等[24]则分别从人非小细胞肺癌、头颈部肿瘤以及肺癌小鼠模型中发现,外周血粒细胞可以通过密度梯度离心法,根据其密度差异区分为具有抗肿瘤功能的高密度粒细胞,以及具有促肿瘤功能的低密度粒细胞和粒细胞样髓源抑制细胞(PMN-MDSC)。本研究在肝癌患者中,鉴定了一群CD33lowCD11blow类嗜碱性粒细胞。该群细胞不表达中性粒细胞标记CD15、CD16和CD66b,并且在Ficoll密度梯度离心中处于单个核细胞层,与经典的中性粒细胞存在着显著差异。CD33lowCD11blow细胞表达CD123和CD38,其表型符合嗜碱性粒细胞[21]。同时,CD33lowCD11blow细胞能够在肿瘤微环境刺激下获得强大的促进T细胞增殖的功能。这些发现描述了嗜碱性粒细胞在肝癌免疫微环境中的作用,并为全面了解肝癌相关粒细胞亚群的表型与功能建立了一定的基础。然而,CD33lowCD11blow细胞促进T细胞增殖的机制在本研究中尚未能深入探讨。鉴于CD33lowCD11blow细胞低表达HLA-DR,与肺癌中HLA-DR+中性粒细胞呈现抗原递呈细胞的特征相类似[22],因此CD33lowCD11blow细胞也可能通过交叉递呈的方式激活CD8+ T细胞。进一步厘清这一反应将有利于提高我们对于肿瘤免疫机制的理解。
髓系细胞具有较短的寿命,因此,肿瘤需要通过系统性的影响造血活动,使其往髓系方向偏倚。近年来,国际上对于肿瘤相关的髓系细胞生成提出了“应急造血”的假说(“emergency” hematopoiesis)[20, 25]。该假说认为,肿瘤通过分泌多种可溶性因子促进髓系细胞生成,并促使大量未成熟的髓系细胞也从骨髓释放到外周循环系统。判断髓系细胞的分化阶段和成熟程度的重要标准就是其核型。过往的研究普遍认为,以MDSC为代表的“应急造血”产物通常具有抑制免疫反应和促进肿瘤发展的功能[26-28],与“应急造血”假说相符。本研究发现CD33lowCD11blow细胞在肝癌患者外周血和肿瘤组织中呈现未成熟的核型,并且其多叶核核型比例在健康人外周血-肝癌患者外周血-肝癌组织中表现出递减趋势。但与流行观点不同的是,CD33lowCD11blow细胞在肿瘤组织中呈现出促进(而非抑制)T细胞免疫反应的功能。本研究通过体外TSN模型模拟肿瘤微环境的刺激,发现TSN能够刺激健康人外周血CD33lowCD11blow细胞获得更强的促T细胞增殖的能力。这些结果提示,肿瘤引起的“应急造血”反应并非专利于肿瘤的机制,而是机体面对肿瘤刺激时的应激反应。这一反应虽然被肿瘤利用而产生大量的免疫抑制细胞,但是仍然有部分“应急造血”反应产物能够起到抗击肿瘤的功能。然而,肿瘤调控、利用“应急造血”为其服务的分子机制,以及CD33lowCD11blow细胞是如何在肿瘤微环境中保持其抗肿瘤功能的,仍需要深入研究。进一步阐明这些机制,对探寻肿瘤免疫治疗的新思路具有重要的意义。
综上,本研究探讨了一群CD45+ CD19-CD56-CD3-CD33lowCD11blow类嗜碱性粒细胞在肝癌患者中的表型和分布,并通过功能研究揭示其抗肿瘤的免疫功能。进一步研究该群细胞的产生、招募以及功能激活机制,对于深入了解肝癌相关的粒细胞反应具有重要的意义,并有望为新型免疫治疗的开发提供新的思路。
| [1] | Llovet J M, Zucman-Rossi J, Pikarsky E, et al. Hepatocellular carcinoma[J]. Nat Rev Dis Primers, 2016, 2: 1–23. DOI:10.1038/nrdp.2016.18 |
| [2] | Torre L A, Bray F, Siegel R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [3] | Tian Y, Yang W, Song J, et al. Hepatitis B virus X protein-induced aberrant epigenetic modifications contributing to human hepatocellular carcinoma pathogenesis[J]. Mol Cell Biol, 2013, 33(15): 2810–2816. DOI:10.1128/MCB.00205-13 |
| [4] | Wu S, Yang C, Guo S, et al. Stimulation of B7-H1 in hepatocarcinoma cells by hepatitis B virus X antigen[J]. Immunol Invest, 2010, 39(7): 754–769. DOI:10.3109/08820139.2010.494193 |
| [5] | Alison M R, Nicholson L J, Lin W R.Chronic inflammation and hepatocellular carcinoma[M]//Inflammation and Gastrointestinal Cancers, 2011, 185: 135-148.DOI:10.1007/978-3-642-03503-6_8. |
| [6] | Hanahan D, Weinberg R A. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646–674. DOI:10.1016/j.cell.2011.02.013 |
| [7] | Kuang D M, Zhao Q, Peng C, et al. Activated monocytes in peritumoral stroma of hepatocellular carcinoma foster immune privilege and disease progression through PD-L1[J]. J Exp Med, 2009, 206(6): 1327–1337. DOI:10.1084/jem.20082173 |
| [8] | Li X F, Chen D P, Ouyang F Z, et al. Increased autophagy sustains the survival and pro-tumourigenic effects of neutrophils in human hepatocellular carcinoma[J]. J Hepatol, 2015, 62(1): 131–139. DOI:10.1016/j.jhep.2014.08.023 |
| [9] | Ouyang F Z, Wu R Q, Wei Y, et al. Dendritic cell-elicited B-cell activation fosters immune privilege via IL-10 signals in hepatocellular carcinoma[J]. Nat Commun, 2016, 7: 13453. DOI:10.1038/ncomms13453 |
| [10] | Engblom C, Pfirschke C, Pittet M J. The role of myeloid cells in cancer therapies[J]. Nat Rev Cancer, 2016, 16(7): 447–462. DOI:10.1038/nrc.2016.54 |
| [11] | Kumar V, Patel S, Tcyganov E, et al. The nature of myeloid-derived suppressor cells in the tumor microenvironment[J]. Trends Immunol, 2016, 37(3): 208–220. DOI:10.1016/j.it.2016.01.004 |
| [12] | Luo B, Gan W, Liu Z, et al. Erythropoeitin signaling in macrophages promotes dying cell clearance and immune tolerance[J]. Immunity, 2016, 44(2): 287–302. DOI:10.1016/j.immuni.2016.01.002 |
| [13] | Powell D R, Huttenlocher A. Neutrophils in the tumor microenvironment[J]. Trends Immunol, 2016, 37(1): 41–52. DOI:10.1016/j.it.2015.11.008 |
| [14] | Coffelt S B, Wellenstein M D, de Visser K E. Neutrophils in cancer: neutral no more[J]. Nat Rev Cancer, 2016, 16(7): 431–446. DOI:10.1038/nrc.2016.52 |
| [15] | Peranzoni E, Zilio S, Marigo I, et al. Myeloid-derived suppressor cell heterogeneity and subset definition[J]. Curr Opin Immunol, 2010, 22(2): 238–244. DOI:10.1016/j.coi.2010.01.021 |
| [16] | Sionov R V, Fridlender Z G, Granot Z. The Multifaceted Roles Neutrophils Play in the Tumor Microenvironment[J]. Cancer Microenviron, 2015, 8(3): 125–158. DOI:10.1007/s12307-014-0147-5 |
| [17] | Kushner B H, Cheung N K. Absolute requirement of CD11/CD18 adhesion molecules, FcRⅡ and the phosphatidylinositol-linked FcRⅢ for monoclonal antibody-mediated neutrophil antihuman tumor cytotoxicity[J]. Blood, 1992, 79(6): 1484–1490. |
| [18] | Granot Z, Henke E, Comen E A, et al. Tumor entrained neutrophils inhibit seeding in the premetastatic lung[J]. Cancer Cell, 2011, 20(3): 300–314. DOI:10.1016/j.ccr.2011.08.012 |
| [19] | López-Lago M A, Posner S, Thodima V J, et al. Neutrophil chemokines secreted by tumor cells mount a lung antimetastatic response during renal cell carcinoma progression[J]. Oncogene, 2013, 32(14): 1752–1760. DOI:10.1038/onc.2012.201 |
| [20] | Strauss L, Sangaletti S, Consonni F M, et al. RORC1 Regulates Tumor-Promoting "Emergency" Granulo-Monocytopoiesis[J]. Cancer Cell, 2015, 28(2): 253–269. DOI:10.1016/j.ccell.2015.07.006 |
| [21] | Chirumbolo S, Ortolani R, Vella A. CCR3 as a single selection marker compared to CD123/HLADR to isolate basophils in flow cytometry: some comments[J]. Cytometry A, 2011, 79(2): 102–106. DOI:10.1002/cyto.a.21008 |
| [22] | Singhal S, Bhojnagarwala P S, O'Brien S, et al. Origin and Role of a Subset of Tumor-Associated Neutrophils with Antigen-Presenting Cell Features in Early-Stage Human Lung Cancer[J]. Cancer Cell, 2016, 30(1): 120–135. DOI:10.1016/j.ccell.2016.06.001 |
| [23] | Condamine T, Dominguez G A, Youn J I, et al. Lectin-type oxidized LDL receptor-1 distinguishes population of human polymorphonuclear myeloid-derived suppressor cells in cancer patients[J]. Science Immunology, 2016, 1(2). DOI:10.1126/sciimmunol.aaf8943 |
| [24] | Sagiv J Y, Michaeli J, Assi S, et al. Phenotypic diversity and plasticity in circulating neutrophil subpopulations in cancer[J]. Cell Rep, 2015, 10(4): 562–573. DOI:10.1016/j.celrep.2014.12.039 |
| [25] | Ueha S, Shand F H, Matsushima K. Myeloid cell population dynamics in healthy and tumor-bearing mice[J]. Int Immunopharmacol, 2011, 11(7): 783–788. DOI:10.1016/j.intimp.2011.03.003 |
| [26] | Condamine T, Mastio J, Gabrilovich D I. Transcriptional regulation of myeloid-derived suppressor cells[J]. J Leukoc Biol, 2015, 98(6): 913–922. DOI:10.1189/jlb.4RI0515-204R |
| [27] | Talmadge J E, Gabrilovich D I. History of myeloid-derived suppressor cells[J]. Nat Rev Cancer, 2013, 13(10): 739–752. DOI:10.1038/nrc3581 |
| [28] |
王婷婷, 庄园, 陈娜, 等. 肿瘤相关中性粒细胞在胃癌中的分布、表型及其免疫抑制功能研究[J].
第三军医大学学报, 2014, 36(6): 587–591.
Wang T T, Zhuang Y, Chen N, et al. Distribution, phenotype and immunosuppressive function of tumor-associated neutrophils in gastric cancer[J]. J Third Mil Med Univ, 2014, 36(6): 587–591. |



