2. 400038 重庆,第三军医大学心理学院发育神经心理学教研室
2. Department of Developmental Neuropsychology, College of Psychology, Third Military Medical University, Chongqing, 400038, China
丙泊酚是目前普遍用于麻醉诱导、维持及ICU镇静的新型静脉麻醉药,起效快、苏醒迅速且功能恢复完善。研究发现,新生儿时期麻醉暴露引起大脑发育受损并导致长期的认知行为改变[1-2],同时一些临床研究表明,新生期麻醉可能是脑发育失调及行为障碍的高危因素[3],并且对儿童后期学习能力造成影响[4]。我们前期研究证实,丙泊酚能抑制新生鼠海马神经发生[5],并影响梨状皮层神经前体细胞增殖[6]。然而丙泊酚对大脑影响广泛, 其神经毒性机制尚未完全认识。
有研究指出,丙泊酚可作用于下丘脑一些核团并影响这些核团中的神经元活动[7-8]。下丘脑分泌的神经肽类在神经发生及神经环路的形成中发挥重要作用,并作为关键的信号分子短期或长期地作用于大脑发育过程[9]。因此,丙泊酚是否通过影响下丘脑从而对神经发生造成损伤值得研究。本研究采用新生期小鼠丙泊酚暴露模型,观察新生小鼠下丘脑的相关改变,以进一步研究麻醉药物的神经毒性机制。
1 材料与方法 1.1 主要试剂丙泊酚购自英国AstraZenenca公司; 10%脂肪乳剂购自中国安徽丰原药业公司; C-Fos抗体购自美国Milipore公司; 糖皮质激素受体(glucocorticoid receptor GR)抗体购自美国Santa Cruz公司;精氨酸加压素(arginine vasopressin, AVP)抗体购自美国Santa Cruz公司;离子钙接头分子蛋白1(ionized calcium binding adapter molecule 1,Iba1) 抗体购自日本Wako公司;β-actin抗体购自中国武汉博士德公司;荧光二抗、生物素二抗购自美国Invitrogen公司;SABC试剂购自美国Vector公司;辣根酶标记IgG二抗、DAB显色试剂盒购自中国北京中杉金桥公司。
1.2 方法 1.2.1 动物与分组健康4月龄C57BL/6J临产孕鼠购自第三军医大学实验动物中心,体质量23~25 g,饲养环境18~22 ℃,正常昼夜交替采光,自由充足摄取食物和水。15只小鼠出生第1天记为P0,第7天(P7) 时将同窝新生小鼠按随机数字表法分为3组(n=5):对照组、丙泊低剂量组、丙泊酚高剂量组。
1.2.2 药物处理小鼠7 d龄时,予以药物处理。对照组腹腔注射10%脂肪乳剂(丙泊酚药物溶剂),低、高剂量组分别腹腔注射丙泊酚30 mg/kg及60 mg/kg。药物处理后小鼠置于37 ℃恒温充氧保温箱中,直至小鼠麻醉恢复。药物注射24 h后(P8) 处死小鼠并收取标本。
1.2.3 免疫组织化学及免疫荧光染色小鼠处死后,取脑标本置于4%多聚甲醛(4%PFA)溶液中固定48 h,后转移至30%蔗糖+4%PFA溶液中。充分脱水沉底后,将脑标本以40 μm/张收取冠状面冰冻切片,收集于防冻液-20 ℃保存备用。取合适的切片于0.01 mol/L PBS漂洗后,3%过氧化氢溶液(H2O2)室温孵育20 min,PBS漂洗后0.3% Triton X-100 37 ℃处理30 min,3%胎牛血清(BSA)封闭反应30 min。分别加入一抗:兔来源C-Fos (1:1 000);兔来源GR(1:500);兔来源Iba1(1:1 000);山羊来源AVP(1:1 000),4 ℃孵育过夜。PBS漂洗后分别加入生物素化的抗兔IgG(1:200), 抗兔Cy3、抗山羊594荧光二抗(1:400),于室温孵育2 h。PBS漂洗后置于链霉亲和素-生物素复合物(SABC)中37 ℃孵育1 h。PBS漂洗后DAB显色,漂片后自然晾干,中性树脂封片。GR、AVP免疫荧光二抗孵育后,PBS漂洗,DAPI进行复染,再次PBS漂洗后漂片,晾干,荧光封片剂封片。
1.2.4 Western blot小鼠处死后,迅速取下丘脑新鲜组织,采用RIPA裂解法提取总蛋白,并用BCA法测定蛋白浓度并调至一致。采用SDS-PAGE凝胶电泳方法分离蛋白后,转移至PVDF膜上。5%脱脂奶粉室温封闭3 h,分别加入一抗:山羊来源AVP(1:1 000), 兔来源GR(1:1 000),小鼠来源β-actin(1:1 000), 4 ℃孵育过夜。TBST漂洗3次后,加入辣根酶标记山羊抗兔、兔抗山羊、山羊抗小鼠二抗(1:1 000), 室温孵育3 h。TBST漂洗3次后,用化学发光试剂盒显影,用Image Lab软件进行灰度分析。
1.3 统计学分析采用SPSS 19.0统计软件。计量资料以x±s表示,组间比较采用单因素方差分析及LSD多重比较。
2 结果 2.1 丙泊酚激活小鼠下丘脑室旁核相关神经元免疫组化结果(图 1)显示:C-Fos阳性细胞在下丘脑各区域均有表达,而在室旁核区域,相比对照组(9.95±1.51),丙泊酚低剂量组(14.75±1.39) 和高剂量组(24.00±5.25) C-Fos阳性细胞数量均明显增加(n=5, P < 0.05, P < 0.01),高剂量组对比低剂量组其阳性细胞数量增多(n=5, P < 0.01)。各组中C-Fos阳性细胞在室旁核中表达的范围未见明显改变。
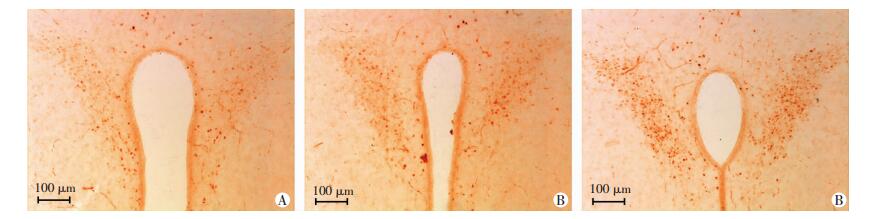
|
| A:对照组;B丙泊酚低剂量组;C:丙泊酚高剂量组 图 1 SABC染色观察丙泊酚激活小鼠下丘脑室旁核相关神经元 |
2.2 丙泊酚致新生小鼠室旁核表达AVP阳性细胞数量增加
观察各组中室旁核分泌AVP的神经元(图 2),与对照组相比(14.94±3.39),丙泊酚低剂量组(19.63±3.70) 中AVP阳性细胞数量增加,但差异无统计学意义(P > 0.05)。而丙泊酚高剂量组(23.38±2.29) 对比对照组,表达AVP细胞数量明显增加,差异有统计学意义(P < 0.01)。同时蛋白定量分析结果显示,高剂量组中AVP蛋白增加37.8%(P < 0.01,图 3A)。
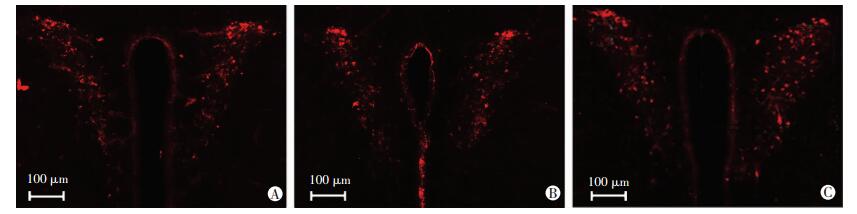
|
| A:对照组;B:丙泊酚低剂量组;C:丙泊酚高剂量组 图 2 免疫荧光染色观察丙泊酚上调新生小鼠室旁核AVP表达 |

|
| A:下丘脑AVP;B:室旁核GR 图 3 Western blot检测各组小鼠AVP、GR蛋白表达 |
2.3 丙泊酚致新生小鼠下丘脑室旁核GR表达上调
GR表达明显聚集于下丘脑室旁核中。与对照组(27.38±2.17) 相比,丙泊酚低剂量组(31.38±2.39) 中室旁核糖皮质激素受体表达无明显差异(P > 0.05);高剂量组(37.38±3.17) 对比对照组及低剂量组GR表达均明显上调,差异有统计学意义(P < 0.01, P < 0.05, 图 4)。蛋白定量分析结果显示:相比对照组,低剂量组及高剂量组GR蛋白分别增加23.4%(P < 0.05) 及47.2%(P < 0.01,图 3B)。
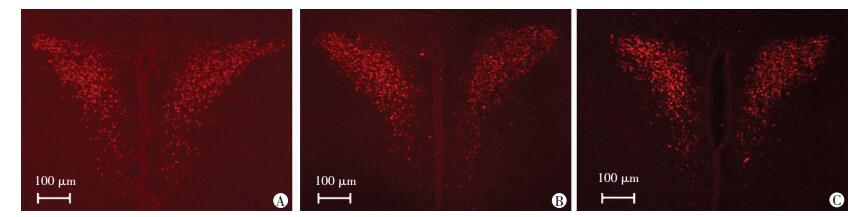
|
| 图 4 免疫荧光染色观察丙泊酚上调新生小鼠室旁核GR表达 |
2.4 丙泊酚抑制新生期小鼠下丘脑小胶质细胞活化水平
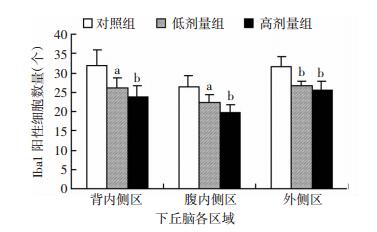
采用Iba1特异性标记下丘脑中的小胶质细胞,并观察统计下丘脑背内侧区(dorsomedial hypothalamic area, DMHA)、腹内侧区(ventromedial hypothalamic area, VMHA)及下丘脑外侧区(lateral hypothalamic area, LHA)各组中小胶质细胞数量,可见在以上3个部位,相对比对照组,丙泊酚低剂量组和高剂量组中Iba1阳性细胞数量均明显减少,而Iba1阳性细胞的分布趋势并没有改变(图 5、6)。
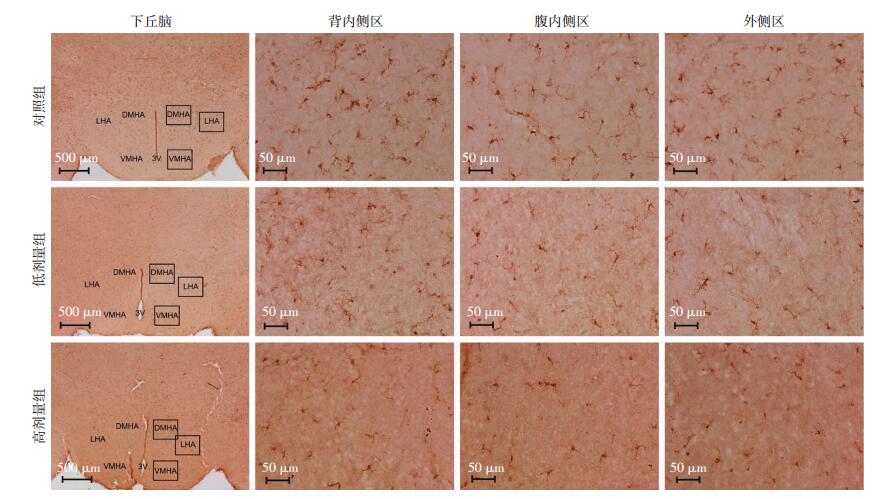
|
| 图 5 SABC染色观察丙泊酚抑制新生小鼠下丘脑小胶质细胞活化水平 (DMHA:下丘脑背内侧区;VMHA:下丘脑腹内侧区;LHA:下丘脑外侧区;3V:第三脑室) |
|
| a: P < 0.05, b: P < 0.01, 与对照组比较 图 6 丙泊酚处理后小鼠下丘脑各区域105 μm2范围内Iba1阳性细胞数量 (n=4,x±s) |
3 讨论
大脑的发育是一个长期而持续的过程,在人类中孕后6个月至生后几年的时间内,处在一个快速发展阶段[10]。在这个阶段内,大脑中的神经发生尤为容易受到影响。大量研究表明,大脑发育关键期丙泊酚麻醉暴露,可能导致神经元凋亡,抑制神经元的增殖,并且对远期的神经行为功能产生影响[2, 11]。然而,目前对于丙泊酚神经毒性相关机制,并没有明确结论。
神经发生受到多方面因素的调控如激素、生长因子、神经递质等,而下丘脑作为机体调节内分泌的高级神经中枢,在大脑发育的关键窗口期发挥着重要的作用。下丘脑分泌的神经肽类物质,催产素、精氨酸加压素、促肾上腺皮质激素释放激素等,被证实与神经发生及神经突发生相关,参与调控神经环路形成,并影响远期的社会行为表现[9, 12]。胚胎期下丘脑即与大脑其他区域形成复杂的联系,然而在后期一些环境改变后联系将进行重塑,例如营养水平、应激、哺乳等因素刺激[9]。
C-Fos蛋白是即刻早期基因转录因子家族中的一员,其在机体中的表达在正常情况下较为稳定,而在一些应激下能够迅速表达升高,如代谢改变或者神经元的激活[13]。运用C-Fos蛋白可以在细胞水平对机体应激部位进行定位,并且C-Fos阳性细胞数量与受刺激的强度直接相关,刺激越强,阳性细胞数量越多。本研究结果显示,丙泊酚麻醉暴露后,下丘脑室旁核区域C-Fos大量表达,低、高剂量组相对比对照组均表达上调,并且高剂量组明显多于低剂量组。提示丙泊酚激活下丘脑室旁核中神经元,并且激活程度与丙泊酚呈剂量相关性。
室旁核(PVN)是下丘脑中重要的神经核团之一,位于第三脑室两侧室侧壁,分泌多种激素参与调控机体生理功能。AVP是室旁核大细胞神经元分泌的一种九肽激素,作为应激和免疫反应的直接调节因子,在急性应激时迅速分泌。除了收缩血管及抗利尿作用之外,AVP被发现作用于多个系统,参与垂体功能调节、免疫应激反应,以及认知社会行为(记忆、焦虑、应激行为)[14]。丙泊酚高剂量组处理显著提高室旁核AVP阳性细胞数量,表明麻醉暴露导致机体应激水平提高,而引起下丘脑内分泌的变化。GR是糖皮质激素的受体,在生理性高峰或应激下糖皮质激素水平升高时被激活。GR表达于所有细胞类型,并且在下丘脑室旁核、弓形核、嗅球、皮层、海马CA1、CA2区等区域表达相对较多,而且被认为与认知功能、下丘脑-垂体-肾上腺(HPA)轴的调节、行为反应相关。更重要的是,越来越多研究表明糖皮质激素和其受体与神经元的完整性和存活相关,而这在应激状态和HPA轴异常时尤为明显,并且在亨廷顿病、阿尔兹海默病、帕金森病中异常糖皮质激素及受体表达表明,糖皮质激素及其受体可能参与大脑中神经退行性病变[15-16]。丙泊酚麻醉后,高剂量组中室旁核GR表达明显上调,而低剂量组并无差异。因此,高剂量丙泊酚暴露可能导致机体应激后糖皮质激素水平调节。丙泊酚直接或者通过机体应激间接作用于下丘脑,引起下丘脑内分泌功能改变,连锁性引发HPA轴异常活动。而新生儿正处在大脑发育的关键窗口期,作为神经认知功能活动的重要调节因子,AVP及GR的异常表达增多必然作用于发育期的大脑,进一步可能对神经发育及远期的行为表现产生影响。这可能是新生儿时期丙泊酚暴露导致发育受损及行为异常的机制之一。
小胶质细胞广泛存在于中枢神经系统(CNS)中,作为CNS的免疫效应细胞,其功能相当于脑和脊髓中的巨噬细胞,并且能够分泌各种介质,是中枢神经系统第一道也是最主要的一道免疫防线。应激与免疫变化密切相关。体内外实验证实麻醉对各种免疫细胞存在作用,可以抑制机体的固有免疫功能[17]。有研究表明,脑外伤手术中,采用丙泊酚麻醉后,小胶质细胞活化水平明显下降[18]。本研究中,丙泊酚处理后,下丘脑各个区域Iba1标记的小胶质细胞数量均明显减少,说明丙泊酚能降低小胶质细胞活化水平,而这意味着下丘脑固有免疫功能的损伤,这可能与糖皮质激素的免疫抑制作用相关。免疫防线受损,有害物质蓄积,这可能会引起进一步的下丘脑功能改变。而这是否与丙泊酚的神经毒性作用相关需要进一步的研究。
综上所述,丙泊酚可明显激活下丘脑室旁核相关神经元,提高下丘脑应激水平,引起下丘脑内分泌及HPA轴异常,同时抑制下丘脑固有免疫。下丘脑是内分泌系统和中枢神经系统的重要联系枢纽,与大脑发育及神经发生密切相关。因此,我们推测丙泊酚可能通过影响下丘脑功能,进而引起发育期中枢神经系统改变。这为治疗丙泊酚的神经毒性提供了新的思路及研究靶点。
| [1] | Sinner B, Becke K, Engelhard K. General anaesthetics and the developing brain: an overview[J]. Anaesthesia, 2014, 69(9): 1009–1022. DOI:10.1111/anae.12637 |
| [2] | Han D, Jin J, Fang H, et al. Long-term action of propofol on cognitive function and hippocampal neuroapoptosis in neonatal rats[J]. Int J Clin Exp Med, 2015, 8(7): 10696–10704. |
| [3] | Dimaggio C, Sun L S, Li G. Early childhood exposure to an-esthesia and risk of developmental and behavioral disorders in a sibling birth cohort[J]. Anesth Analg, 2011, 113(5): 1143–1151. DOI:10.1213/ANE.0b013e3182147f42 |
| [4] | Wilder R T, Flick R P, Sprung J, et al. Early exposure to anesthesia and learning disabilities in a population-based birth cohort[J]. Anesthesiology, 2009, 110(4): 796–804. DOI:10.1097/01.anes.0000344728.34332.5d |
| [5] | Huang J, Jing S, Chen X, et al. Propofol Administration During Early Postnatal Life Suppresses Hippocampal Neuro-genesis[J]. Molecular Neurobiology, 2016, 53(2): 1031–1044. DOI:10.1007/s12035-014-9052-7 |
| [6] |
余丹, 景胜, 黄静, 等. 丙泊酚对发育期小鼠大脑梨状皮层神经前体细胞增殖的影响[J].
第三军医大学学报, 2016, 38(7): 731–736.
Yu D, Jing S, Huang J, et al. Effect of propofol on prolifera-tion in neural precursor cells of developing mouse piriform cortex[J]. J Third Mil Med Univ, 2016, 38(7): 731–736. DOI:10.16016/j.1000-5404.201509051 |
| [7] | Zhang H H, Zheng C, Wang B A, et al. Inhibitory effects of propofol on excitatory synaptic transmission in supraoptic nu-cleus neurons in vitro[J]. Sheng Li Xue Bao, 2015, 67(6): 583–590. |
| [8] | Shirasaka T, Yoshimura Y, Qiu D L, et al. The effects of propofol on hypothalamic paraventricular nucleus neurons in the rat[J]. Anesth Analg, 2004, 98(4):1017-1023, table of contents. DOI:10.1213/01.ane.0000107960.89818.35. |
| [9] | Bakos J, Zatkova M, Bacova Z, et al. The Role of Hypotha-lamic Neuropeptides in Neurogenesis and Neuritogenesis[J]. Neural Plast, 2016, 2016: 3276383. DOI:10.1155/2016/3276383 |
| [10] | Dobbing J, Sands J. Comparative aspects of the brain growth spurt[J]. Early Hum Dev, 1979, 3(1): 79–83. DOI:10.1016/0378-3782(79)90022-7 |
| [11] | Yu D, Jiang Y, Gao J, et al. Repeated exposure to propofol potentiates neuroapoptosis and long-term behavioral deficits in neonatal rats[J]. Neurosci Lett, 2013, 534: 41–46. DOI:10.1016/j.neulet.2012.12.033 |
| [12] | Lukas M, Neumann I D. Oxytocin and vasopressin in rodent behaviors related to social dysfunctions in autism spectrum disorders[J]. Behav Brain Res, 2013, 251: 85–94. DOI:10.1016/j.bbr.2012.08.011 |
| [13] | Cesar-Tognoli L M, Salamoni S D, Tavares A A, et al. Effects of spider venom toxin PWTX-I(6-Hydroxytrypargine)on the central nervous system of rats[J]. Toxins(Basel), 2011, 3(2): 142–162. DOI:10.3390/toxins3020142 |
| [14] | Rotondo F, Butz H, Syro L V, et al. Arginine vasopressin(AVP): a review of its historical perspectives, current re-search and multifunctional role in the hypothalamo-hypophy-sial system[J]. Pituitary, 2016, 19(4): 345–355. DOI:10.1007/s11102-015-0703-0 |
| [15] | De Kloet E R, Vreugdenhil E, Oitzl M S, et al. Brain corti-costeroid receptor balance in health and disease[J]. Endocr Rev, 1998, 19(3): 269–301. DOI:10.1210/edrv.19.3.0331 |
| [16] | Vyas S, Maatouk L. Contribution of glucocorticoids and glu-cocorticoid receptors to the regulation of neurodegenerative processes[J]. CNS Neurol Disord Drug Targets, 2013, 12(8): 1175–1193. DOI:10.2174/187152731131200125 |
| [17] | Kurosawa S, Kato M. Anesthetics, immune cells, and im-mune responses[J]. J Anesth, 2008, 22(3): 263–277. DOI:10.1007/s00540-008-0626-2 |
| [18] | Luo T, Wu J, Kabadi S V, et al. Propofol limits microglial activation after experimental brain trauma through inhibition of nicotinamide adenine dinucleotide phosphate oxidase[J]. Anesthesiology, 2013, 119(6): 1370–1388. DOI:10.1097/ALN.0000000000000020 |



