甲状腺癌是内分泌系统最常见的恶性肿瘤。近年来,全球甲状腺癌的发病率呈逐年上升趋势,尤以甲状腺乳头状癌更为明显,女性发病率是男性的3倍,且育龄期女性发病率增加,绝经后妇女发病率呈逐渐下降的趋势,表明雌激素可能与甲状腺乳头状癌的发生、发展相关[1]。人三叶草因子1(trefoil factor family 1,TFF1) 是三叶草因子家族(trefoil factor family,TFF)中的成员,是具有类似生长因子般促进细胞存活、增殖及迁移能力的一类分泌蛋白[2],可以通过雌激素诱导产生,并且与雌激素受体(estrogen receptor,ER)有关[3]。其机制是雌二醇(estradiol,E2)引起ERα转录激活区(AF-1) N末端118位丝氨酸高度磷酸化[4-5],磷酸化的ERα随即被招募到TFF1启动子,对下游基因的转录激活起到重要作用[6]。上述机制在乳腺癌、肝癌、肺癌、子宫内膜癌中发生、发展已有研究报道,但是TFF1在甲状腺乳头状癌发生、发展中的作用还不清楚。本研究以人甲状腺乳头状癌K-1细胞为模型,探讨雌激素对TFF1分泌的影响及相关雌激素受体亚型与TFF1分泌的关系,为甲状腺乳头状癌的临床治疗及预后提供实验依据。
1 材料与方法 1.1 材料 1.1.1 细胞系人甲状腺乳头状癌K-1细胞系(香港中文大学陈功教授惠赠)。
1.1.2 主要试剂17β-E2、ERβ激动剂(propylpyrazoletriol,PPT)、ERβ激动剂(diarylpropionitrile,DPN)购自Sigma公司;RIPA裂解液、SDS-PAGE配胶试剂盒和免疫印迹化学发光剂ECL购自碧云天生物技术有限公司;兔抗人TFF1和β-actin多克隆抗体购自Bioworld公司;兔抗人ERα和ERβ多克隆抗体购自Abcam公司;TFF1-ELISA试剂盒购自USCN公司;Lipofectamine RNAiMAX购自Invitrogen公司;EZ ChIP Kit购自Millipore公司;ERα siRNA、ERβ siRNA、scrambled siRNA序列由上海生工生物工程有限公司合成;Costar Transwell(8.0 μm孔径)购自Corning公司;MTT购自Sigma公司。
1.2 细胞培养和药物处理将人甲状腺乳头状癌K-1细胞贴壁培养于含10%胎牛血清、100 μg/mL青霉素和100 μg /mL链霉素的RPMI1640培养基,于37 ℃、5% CO2饱和湿度孵箱中培养,常规换液传代,取对数期细胞进行后续实验。
1.2.1 E2对TFF1分泌的影响用10 nmol/L E2分别处理K-1细胞0、3、6、12、24 h和48 h,同一时间收集细胞上清,TFF1-ELISA试剂盒检测TFF1含量。
1.2.2 与TFF1分泌相关的雌激素受体亚型对其分泌的影响分别用10 nmol/L E2、PPT及DPN处理细胞24 h,TFF1-ELISA试剂盒检测细胞上清中TFF1分泌量。
1.2.3 ERα、ERβ对TFF1分泌的影响用10 nmol/L E2分别处理正常细胞、转染ERα siRNA、转染ERβ siRNA、阴性对照(转染scrambled siRNA)后的K-1细胞24 h,TFF1-ELISA试剂盒检测细胞上清中TFF1含量。
1.3 siRNA的合成与转染具体操作步骤见文献[7]报道的方法。
1.4 细胞总蛋白提取和Western blot检测蛋白表达水平具体操作步骤见文献[7]报道的方法。
1.5 TFF1-ELISA试剂盒测定K-1细胞上清中TFF1含量由于TFF1是分泌蛋白,Western blot检测蛋白条带不明显,改用TFF1-ELISA试剂盒测定。同一时间收集细胞上清,按说明书测定细胞上清中TFF1含量,每组做3个复孔,在450 nm波长下测定光密度值[D(450)],最后取平均值。
1.6 染色体免疫共沉淀(chromatin immune-precipitation analysis,ChIP)分析ChIP按试剂盒说明书进行。体外交联和裂解细胞,超声断裂DNA,加特异性抗体(anti-ERα、anti-ERβ和anti-IgG)进行免疫共沉淀,洗脱与解交联,DNA纯化,最后以沉淀所得的DNA为模板,进行PCR扩增分析。ChIP引物为针对TFF1基因启动子区域的引物对,上游引物为:5′-GGTCGCCTTTGGAGCAGAG-3′;下游引物为:5′-AGGACCAGGGCGCAGATC-3′。
1.7 MTT检测E2对K-1细胞增殖的影响细胞悬液按3 000个/孔接种于96孔板,每孔100 μL,每组设8个孔(含6个复孔,2个调零孔),孵育24 h后,实验组用10 nmol/L E2处理,对照组加PBS,继续培养24 h,每孔加入20 μL MTT(5 mg/mL),继续培养4~6 h,弃培养液,每孔加入150 μL DMSO,充分溶解,震荡10 min,显色,570 nm处测定光密度值[D(570)],以各组平均值表示细胞数目。
1.8 Transwell检测E2对K-1细胞迁移能力的影响为保证接种细胞数目一致,先对细胞进行预处理后再接种于小室。将K-1细胞与10 nmol/L E2在培养瓶中共同孵育24 h,移除原培养基,用无血清培养基洗涤数次;用胰酶消化并用无血清培养基收集细胞,分别将不含血清的细胞悬液按1×105个/室接种于上室,每室200 μL,下室加600 μL含10%FBS的培养基,孵育24 h后移除上、下室的液体,下室加入600 μL甲醇固定细胞20 min,移除甲醇,用棉签擦除未穿过膜的细胞,下室加入600 μL 0.1%结晶紫染色10 min,用PBS洗涤2~3次,在显微镜下观察细胞并拍照。
1.9 统计学分析采用SPSS 17.0统计软件进行分析,数据以x±s表示,实验重复3次,采用t检验、单因素方差分析及Dunnett事后分析统计学方法。检验水准:α=0.05。
2 结果 2.1 E2对K-1细胞上清中TFF1含量的影响用10 nmol/L E2处理K-1细胞0、3、6、12、24 h和48 h,随着处理时长的增加,K-1细胞上清中TFF1含量逐渐增高,在24 h达到峰值,随后降低(P < 0.05,图 1)。
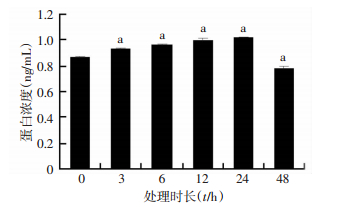
|
| a: P < 0.05,与0 h比较 图 1 ELISA检测E2处理不同时长K-1细胞上清中TFF1蛋白含量 |
2.2 ERα和ERβ在K-1细胞中的表达
ERα、ERβ在K-1细胞中均有表达,且ERα表达水平显著高于ERβ[(0.825±0.018)vs (0.573±0.016),P < 0.05]。
2.3 E2、PPT、DPN对K-1细胞上清中TFF1含量的影响E2、PPT处理K-1细胞24 h,与对照组相比,细胞上清中TFF1含量均升高(P < 0.05),且PPT作用效果更明显;DPN处理K-1细胞24 h,与对照组相比细胞上清中TFF1含量显著下降(P < 0.05,图 2)。
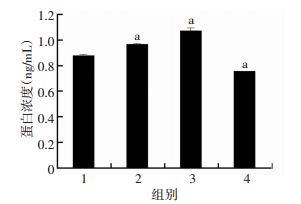
|
| 1:对照组,2:E2处理组,3:PPT处理组,4:DPN处理组a: P < 0.05,与对照组比较 图 2 ELISA检测E2、PPT及DPN处理过的K-1细胞上清中TFF1含量 |
2.4 ERα siRNA、ERβ siRNA在K-1细胞中的干扰效果
分别用ERα siRNA和ERβ siRNA转染K-1细胞后,ERα、ERβ蛋白表达水平均显著低于对照组(设为1) 与阴性对照组(P < 0.05),对照组和阴性对照组均差异无统计学意义(P > 0.05,图 3)。
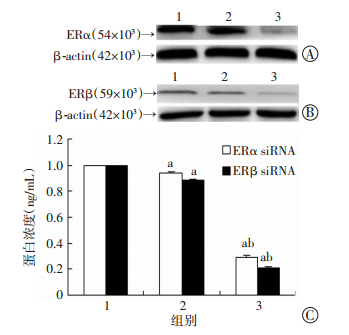
|
|
1:对照组,2:阴性对照组,3:ERα siRNA转染组 A、B:Western blot检测结果;C:半定量分析结果a:P < 0.05,与对照组比较;b:P < 0.05,与阴性对照组比较 图 3 K-1细胞中ERα siRNA及ERβ siRNA的干扰效果 |
2.5 ERα siRNA、ERβ siRNA对K-1细胞上清中TFF1含量的影响
与E2处理组相比,ERα siRNA转染组细胞上清中TFF1含量降低(P < 0.05);ERβ siRNA转染组细胞上清中TFF1含量反而升高(P < 0.05);而阴性对照组与E2处理组相比,TFF1含量差异无统计学意义(P > 0.05,图 4)。
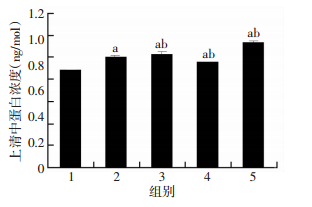
|
| 1:对照组,2:E2处理组,3:阴性对照组,4:ERα siRNA转染组,5:ERβ siRNA转染组a:P < 0.05,与对照组比较;b:P < 0.05,与E2处理组比较 图 4 ELISA检测各组K-1细胞上清中TFF1含量 |
2.6 ERα、ERβ与TFF1基因启动子间的相互作用
用ERβ抗体及阴性IgG抗体(阴性对照)沉淀所得DNA进行PCR扩增,无扩增产物条带;用未经抗体沉淀的阳性对照DNA扩增的产物电泳条带最强;用ERα抗体沉淀所得DNA作为模板扩增出了TFF1基因的条带(图 5)。

|
| 1:对照组,2:E2处理组,3:阴性对照组,4:ERα siRNA转染组,5:ERβ siRNA转染组 图 5 ERα、ERβ与TFF1基因启动子间的相互作用 |
2.7 E2对K-1细胞增殖的影响
MTT检测E2对K-1细胞增殖的影响。与对照组相比,E2处理后的K-1细胞D(570) 值较大[(0.354±0.07) vs (0.210±0.000),P < 0.05],细胞数目较多,增殖较明显。
2.8 E2对K-1细胞迁移能力的影响Transwell小室检测E2对K-1细胞迁移的影响,显微镜下观察下室的细胞并拍照,与对照组相比,E2处理后的小室下层K-1细胞数目较多,迁移能力增强(图 6)。

|
| A:处理前; B:处理后 图 6 Transwell小室检测E2对K-1细胞迁移能力的影响(结晶紫) |
3 讨论
近期研究表明TFF1与癌症的发生、发展密切相关,可被雌激素及多种生长因子调节,具有促进细胞增殖、分化及血管生成,促进细胞迁移,抑制细胞凋亡的作用[8-10]。甲状腺癌是一种与雌激素相关的内分泌系统肿瘤。已有研究表明,雌激素可促进乳腺癌细胞MCF-7、肝癌细胞HepG2中TFF1的分泌[11-12]。然而,雌激素是否可以引起甲状腺癌细胞中TFF1分泌尚不清楚。
本研究发现,E2可以促进K-1细胞TFF1的分泌,且有时间依赖性。雌激素信号介导主要通过ERα和ERβ两种雌激素受体亚型[13],在乳腺癌、宫颈癌细胞中,ERα和ERβ同时存在,且ERβ表达量较低,ERβ对雌激素引起的基因上调及ERα协同的相关基因转录激活均起抑制作用[14-15]。乳腺、宫颈和甲状腺均为激素依赖性器官,均受下丘脑垂体腺体轴调控。本研究也证实在K-1细胞中,ERα、ERβ均有表达,且ERβ表达水平明显低于ERα,结果与文献[14-15]报道一致。这表明ERα和ERβ的相对表达量对甲状腺癌发生、发展有着重要意义。用前期实验方法探究与E2促进甲状腺乳头状癌K-1细胞TFF1分泌的相关雌激素受体亚型[16]。结果显示,PPT、ERβ siRNA对E2促进的TFF1分泌有协同作用;而DPN、ERα siRNA对E2促进的TFF1分泌有抑制作用。TFF1基因启动子上的-405~-393区域含有雌激素应答元件,E2引起ERα转录激活区(AF-1)118位Ser高度磷酸化,ERα再结合到ERE上,进一步与相关转录辅因子相结合,启动下游基因的转录[12, 16]。ChIP结果表明ERα能够与TFF1启动子上游的ERα结合位点结合,启动下游基因的转录,而ERβ不能与TFF1基因启动子区域相结合。
综上,本实验证实ERα对E2促进的K-1细胞中TFF1分泌起协同作用。而ERβ对E2促进的分泌起负调节作用。ER通过两种方式调节基因的表达:一为经典途径,通过与目的基因启动子上游的雌激素应答元件结合从而调节下游基因的表达;二为非经典途径,通过与其他转录因子及蛋白之间的相互作用来调控目的基因的表达。TFF1启动子上含有AP-1结合位点,AP-1是由c-fos和c-jun组成的二聚体,ERα与共激活剂被招募到AP-1位点,刺激下游基因转录。而ERβ不能与TFF1基因启动子区域相结合,其可能通过其他机制如抑制c-fos转录等来参与调控[17]。E2可以通过ERα促进TFF1分泌,进而促进K-1细胞增殖和迁移。这一研究对甲状腺癌等雌激素相关内分泌系统肿瘤的发生、发展与预后及TFF1蛋白的研究及疾病的发生、发展具有重要意义。
| [1] | RAHBARI R, ZHANG L, KEBEBEW E. Thyroid cancer gender disparity[J]. Future Oncol, 2010, 6: 1771–1779. DOI:10.2217/fon.10.127 |
| [2] | PERRY J K, KANNAN N, GRANDISON P M, et al. Are trefoil factors oncogenic?[J]. Trends in Endocrinol Metab, 2008, 19(2): 74–81. DOI:10.1016/j.tem.2007.10.003 |
| [3] | PELDEN S, INSAWANG T, THUWAJIT C, et al. The trefoil factor 1 (TFF1) protein involved in doxorubicin?induced apoptosis resistance is upregulated by estrogen in breast cancer cells[J]. Oncol Rep, 2013, 30(3): 1518–1526. DOI:10.3892/or.2013.2593 |
| [4] | LA ROSA P, PELLEGRINI M, TOTTA P, et al. Xenoestrogens alter estrogen receptor (ER) α intracellular levels[J]. PLoS One, 2014, 9(2): e88961. DOI:10.1371/journal.pone.0088961 |
| [5] | GAO Q G, CHAN H Y, MAN C W, et al. Differential ERα-mediated rapid estrogenic actions of ginsenoside Rg1 and estren in human breast cancer MCF-7 cells[J]. J Steroid Biochem Mol Biol, 2014, 141: 104–112. DOI:10.1016/j.jsbmb.2014.01.014 |
| [6] | METIVIER R, PENOT G, HUBNER M R, et al. Estrogen receptor-alpha directs ordered, cyclical, and combinatorial recruitment of cofactors on a natural target promoter[J]. Cell, 2003, 115(6): 751–763. DOI:10.1016/S0092-8674(03)00934-6 |
| [7] |
莫小梅, 朱平, 刘智敏, 等. 17β-雌二醇对人甲状腺乳头状癌BCPAP细胞Hsp27表达的影响及作用机制[J].
基础医学与临床, 2016, 36(10): 1348–1353.
MO X M, ZHU P, LIU Z M, et al. Effect of 17β-estradiol on the expression of Hsp27 by papillary thyroid cancer BCPAP cells and its mechanism[J]. Basic Clin Med, 2016, 36(10): 1348–1353. DOI:10.16352/j.issn.1001-6325.2016.10.005 |
| [8] | TAUPIN D, PODOLSKY D K. Trefoil factors: initiators of mucosal healing[J]. Nat Rev Mol Cell Biol, 2003, 4(9): 721–732. DOI:10.1038/nrm1203 |
| [9] | REGALO G. Trefoil factors: from ulceration to neoplasia[J]. Cell Mol Life Sci, 2005, 62(24): 2910–2915. DOI:10.1007/s00018-005-5478-4 |
| [10] | EMAMI S. Trefoil factor family (TFF) peptides and cancer progression[J]. Peptides, 2004, 25(5): 885–898. DOI:10.1016/j.peptides.2003.10.019 |
| [11] | BARON S, ESCANDE A, ALBÉROLA G, et al. Estrogen receptor α and the activating protein-1 complex cooperate during insulin-like growth factor-I-induced transcriptional activation of the pS2/TFF1 gene[J]. J Biol Chem, 2007, 282(16): 11732–11741. DOI:10.1074/jbc.M610079200 |
| [12] | BARKHEM T, HALDOSÉN L A, GUSTAFSSON J A, et al. PS2 gene expression in HepG2 cells: complex regulation through crosstalk between the estrogen receptor, an estrogen-responsive element, and the activator protein 1 response element[J]. Mol Pharmacol, 2002, 61(6): 1273–1283. DOI:10.1124/mol.61.6.1273 |
| [13] | PLANEY S L, KUMAR R, ARNOTT J A. Estrogen receptors (ERα versus ERβ): friends or foes in human biology?[J]. J Recept Signal Transduct Res, 2014, 34(1): 1–5. DOI:10.3109/10799893.2013.853188 |
| [14] | CHANG E C, FRASOR J, KOMM B, et al. Impact of estrogen receptor beta on gene networks regulated by estrogen receptor alpha in breast cancer cells[J]. Endocrinology, 2006, 147(10): 4831–4842. DOI:10.1210/en.2006-0563 |
| [15] | WILLIAMS C, EDVARDSSON K, LEWANDOWSKI S A, et al. A genome-wide study of the repressive effects of estrogen receptor beta on estrogen receptor alpha signaling in breast cancer cells[J]. Oncogene, 2008, 27(7): 1019–1032. DOI:10.1038/sj.onc.1210712 |
| [16] | BERRY M, NUNEZ A M, Chambon P. Estrogen-responsive element of the human pS2 gene is an imperfectly palindromic sequence[J]. J Biol Chem, 1989, 86(4): 1218–1222. |
| [17] | MATTHEWS J, WIHLÉN B, TUJAGUE M, et al. Estrogen receptor (ER) beta modulates ER alpha-mediated transcriptional activation by altering the recruitment of c-Fos and c-Jun to estrogen-responsive promoters[J]. Mol Endocrinol, 2006, 20(3): 534–543. DOI:10.1210/me.2005-0140 |



