近年来,跨膜转运蛋白作为药物处置关键因素的重要性已经越来越得到重视。已证实有机阴离子转运体蛋白(OATP,溶质运载蛋白家族SLCO,原名SLC21A)起着药物性肝炎发生和发展的关键作用。OATP1B1/ SLCO1B1有助于HMG-CoA还原酶抑制剂的肝细胞膜转运。HMG-CoA还原酶抑制剂,也称为他汀类药物,是治疗高胆固醇血症最有效的药物。这些药物在大多数病人耐受良好,但主要的临床并发症是肌病和横纹肌溶解[1]。到目前为止,SLCO1B1的基因多态性是导致他汀类药物引导肌病风险的主要遗传因素[2]。
SLCO1B1基因长约109 kb,位于染色体12p12.2-p12.1,包含14个外显子和1个非编码外显子。它的主要功能是负责编码特异性分布于肝细胞基底膜外侧的有机阴离子转运蛋白OATP1B1。它由691个氨基酸构成,包含14个跨膜区和1个大的第5胞外环。它是主要的Na+非依赖性胆汁盐摄取系统。SLCO1B1基因的两种常见的多态性是T521C和A388G,他们组成3种单倍型:SLCO1B1*1b,*5和*15。多数研究关注的是SLCO1B1 T521C的多态性,这与摄取的有机阴离子的活性降低有关。理论上OATP1B1的该功能受损会降低他汀类药物的肝摄取,从而导致增加全身性暴露于他汀类药物的风险。OATP1B1基因521T>C的多态性与增加全身暴露于他汀类药物有关。关于OATP1B1 T521C基因多态性和他汀类药物的药代动力学之间的关联的研究不少,但尚无明确结论。据我们所知,还没有此方面的Meta分析。为了准确地评价OATP1B1基因多态性和HMG-CoA还原酶抑制剂的药代动力学之间的关系,我们通过病例对照研究的Meta分析,试图了解在不同种族OATP1B1 T521C基因多态性影响他汀类药物的药物代谢动力学的情况。
1 资料与方法 1.1 文献来源本研究是根据流行病学组观测性研究的Meta分析的建议进行的[3]。Meta分析方法参照已经发表的单核苷酸多态性(SNP)对地高辛C3435T药动学的影响Meta分析研究[4]。计算机检索Pubmed、Embase、Cochrane Library、中国期刊全文数据库、万方、维普数据库,检索年限为从建库到2016年12月2日。收集有关SLCO1B1 T521C基因多态性和他汀类药物药代动力学的研究。检索词的同义词通过中国生物医学数据库主题词下的词目进行查找,检索词主要包括:“SLCO1B1”“OATP1B1”“OATPc”“OATP2”“LST1”“HMG-CoA reductase inhibitor”“ statins”“Atorvatatin”“Pravastatin”“Rosuvastatin”“ Pitavastatin”“fluvastatin”“simvastatin”“cerivastatin”“mevastatin”“lovastatin”“fluvastatin”和“pharmacodynamics”“Drug Kinetics” “Kinetics,Drug”“blood concentration”等。
1.2 文献纳入、排除标准纳入标准:① 研究类型:国内外有关SLCO1B1 T521C基因多态性对他汀类药物药物动力学影响的研究;② 研究对象:用他汀类药物治疗或预防高血脂的患者或健康人,其年龄、性别、种族不限,对象还需经血药浓度检测及对SLCO1B1基因T521C位点多态性进行检测,检测方法不限;③ 暴露因素:按照基因检测的结果,将患者分为野生型纯合子基因型组(TT)、突变纯合子基因型组(CC)、突变杂合子基因型组(TC)、突变混合基因型组(TC+CC);④ 结局指标:不同基因型他汀类药物的浓度-时间曲线下面积(AUC0~6 h、AUC0~12 h、AUC0~24 h、AUC0-inf),峰浓度(Cmax)和口服清除率(CL/F), 结果表达为x±s;⑤ 语种:语言限定为英文和中文。排除标准:① 综述型文章,病例报道,会议摘要,每组基因型与对应结局指标缺少,且通过联系作者等途径仍无法获得的文章,重复发表的研究;② 文献数据不全,不能提取需要的数据资料的排除。
1.3 文献资料的提取由2名评价者独立筛选文献,并制定标准数据提取表;同时独立提取资料,不同意见则通过讨论解决。最终决定从每篇文献中提取以下信息:① 第一作者、发表年份、研究地区、种族、样本量、治疗方法、基因分型方法、基因型及其例数。② 通过浓度-时间曲线下面积(AUC0~6 h、AUC0~12 h、AUC0~24 h、AUC0-inf)和最大血浆药物浓度(Cmax)和口服清除率(CL / F)等;测量他汀类药物暴露的平均值、标准差、置信区间。如果该文章表中未提供数据,我们从文章的正文提取。如果分别提供了最小值、中位数和最大值,而没有提供均数和标准差,均数和标准差使用Chowbay等[4]所述的方法估算。如果这项研究提供的是中位数和四分位数范围而不是均数和标准差,我们使用Hozo等[5]所述的方法估算均数和标准差。
1.4 统计学方法采用RevMan 5.3软件进行Meta分析。使用森林图和异质性检验来检验每一次荟萃分析的异质性,对于所有荟萃分析采用固定效应或随机效应模型进行Meta分析。若P>0.1或I2<50%,则视为研究间无明显异质性,采用固定效应模型进行统计学分析。若P<0.1或I2>50%,说明研究间存在异质性,则采用亚组分析(如种族、他汀类药物的种类等分亚组)或敏感度分析处理。因部分Meta分析的异质性检验P<0.1,不适合固定效应模型,为了保持分析的一致性,采用了相对使用性较广的随机效应模型[6]。计量资料用x±s表示,如果文献提供的是区间值(中位数、最小值及最大值),则依据Chowbay等提供的公式,将区间值换算为x±s。合并分析结果,则用均数差(MD)来表示。连续性变量则采用均数差(WMD)或标准均数差(SMD)及其95%CI表示。若Meta分析结果的95%CI没有包括1(对于OR)或者0(对于WMD或SMD)则认为有统计学,反之则认为没有统计学差异。
2 结果 2.1 文献检索及筛选结果共检索到1 166篇文献,筛除重复文献后得到相关文献589篇,阅读标题和摘要后排除明显不相关文献得到文献72篇。阅读全文后,最终得到符合标准的文献25篇,其英文文献23篇,中文文献2篇[7-31],流程见图 1。
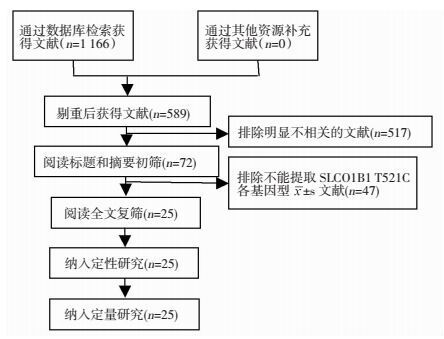
|
| 图 1 文献筛选过程详细流程 |
2.2 纳入研究的基本资料
纳入25项研究,各研究的基本资料见表 1。
| 研究 | 受试者 | SNP | 基因型(例) | AUC0~6 h(x±s,ng·h/mL) | AUC0~12 h(x±s,ng·h/ mL) | AUC0~24 h(x±s,ng·h/mL) | AUC0-inf(x±s,ng·h /mL) | Cmax(x±s,ng/mL) | CL/F(L/h) |
| Mwinyi(2004)[7] | 白种人 | Pravastatin | TT(20) | 94.65±56.90 | 47.50±31.83 | ||||
| (40 mg) | TC(10) | 163.00±64.60 | 84.30±32.10 | ||||||
| Niemi(2004)[8] | 白种人 | Pravastatin | TT(28) | 89.50±64.00 | 40.30±28.90 | ||||
| (40 mg) | TC(11) | 184.70±105.00 | 84.40±56.60 | ||||||
| CC(2) | 140.10±39.30 | 51.90±19.00 | |||||||
| TC+CC(13) | 177.84±97.96 | 79.40±53.37 | |||||||
| Chung(2005)[9] | 亚洲人 | Pitavastatin | TT(13) | 49.61±4.24 | 16.66±5.49 | ||||
| (1~8 mg) | TC(11) | 68.10±16.30 | 29.40±9.60 | ||||||
| Lee(2005)[10] | 亚洲人 | Rosuvastatin | TT(110) | 354.41±104.90 | 42.74±12.68 | ||||
| (40 mg) | TC(26) | 410.54±133.94 | 49.51±18.76 | ||||||
| CC(5) | 416.00±0.00 | 58.60±0.00 | |||||||
| TC+CC(31) | 411.42±122.29 | 50.97±17.46 | |||||||
| Hedman(2006)[10] | 白种人 | Pitavastatin | TT(14) | 34.50±21.70 | 18.40±15.60 | ||||
| (0.30±0.13) mg/kg | TC(6) | 25.70±20.00 | 9.40±9.60 | ||||||
| Hedman(2006)[11] | 白种人 | Pitavastatin | TT(9) | 366.30±223.50 | 145.78±9.80 | ||||
| (0.32±0.16) mg/kg | TC(3) | 137.80±41.00 | 78.00±10.30 | ||||||
| Maeda(2006)[12] | 亚洲人 | pravastatin | TT(12) | 58.15±24.36 | |||||
| (10 mg) | TC(11) | 55.11±25.24 | |||||||
| Niemi(2006)[13] | 白种人 | fluvastatin | TT(16) | 422.70±132.10 | 304.00±175.20 | ||||
| (40 mg) | TC(12) | 479.50±215.00 | 291.40±198.90 | ||||||
| CC(4) | 503.40±251.20 | 264.30±111.10 | |||||||
| TC+CC(16) | 485.48±215.95 | 284.63±204.40 | |||||||
| Niemi(2006)[13] | 白种人 | fluvastatin | TT(16) | 150.30±78.10 | 68.50±38.90 | ||||
| (40 mg) | TC(12) | 164.80±85.70 | 73.80±42.20 | ||||||
| CC(4) | 287.40±102.90 | 141.60±46.80 | |||||||
| TC+CC(16) | 195.45±102.52 | 90.75±51.61 | |||||||
| Pasanen(2006)[14] | 白种人 | simvastatin | TT(16) | 24.70±9.60 | 26.40±10.50 | 8.90±4.7 | |||
| (40 mg) | TC(11) | 28.80±14.40 | 31.90±17.60 | 10.20±4.9 | |||||
| CC(4) | 34.50±13.50 | 37.90±14.70 | 13..00±3.7 | ||||||
| TC+CC(15) | 30.32±13.93 | 33.50±16.59 | 10.95±4.66 | ||||||
| Pasanen(2007)[16] | 白种人 | atorvastatin | TT(16) | 24.20±8.60 | 5.70±2.57 | ||||
| (20 mg) | TC(12) | 36.20±20.30 | 8.03±3.72 | ||||||
| CC(4) | 59.30±17.40 | 10.06±9.02 | |||||||
| TC+CC(16) | 41.98±21.67 | 8.54±5.22 | |||||||
| Pasanen(2007)[16] | 白种人 | rosuvastatin | TT(16) | 35.00±18.10 | 4.21±2.41 | ||||
| (10 mg) | TC(12) | 55.00±22.70 | 6.38±3.20 | ||||||
| CC(4) | 56.70±5.10 | 7.53±1.20 | |||||||
| TC+CC(16) | 55.43±19.59 | 6.67±2.84 | |||||||
| Richard(2007)[15] | 白种人 | pravastatin | TT(88) | 82.54±62.15 | 45.21±33.86 | ||||
| (40 mg) | TC(17) | 107.28±43.15 | 57.30±24.92 | ||||||
| 非洲美国人 | CC(2) | 167.00±31.40 | 75.60±2.10 | ||||||
| TC+CC(19) | 113.57±45.44 | 59.23±24.20 | |||||||
| Choi(2008)[18] | 亚洲人 | rosuvastatin | TT(17) | 111.11±49.30 | 10.59±5.04 | ||||
| (10 mg) | TC(9) | 125.67±45.04 | 11.73±3.84 | ||||||
| CC(3) | 191.00±31.00 | 21.20±5.10 | |||||||
| TC+CC(12) | 142.00±50.23 | 14.10±5.81 | |||||||
| Deng(2008)[19] | 亚洲人 | pravastatin | TT(6) | 275.21±95.60 | 140.92±41.00 | 2.30±0.70 | |||
| (40 mg) | CC(5) | 547.29±166.00 | 298.80±132.000 | 1.11±0.30 | |||||
| Deng(2008)[19] | 亚洲人 | pitavastatin | TT(6) | 281.26±102.00 | 84.58±42.10 | 0.12±0.05 | |||
| (40 mg) | CC(5) | 736.85±192.00 | 264.00±77.90 | 0.04±0.01 | |||||
| Fang(2008)[20] | 亚洲人 | rosuvastatin | TT(6) | 50.00±10.80 | 3.22±1.20 | 415.00±86.60 | |||
| (20 mg) | TC(6) | 71.30±15.80 | 3.34±0.94 | 296.00±87.30 | |||||
| CC(6) | 72.70±10.20 | 4.78±0.86 | 280.00±47.20 | ||||||
| TC+CC(12) | 72.00±12.89 | 4.06±1.14 | 288.00±67.43 | ||||||
| Kalliokoski(2008)[21] | 白种人 | atorvastatin | TT(12) | 5.30±1.90 | 5.00±2.30 | ||||
| (40 mg) | TC(6) | 5.50±1.40 | 4.80±0.80 | ||||||
| CC(6) | 8.90±2.50 | 6.60±2.60 | |||||||
| TC+CC(12) | 7.20±2.62 | 5.70±2.06 | |||||||
| Suwannakul(2008)[22] | 亚洲人 | pravastatin | TT(4) | 48.00±32.00 | 20.00±13.00 | 6.30±6.00 | |||
| (40 mg) | TC(2) | 38.00±0.00 | 14.00±0.00 | 3.70±0.00 | |||||
| CC(4) | 56.00±43.00 | 19.00±16.00 | 3.90±2.50 | ||||||
| TC+CC(6) | 50.00±34.58 | 17.33±12.66 | 3.83±12.39 | ||||||
| Wen aiping(2008)[17] | 亚洲人 | pravastatin | TT(9) | 246.76±69.83 | 116.06±46.22 | 168.12±3.20 | |||
| (40 mg) | TC(8) | 315.36±58.44 | 173.36±36.23 | 126.96±24.68 | |||||
| CC(1) | 660.05±0.00 | 401.76±59.60 | 59.60±0.00 | ||||||
| TC+CC(9) | 353.65±58.44 | 198.73±36.23 | 119.47±24.68 | ||||||
| He YJ(2009)[23] | 亚洲人 | atorvastatin | TT(6) | 27.40±7.20 | 3.40±0.90 | 1 580.80±563.60 | |||
| (40 mg) | TC(6) | 31.60±4.40 | 5.70±1.60 | 1282.40±157.70 | |||||
| CC(4) | 56.90±37.20 | 12.10±8.50 | 882.90±376.20 | ||||||
| TC+CC(10) | 41.72±25.35 | 8.26±6.06 | 1122.60±321.79 | ||||||
| Lee YJ(2010)[24] | 亚洲人 | atorvastatin | TT(17) | 66.30±22.70 | 17.10±8.40 | ||||
| (20 mg) | TC(8) | 80.70±18.50 | 14.90±5.80 | ||||||
| CC(3) | 148.20±22.10 | 21.50±11.30 | |||||||
| TC+CC(11) | 99.11±36.49 | 16.70±7.65 | |||||||
| 隋双明(2011)[25] | 亚洲人 | rosuvastatin | TT(7) | 174.68±67.88 | 18.62±6.67 | 128.90±44.93 | |||
| (20 mg) | TC+CC(7) | 324.83±101.05 | 31.51±8.57 | 68.30±26.37 | |||||
| Chang-Ik Choi(2012)[26] | 亚洲人 | Pitavastatin | TT(20) | 164.60±41.30 | 48.30±13.40 | 13.10±3.90 | |||
| (2 mg) | TC(13) | 172.30±47.80 | 65.10±22.10 | 12.30±3.10 | |||||
| CC(5) | 285.50±14.50 | 106.70±15.10 | 6.90±0.40 | ||||||
| TC+CC(18) | 203.74±66.21 | 76.66±27.68 | 10.80±3.61 | ||||||
| Q.Zhou(2012)[27] | 亚洲人 | Fluvastatin | TT(10) | 588.47±266.25 | 551.66±232.44 | ||||
| (40 mg) | TC(2) | 672.71±175.36 | 548.67±9.89 | ||||||
| CC(5) | |||||||||
| Quan Zhou(2013)[28] | 亚洲人 | Simvastatin | TT(13) | 40.15±6.99 | 9.81±2.46 | ||||
| (40 mg) | TC+CC(4) | 40.88±7.24 | 9.9±2.60 | ||||||
| Jie Zhu(2013)[29] | 亚洲人 | pitavastatin | TT(9) | 92.87±30.05 | 92.83±18.92 | ||||
| (4 mg/d) | TC(3) | 132.25±31.67 | 119.20±23.58 | ||||||
| Aleksi(2015)[30] | 白种人 | Lovastatin | TT(22) | 34.11±4.07 | 3.06±0.68 | ||||
| (40 mg) | CC(5) | 30.30±0.51 | 3.80±0.65 | ||||||
| MEI liu(2016)[31] | 亚洲人 | Rosuvastatin | TT(43) | 167.70±78.50 | 18.10±10.20 | 145.90±86.90 | |||
| (20 mg) | TC+CC(18) | 282.40±176.80 | 28.90±15.50 | 89.20±40.30 |
2.3 Meta分析结果
纳入的25个研究[7-31],累积样本量903例,Meta分析结果见表 2。
| 研究 | n | P | 95%CI |
| AUC0~6 h全部研究 | |||
| TT-TC | 152 | 0.29 | 0.72(0.24~1.19) |
| TT-(TC+CC) | 125 | 0.08 | 0.93(-0.08~1.95) |
| 白种人的研究 | |||
| TT-TC | 97 | 0.11 | 0.65(-0.14~1.45) |
| AUC0~12 h全部研究 | |||
| TT-TC | 66 | 0.11 | 0.78(-0.07~1.63) |
| TT-CC | 50 | 0.89 | 0.86(-0.04~1.75) |
| TT-(TC+CC) | 72 | 0.19 | 0.80(0.14~1.75) |
| AUC0~24 h全部研究 | |||
| TT-TC | 41 | 0.26 | -0.40(-1.24~0.44) |
| TT-CC | 35 | 0.18 | -0.50(-1.64~0.63) |
| AUC0-inf全部研究 | |||
| TT-TC | 469 | 0.39 | 0.51(0.29~0.72) |
| TT-CC | 342 | 0.06 | 1.80(1.31~2.29) |
| TT-(TC+CC) | 571 | 0.26 | 0.78(0.57~0.99) |
| 白种人的研究 | |||
| TT-TC | 117 | 0.40 | 0.38(0.07~0.69) |
| TT-CC | 118 | 0.13 | 1.42(0.77~2.06) |
| TT-(TC+CC) | 183 | 0.12 | 0.55(0.15~0.94) |
| 亚洲人的研究 | |||
| TT-TC | 292 | 0.37 | 0.61(0.32~0.90) |
| TT-CC | 242 | 0.33 | 2.10(1.55~2.65) |
| TT-(TC+CC) | 388 | 0.11 | 0.87(0.54~1.19) |
| Cmax全部研究 | |||
| TT-TC | 678 | 0.0003 | 0.48(0.18~0.77) |
| TT-CC | 507 | 0.003 | 1.24(0.77~1.70) |
| TT-(TC+CC) | 747 | 0.05 | 0.65(0.43~0.87) |
| 白种人的研究 | |||
| TT-TC | 363 | 0.0006 | 0.29(-0.15~0.73) |
| TT-CC | 265 | 0.51 | 0.84(0.45~1.23) |
| TT-(TC+CC) | 331 | 0.47 | 0.51(0.27~0.75) |
| 亚洲人的研究 | |||
| TT-TC | 315 | 0.06 | 0.67(0.27~1.06) |
| TT-CC | 242 | 0.002 | 1.83(0.91~2.74) |
| TT-(TC+CC) | 416 | 0.03 | 0.78(0.43~1.13) |
| CL/F全部研究 | |||
| TT-TC | 80 | 0.04 | -1.01(-1.91~-0.11) |
| TT-CC | 87 | 0.69 | -1.51(-2.08~-0.94) |
| TT-(TC+CC) | 201 | 0.08 | -1.07(-1.55~-0.59) |
2.3.1 SLCO1B1 T521C基因多态性对浓度-时间曲线下面积(AUC)的影响
有3篇文献报道AUC0~6h[7, 15, 17],标准均数差TT-TC为0.72(95%CI=0.24~1.19),敏感性分析:去除权重最大的文献进行分析,结果一致。因只有2篇文献报道TT和TC+CC基因型,所以没有进行敏感性分析,暂不能说明有明显统计学差异。有2篇文献报道AUC0~12 h[8, 12],TC+CC较TT基因型显著更高(SMD为0.8,95%CI:0.14~1.47)。TT-TC、TT-CC无明显统计学差异。有4篇文献报道AUC0~24 h[11-12, 22, 30],AUC0~24 h TT与TC、CC基因型无显著差异(表 2)。
有18篇文章报道了AUC0-inf[9-10, 11, 13-14, 16, 18-21, 23-29, 31]。标准均数差TT-TC为0.50(95%CI: 0.30~0.71),TT-CC为1.72(95%CI: 1.35~2.09),TT-(TC+CC)为0.76(95%CI: 0.57~0.94);总体而言,AUC0-inf的标准均数差在突变基因型高(表 2)。白种人和亚洲人的亚组分析也说明了TT与TC、CC、TC+CC基因型之间差异有统计学意义,AUC0-inf的标准均数差在突变基因型高(表 2)。敏感性分析:去除权重最大的文献进行分析,结果一致。提示在T521C野生型纯合子(TT)中,AUC0-inf低于其他基因型的受试者。白种人和亚洲人亚组分析,T521C野生型纯合子(TT)中,AUC0-inf也同样低于其他基因型白种人和亚洲人的受试者,说明T521C单核苷酸多态性基因型和表型相关性中不存在种族差异。
2.3.2 SLCO1B1 T521C对Cmax的影响在表 1中总共24个研究报道了T521C对血药峰浓度的影响[7-11, 13-31]。在这24个研究中,合并后的标准均数差TT-TC为0.48(95%CI: 0.18~0.77),TT-CC为1.24(95%CI: 0.77~1.70),TT-(TC+CC)为0.64(95%CI: 0.47~0.80,表 2)。白种人的亚组分析TT与CC、TC+CC基因型之间差异有统计学意义,亚洲人的亚组分析TT与TC、CC、TC+CC基因型之间差异有统计学意义;Cmax的标准均数差在突变基因型高(表 2)。敏感性分析:去除权重最大的文献进行分析,结果一致。提示在T521C野生型纯合子(TT)中,Cmax低于其他基因型的受试者。白种人和亚洲人亚组分析,T521C野生型纯合子(TT)中,Cmax也同样低于其他基因型白种人和亚洲人的受试者,说明T521C单核苷酸多态性基因型和表型相关性中不存在种族差异。
2.3.3 T521C对CL/F的影响包括8篇文章[17, 19-20, 22-23, 25-26, 31]。合并后的标准均数差TT-TC为-1.01(95%CI: -1.91~-0.11),TT-CC为-1.51(95%CI: -2.08~-0.94),TT-(TC+CC)为-0.96(95%CI: -1.29~-0.64)。在统计学上有显著差异(表 2)。敏感性分析:去除权重最大的文献进行分析,结果一致。说明在T521C野生型纯合子(TT)中,CL/F高于其他突变基因型。
2.4 发表偏倚评估对SLCO T521C基因多态性的药物动力学参数(AUC0~6 h、AUC0~12 h、AUC0~24 h、AUC0-inf、Cmax、CL/F)进行发表偏倚评估,漏斗图结果显示,大部分点基本对称分布于合并SMD值两侧,呈倒置漏斗状,提示偏倚控制较好。进一步说明发表偏倚对此次Meta分析影响较小,结论较为准确。
3 讨论OATP1B1在人类肝脏高度表达,能够运输各种外源性物质和药物,包括HMG-CoA还原酶抑制剂。OATP1B1的多态性与在质膜上表达水平有关,可能是影响药物处置的重要因素。文献报道在SLCO1b1基因敲除小鼠,普伐他汀的速率低于4倍肝血浆比率[32]。SLCO1B1特别是521C等位基因被证明能减少肝摄取和增加所有他汀类药物的血浆浓度,并在最近已被证明可增加肌病的风险[33]。
Morimoto等[34]研究发现在接受普伐他汀和阿托伐他汀的肌病患者与无肌病肌病患者相比OATP1B1 * 15的突变等位基因显著增高。Kameyama等[35]研究发现,在表达521 T > C的HEK293细胞普伐他汀和阿托伐他汀运输活动显著降低。药物转运蛋白OATP1B1、OATP-B、MRP2 and MDR1的多态性和降胆固醇药的药代动力学之间可能存在的关系。发现在SLCO1B1 521T>C单核苷酸多态性和系统性暴露于降脂药物之间的重要关联。
通过测量AUC0~6 h,AUC0~12 h,AUC0~24 h水平变化,没有发现T521C基因多态性对他汀类药物有显著的影响。一个可能的解释是,这个Meta分析纳入的研究对象过小;另一个原因可能是每个研究治疗剂量不同。T521C基因多态性对他汀类药物的AUC0-inf、Cmax和CL/F有显著影响。进行亚组分析、敏感性分析减少数据的异质性,结果大致相同。这可能表明,T521C等位基因减少他汀类药物从血液吸收进入肝细胞,并降低CL/F。通过AUC0-inf、Cmax和CL/F的分析,发现在T521C突变基因型的白种人和亚洲人均增加了他汀类药物的暴露水平。
还存在一些影响结论客观性的因素。首先,一些纳入研究的样本量较小,没有足够的能力来说明对HMG-CoA抑制剂的影响。其次,由于对其他OATP1B1基因多态性现有的证据有限,本研究仅调查了T521C的多态性。此外,数据没有按年龄、性别、体质量指数和其他可疑的因素分层。因此,还需要更多的数据进行更精确的分析。
| [1] | Ballantyne C M, Corsini A, Davidson M H, et al. Risk for myopathy with statin therapy in high-risk patients[J]. Arch Intern Med, 2003, 163(5): 553–564. DOI:10.1001/archinte.163.5.553 |
| [2] | Romaine S P, Bailey K M, Hall A S, et al. The influence of SLCO1B1 (OATP1B1) gene polymorphisms on response to statin therapy[J]. Pharmacogenomics J, 2010, 10(1): 1–11. DOI:10.1038/tpj.2009.54 |
| [3] | Stroup D F, Berlin J A, Morton S C, et al. Meta-analysis of observational studies in epidemiology: a proposal for reporting. Meta-analysis Of Observational Studies in Epidemiology (MOOSE) group[J]. JAMA, 2000, 283(15): 2008–2012. DOI:10.1001/jama.283.15.2008 |
| [4] | Chowbay B, Li H, David M, et al. Meta-analysis of the influence of MDR1 C3435T polymorphism on digoxin pharmacokinetics and MDR1 gene expression[J]. Br J Clin Pharmacol, 2005, 60(2): 159–171. DOI:10.1111/j.1365-2125.2005.02392.x |
| [5] | Hozo S P, Djulbegovic B, Hozo I. Estimating the mean and variance from the median, range, and the size of a sample[J]. BMC Med Res Methodol, 2005, 5: 13. DOI:10.1186/1471-2288-5-13 |
| [6] | Field A P. Meta-analysis of correlation coefficients: a Monte Carlo comparison of fixed-and random-effects methods[J]. Psychol Methods, 2001, 6(2): 161–180. DOI:10.1037//1082-989x.6.2.161 |
| [7] | Mwinyi J, Johne A, Bauer S, et al. Evidence for inverse effects of OATP-C (SLC21A6) 5 and 1b haplotypes on pravastatin kinetics[J]. Clin Pharmacol Ther, 2004, 75(5): 415–421. DOI:10.1016/j.clpt.2003.12.016 |
| [8] | Niemi M, Schaeffeler E, Lang T, et al. High plasma pravastatin concentrations are associated with single nucleotide polymorphisms and haplotypes of organic anion transporting polypeptide-C (OATP-C, SLCO1B1)[J]. Pharmacogenetics, 2004, 14(7): 429–440. DOI:10.1097/01.fpc.0000114750.08559.32 |
| [9] | Chung J Y, Cho J Y, Yu K S, et al. Effect of OATP1B1 (SLCO1B1) variant alleles on the pharmacokinetics of pitavastatin in healthy volunteers[J]. Clin Pharmacol Ther, 2005, 78(4): 342–350. DOI:10.1016/j.clpt.2005.07.003 |
| [10] | Lee E, Ryan S, Birmingham B, et al. Rosuvastatin pharmacokinetics and pharmacogenetics in white and Asian subjects residing in the same environment[J]. Clin Pharmacol Ther, 2005, 78(4): 330–341. DOI:10.1016/j.clpt.2005.06.013 |
| [11] | Hedman M, Antikainen M, Holmberg C, et al. Pharmacokinetics and response to pravastatin in paediatric patients with familial hypercholesterolaemia and in paediatric cardiac transplant recipients in relation to polymorphisms of the SLCO1B1 and ABCB1 genes[J]. Br J Clin Pharmacol, 2006, 61(6): 706–715. DOI:10.1111/j.1365-2125.2006.02643.x |
| [12] | Maeda K, Ieiri I, Yasuda K, et al. Effects of organic anion transporting polypeptide 1B1 haplotype on pharmacokinetics of pravastatin, valsartan, and temocapril[J]. Clin Pharmacol Ther, 2006, 79(5): 427–439. DOI:10.1016/j.clpt.2006.01.011 |
| [13] | Niemi M, Pasanen M K, Neuvonen P J. SLCO1B1 polymorphism and sex affect the pharmacokinetics of pravastatin but not fluvastatin[J]. Clin Pharmacol Ther, 2006, 80(4): 356–366. DOI:10.1016/j.clpt.2006.06.010 |
| [14] | Pasanen M K, Neuvonen M, Neuvonen P J, et al. SLCO/B1 polymorphism markedly affects the phrmacokinetics of simvatatin aid[J]. Phormacogenet Genomics[J], 2016, 16(12): 873–879. DOI:10.1097/01.fpc.0000230416.82349.90 |
| [15] | Ho R H, Choi L, Lee W, et al. Effect of drug transporter genotypes on pravastatin disposition in European-and African-American participants[J]. Pharmacogenet Genomics, 2007, 17(8): 647–656. DOI:10.1097/FPC.0b013e3280ef698f |
| [16] | Pasanen M K, Fredrikson H, Neuvonen PJ, et al. Different effects of SLCO1B1 polymorphism on the pharmacokinetics of atorvastatin and rosuvastatin[J]. Clin Pharmacol Ther, 2007, 82(6): 726–733. DOI:10.1038/sj.clpt.6100220 |
| [17] |
温爱萍, 徐小薇, 严晓伟. 有机阴离子转运多肽1B1遗传多态性对普伐他汀药动学的影响[J].
中国药学杂志, 2008, 43(22): 1735–1739.
Wen A P, Xu X W, Yan X W. Effects of genetic polymorphism of OATP1B1 on pharmacokinetics of pravastatin[J]. Chinese Pharmaceutical Journal, 2008, 43(22): 1735–1739. DOI:10.3321/j.issn:1001-2494.2008.22.013 |
| [18] | Choi J H, Lee M G, Cho J Y, et al. Influence of OATP1B1 genotype on the pharmacokinetics of rosuvastatin in Koreans[J]. Clin Pharmacol Ther, 2008, 83(2): 251–257. DOI:10.1038/sj.clpt.6100267 |
| [19] | Deng J W, Song I S, Shin H J, et al. The effect of SLCO1B1*15 on the disposition of pravastatin and pitavastatin is substrate dependent: the contribution of transporting activity changes by SLCO1B1*15[J]. Pharmacogenet Genomics, 2008, 18(5): 424–433. DOI:10.1097/FPC.0b013e3282fb02a3 |
| [20] | Fan L, Zhang W, Guo D, et al. The effect of herbal medicine baicalin on pharmacokinetics of rosuvastatin, substrate of organic anion-transporting polypeptide 1B1[J]. Clin Pharmacol Ther, 2008, 83(3): 471–476. DOI:10.1038/sj.clpt.6100318 |
| [21] | Kalliokoski A, Backman J T, Kurkinen K J, et al. Effects of gemfibrozil and atorvastatin on the pharmacokinetics of repaglinide in relation to SLCO1B1 polymorphism[J]. Clin Pharmacol Ther, 2008, 84(4): 488–496. DOI:10.1038/clpt.2008.74 |
| [22] | Suwannakul S, Ieiri I, Kimura M, et al. Pharmacokinetic interaction between pravastatin and olmesartan in relation to SLCO1B1 polymorphism[J]. J Hum Genet, 2008, 53(10): 899–904. DOI:10.1007/s10038-008-0324-9 |
| [23] | He Y J, Zhang W, Chen Y, et al. Rifampicin alters atorvastatin plasma concentration on the basis of SLCO1B1 521T>C polymorphism[J]. Clin Chim Acta, 2009, 405(1-2): 49–52. DOI:10.1016/j.cca.2009.04.003 |
| [24] | Lee Y J, Lee M G, Lim L A, et al. Effects of SLCO1B1 and ABCB1 genotypes on the pharmacokinetics of atorvastatin and 2-hydroxyatorvastatin in healthy Korean subjects[J]. Int J Clin Pharmacol Ther, 2010, 48(1): 36–45. DOI:10.5414/cpp48036 |
| [25] |
随双明, 温金华, 李新华, 等. OATP1B1基因位点521T→C的突变对瑞舒伐他汀在中国健康人体内药代动力学特征的影响[J].
药学学报, 2011, 46(6): 695–700.
Sui S M, Wen J H, Li X H, et al. Effect of OATP1B1 521T →C heterogenesis on pharmacokinetic characterstics of rosuvastatin in Chinese volunteers[J]. Acta pharmaceutica Sinica, 2011, 46(6): 695–700. |
| [26] | Choi C I, Lee Y J, Lee H I, et al. Effects of the SLCO1B1*15 allele on the pharmacokinetics of pitavastatin[J]. Xenobiotica, 2012, 42(5): 496–501. DOI:10.3109/00498254.2011.632030 |
| [27] | Zhou Q, Ruan Z R, Yuan H, et al. CYP2C9*3(1075A>C), MDR1 G2677T/A and MDR1 C3435T are determinants of inter-subject variability in fluvastatin pharmacokinetics in healthy Chinese volunteers[J]. Arzneimittelforschung, 2012, 62(11): 519–524. DOI:10.1055/s-0032-1323696 |
| [28] | Zhou Q, Ruan Z R, Jiang B, et al. Simvastatin pharmacokinetics in healthy Chinese subjects and its relations with CYP2C9, CYP3A5, ABCB1, ABCG2 and SLCO1B1 polymorphisms[J]. Pharmazie, 2013, 68(2): 124–128. |
| [29] | Zhu J, Song M, Tan H Y, et al. Effect of pitavastatin in different SLCO1B1 backgrounds on repaglinide pharmacokinetics and pharmacodynamics in healthy Chinese males[J]. Pak J Pharm Sci, 2013, 26(3): 577–584. DOI:10.1097/01.hjh.0000408034.54484.7d |
| [30] | Tornio A, Vakkilainen J, Neuvonen M, et al. SLCO1B1 polymorphism markedly affects the pharmacokinetics of lovastatin acid[J]. Pharmacogenet Genomics, 2015, 25(8): 382–387. DOI:10.1097/FPC.0000000000000148 |
| [31] | Liu M, Wu X J, Zhao G L, et al. Effects of Polymorphisms in NR1H4, NR1I2, SLCO1B1, and ABCG2 on the Pharmacokinetics of Rosuvastatin in Healthy Chinese Volunteers[J]. J Cardiovasc Pharmacol, 2016, 68(5): 383–390. DOI:10.1097/FJC.0000000000000426 |
| [32] | van de Steeg E, Wagenaar E, van der Kruijssen C M, et al. Organic anion transporting polypeptide 1a/1b-knockout mice provide insights into hepatic handling of bilirubin, bile acids, and drugs[J]. J Clin Invest, 2010, 120(8): 2942–2952. DOI:10.1172/JCI42168 |
| [33] | Rodrigues AC. Efflux and uptake transporters as determinants of statin response[J]. Expert Opin Drug Metab Toxicol, 2010, 6(5): 621–632. DOI:10.1517/17425251003713519 |
| [34] | Morimoto K, Oishi T, Ueda S, et al. A novel variant allele of OATP-C (SLCO1B1) found in a Japanese patient with pravastatin-induced myopathy[J]. Drug Metab Pharmacokinet, 2004, 19(6): 453–455. DOI:10.2133/dmpk.19.453 |
| [35] | Kameyama Y, Yamashita K, Kobayashi K, et al. Functional characterization of SLCO1B1 (OATP-C) variants, SLCO1B1*5, SLCO1B1*15 and SLCO1B1*15+C1007G, by using transient expression systems of HeLa and HEK293 cells[J]. Pharmacogenet Genomics, 2005, 15(7): 513–522. DOI:10.1097/01.fpc.0000170913.73780.5f |



