2. 400037 重庆,第三军医大学新桥医院心血管外科
2. Department of Cardiovascular Surgery, Xinqiao Hospital, Third Military Medical University, Chongqing, 400037, China
心肌肥厚是心脏对外界多种刺激或者内在病理刺激的一种适应性反应,是许多心血管疾病的重要病理生理过程。心肌肥厚伴随着心脏体积增加和心腔结构的改变,最终易引起心脏衰竭[1]。逆转或者减缓心肌肥厚过程,可预防或者延缓心力衰竭的发生,延长患者的生存时间[2]。慢性缺氧引起的心肌肥厚和压力负荷引起的心肌肥厚,是心肌肥厚中两个主要的病理过程。而慢性缺氧引起的心肌肥厚是临床上紫绀型先天性心脏病重要的病理生理改变。阐明缺氧心肌肥厚的发生机制,对于改善紫绀型先天性心脏病患者的预后具有重要意义。
β链蛋白(β-catenin)是Wnt信号经典通路中参与调节基因转录的重要蛋白,参与心血管的发生、发育过程[3]。近年研究发现,β-catenin还参与了心肌纤维化[4]、心力衰竭的[5]发生、发展。β-catenin是Wnt信号通路中调节基因表达的重要信号分子。当经典的Wnt信号被激活,能稳定β-catenin,使其在胞质中积累,进入细胞核,作为T细胞因子/淋巴增强因子(T-cell factor/lymphoid enhancer factor,TCF/LEF)复合物的转录共刺激因子,激活下游靶基因(如Cyclin D1[6-7])的转录。而β-catenin对缺氧引起的心肌肥厚的影响仍不清楚。除此之外,β-catenin在压力负荷引起的心肌肥厚和心肌缺氧的研究结果常呈现相反的结果。因此,本研究通过在缺氧条件下,在动物水平抑制或者激活β-catenin,观察其对心肌肥厚的影响,为缺氧心肌肥厚的治疗提供新靶点。
1 资料与方法 1.1 临床资料经第三军医大学新桥医院伦理委员会审查批准(2015),在术前获得患儿家属同意并签署知情同意书。以入院后经新桥医院心脏彩超复查所得的心脏多普勒彩超检查结果为诊断标准,常温环境不吸氧1 h以上测四肢血压和血氧饱和度。纳入标准如下[8]:非紫绀组,平均血氧饱和度≥95%且四肢血氧饱和度差异≤2%,临床上诊断结果为室间隔缺损(ventricular septal defect,VSD)合并右室流出道狭窄(right ventricular outflow tract stenosis,RVOS),术中同时行室间隔缺损修补术和右室流出道疏通术;紫绀组,平均血氧饱和度<85%且四肢血氧饱和度差异≤2%,临床诊断是法洛氏四联征(tetralogy of fallot,TOF),术中行右室流出道疏通术。按以上标准,选择2015年10月至2016年8月在新桥医院心血管外科行手术治疗的先心病患者21例,紫绀组11例与非紫绀组10例(表 1)。
| 组别 | n | 男/女 (例) |
手术时年龄 (x±s,月) |
临床诊断 | 血氧饱和度 [(x±s)%] |
射血分数 [(x±s)%] |
血红蛋白 (x±s,g/L) |
| 非紫绀组 | 10 | 4/6 | 21.40±15.09 | VSD+ RVOS | 97.67±1.12 | 68.89±2.57 | 140.22±11.54 |
| 紫绀组 | 11 | 2/7 | 17.10±11.89 | TOF | 72.11±5.69a | 63.44±3.21 | 119.56±7.68 |
| a:P < 0.05,与非紫绀组比较 | |||||||
1.2 材料 1.2.1 动物与分组
25只雄性C57BL/6J小鼠,6~8周龄,体质量20~25 g,购于第三军医大学新桥医院实验动物中心。分为常氧4周组、缺氧4周组、缺氧4周+生理盐水组、缺氧4周+激动剂(CHIR-9901) 组和缺氧4周+抑制剂(IWR-1) 组(n=5)。
1.2.2 试剂CHIR-9901(Sigma),IWR-1(Sigma),DMSO(索莱宝公司),标记Alexa Fluro 488的WGA(Invitrogen),β-catenin抗体(CST),Cyclin D1抗体(Abcam),c-Myc抗体(CST),troponin T(Abcam),其余常见试剂均购自碧云天。
1.3 方法 1.3.1 动物慢性缺氧模型建立将5只C57小鼠置入氧含量为10%,温度维持在25 ℃的缺氧仓(Ruskinn’s Invivo 2-1000),剩余5只C57小鼠置入相同环境的常氧(氧含量为21%)环境中培养。缺氧仓中C57小鼠自由进食和饮水,并监测每天进食量和进水量。按照缺氧小鼠每天的进食量和进水量给予常氧小鼠食物和水,保持两组间的进食量与进水量一致。于缺氧4周取5只C57小鼠和相对应的5只常氧小鼠,分别建立缺氧4周组和其对应的常氧4周组,并通过血红蛋白检测确认缺氧模型建立。
1.3.2 药物干预将15只C57小鼠置入10%含氧量的缺氧仓中,建立缺氧3周慢性缺氧动物模型,分为3组:缺氧4周+生理盐水组、缺氧4周+激动剂组和缺氧4周+抑制剂组,分别于缺氧第4周开始每天每只腹腔注射生理盐水、CHIR-9901(2 mg/g)和IWR-1(1.75 mg/g),一直注射到缺氧第4周结束。
1.3.3 标本采集① 临床心肌组织:静脉复合麻醉,正中开胸建立体外循环,取手术中切除的右心室流出道心肌组织作为标本,液氮保存。② 小鼠心肌组织:称量和测定血氧饱和度后,经断颈处死后开胸取心脏和肺,分别称取心脏和肺的质量,取右心室部分,锡箔纸包裹,液氮保存。
1.3.4 Western blot检测β-catenin表达情况从液氮中取出冻存的心肌组织,取0.1 g溶解于组织裂解液中制成匀浆。按照碧云天胞质胞核提取试剂盒的说明书,分别提取胞质和胞核蛋白,用BCA法测定蛋白质量。按照4 :1比例加入SDS-PAGE蛋白上样缓冲液(5×),混匀并于100 ℃煮沸5 min后,取等量样本进行SDS-PAGE凝胶电泳,湿转法转至PVDF膜上,BSA封闭1 h,β-catenin孵育4 ℃过夜,以β-actin为胞质内参,Lamin B为胞核内参。TBST漂洗3次,每次10 min。再加入相应的二抗室温孵育1 h,TBST漂洗3次,每次10 min,化学发光显影,凝胶成像系统采集图片。图像用Image-Pro Plus 6.0软件测定目的条带和内参条带的灰度值。
1.3.5 细胞面积的测定取4%多聚甲醛固定好的心肌切片,0.1%Triton X-100破膜15 min,山羊血清封闭37 ℃,30 min。加入标记Alexa Fluro 488的麦胚凝集素(wheat germ agglutinin,WGA),37 ℃孵育1 h,PBS漂洗55 min。用荧光显微镜采图,用Image-Pro Plus 6.0软件测量细胞面积和直径。
1.3.6 Western blot测定Cyclin D1的表达取心肌组织用液氮研磨制成粉末。用碧云天蛋白提取试剂盒,提取总蛋白,余下步骤按照1.3.4进行。用Image-Pro Plus 6.0软件测量条带的灰度值。
1.3.7 心导管检测右心室功能经小鼠颈静脉置入心导管,进入右心室,记录右心室血流动力学参数。
1.4 统计学方法采用SPSS 17.0统计软件分析,数据均以x±s形式表示。多组比较采用单因素方差分析法,两两比较用SNK法。两组比较采用独立样本t检验。检验水准:α=0.05。
2 结果 2.1 缺氧心肌标本中心肌细胞面积和活化的β-catenin表达变化与非紫绀组相比,紫绀组先心病患儿的心肌细胞面积明显增大[(728.7±24.0) 像素点vs (799.0±16.2) 像素点,P < 0.05,图 1],心肌细胞核中的β-catenin明显减少[细胞核:(0.42±0.06) vs (0.19±0.03),细胞质:(0.72±0.07) vs (0.69±0.09),P < 0.05,图 2]。
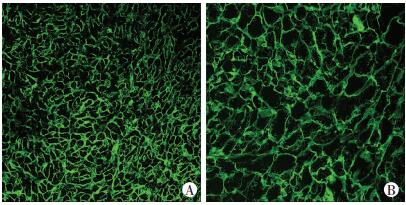
|
| A:非紫绀组;B:紫绀组 图 1 先心病患儿心肌组织中心肌细胞面积(免疫荧光×400) |
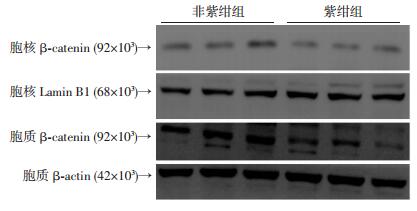
|
| 图 2 Western blot检测先心病患者心肌组织β-catenin在胞核、胞质的蛋白水平 |
2.2 缺氧诱导右心室肥厚、血流动力学改变和β-catenin表达改变
缺氧4周组的小鼠心肌细胞面积、右心室质量/体质量与常氧4周组比较,均有明显变化(P < 0.05,图 3,表 2)。缺氧4周组的右心室射血分数也明显低于常氧4周组(P < 0.05,表 2)。β-catenin在缺氧4周组中胞质、胞核中的含量均明显减少(P < 0.05,图 4,表 2)。
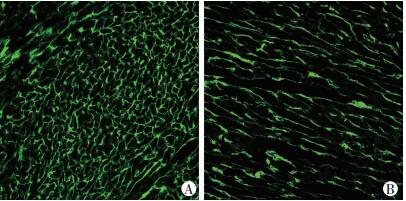
|
| A:常氧4周组;B:缺氧4周组 图 3 常氧4周组与缺氧4周组心肌组织中心肌细胞面积(免疫荧光×400) |
| 组别 | 心肌细胞面积(像素点) | 右心室射血分数(%) | 右心室质量/体质量 | β-catenin细胞核含量 | β-catenin细胞质含量 |
| 常氧4周组 | 370.40±35.10 | 57.89±2.49 | 0.000 9±0.000 2 | 0.61±0.02 | 0.46±0.04 |
| 缺氧4周组 | 675.40±29.20a | 44.46±3.83a | 0.001 5±0.000 3a | 0.39±0.10a | 0.38±0.05a |
| a:P < 0.05,与常氧4周组比较 | |||||
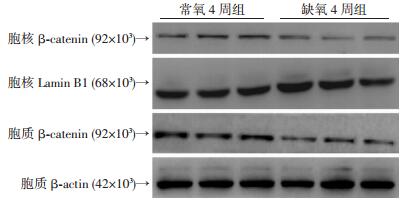
|
| 图 4 Western blot检测常氧4周组和缺氧4周组小鼠β-catenin在胞质、胞核的蛋白水平 |
2.3 链蛋白激动剂对缺氧4周的右心室肥厚程度和血流动力学的影响
缺氧4周+激动剂组的小鼠右心心肌细胞面积、右心室质量/体质量和右心室射血分数较缺氧4周+生理盐水组和缺氧4周+抑制剂组有显著改变(P < 0.05)。而缺氧4周+抑制剂组与缺氧4周+生理盐水组的变化不明显(P>0.05,图 5,表 3)。
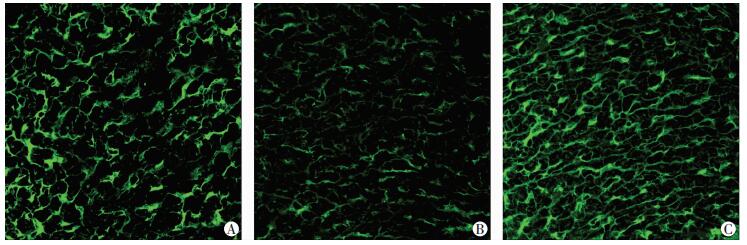
|
| A:缺氧4周+生理盐水组;B:缺氧4周+β-catenin激动剂组;C:缺氧4周+β-catenin抑制剂组 图 5 3组小鼠心肌组织中心肌细胞面积(免疫荧光×400 |
| 组别 | 心肌细胞面积(像素点) | 右心室射血分数(%) | 右心室质量/体质量 | ||
| 缺氧4周+生理盐水组 | 659.00±59.80a | 47.19±2.88a | 0.001 8±0.000 3a | ||
| 缺氧4周+激动剂组 | 396.40±38.15 | 51.47±1.70 | 0.001 1±0.000 1 | ||
| 缺氧4周+抑制剂组 | 712.00±34.12a | 41.16±6.91a | 0.001 9±0.000 2a | ||
| a:P < 0.05,与缺氧4周+激动剂组比较 | |||||
2.4 小鼠β-catenin激动剂对Cyclin D1的表达影响
与缺氧4周+抑制剂组和缺氧4周+生理盐水组相比,缺氧4周+激动剂组的小鼠β-catenin细胞核含量及β-catenin总蛋白含量明显增加,并且下游靶基因Cyclin D1的表达也明显增加(P < 0.05,图 6,表 4)。
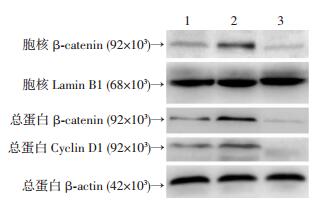
|
| 1:缺氧4周+生理盐水组;2:缺氧4周+激动剂组;3:缺氧4周+抑制剂组 图 6 Western blot检测小鼠β-catenin在细胞核水平和下游Cyclin D1的表达 |
| 组别 | β-catenin细胞核含量 | β-catenin总蛋白含量 | Cyclin D1总蛋白含量 |
| 缺氧4周+生理盐水组 | 0.32±0.01a | 0.51±0.06a | 0.33±0.04a |
| 缺氧4周+激动剂组 | 0.56±0.03 | 0.77±0.06 | 0.62±0.03 |
| 缺氧4周+抑制剂组 | 0.17±0.01a | 0.39±0.02a | 0.12±0.02a |
| a:P < 0.05,与缺氧4周+激动剂组比较 | |||
3 讨论
缺氧诱导的心肌肥厚是重要病理生理过程。由于心肌慢性缺氧在紫绀型先天性心脏病、稳定性冠心病等常见临床疾病中普遍存在,心肌常常会因此产生一系列适应性改变,比如缺氧心肌肥厚[9]。目前,缺氧右心室肥厚的发生机制仍不清楚。
β-catenin是亲斑蛋白家族的成员之一。亲斑蛋白家族属于犰狳相关蛋白,是桥粒斑的必要组分。除了参与细胞连接功能外,β-catenin还参与调节心脏的胚胎和出生后的发育过程[10]。有研究发现,β-catenin参与了左心室的代偿期心肌重构[11]和失代偿期心肌重构[12]。最近有关缺氧肺动脉高压的研究也发现,β-catenin参与了肺血管的重构[13],并且β-catenin的表达减少会引起桥粒斑的减少,从而参与致心律失常性右室心肌病的病理生理过程[14]。因此,β-catenin可能参与了缺氧诱导的右心室心肌肥厚过程。
本实验发现,在慢性缺氧的临床标本中,胞核和胞质中β-catenin减少。同样在慢性缺氧诱导的右心室肥厚的小鼠模型中,缺氧右心室中胞核和胞质中的β-catenin也减少,提示β-catenin可能会在缺氧心肌肥厚中起保护作用。为进一步验证β-catenin的作用,我们用β-catenin的激动剂和抑制剂分别干预了缺氧小鼠,检测心肌肥厚相关指标。结果显示,相对于生理盐水组,β-catenin激动剂组的心肌肥厚明显改善,心功能也得到一定程度的恢复,而β-catenin抑制剂组未显示出明显的心肌肥厚的加重和心功能改变。因此,我们认为β-catenin能改善慢性缺氧诱导的心肌肥厚,改善心脏功能。
最近的一项研究发现,非经典Wnt通路激活能降低β-catenin的含量,改善缺氧所致的右心室肥厚[13]。这个结果与本研究结论相反,但文献中所用的是缺氧2周的心肌肥厚模型。这说明β-catenin对缺氧右心室肥厚可能有双相调节作用。在左心室肥厚的研究中,已经有类似的结论[11-12]。在血管紧张素Ⅱ诱导的左心肥厚中,β-catenin的减少可促进代偿期的左心室肥厚[10];而β-catenin的激活促进主动脉缩窄术后6周的左心室肥厚[12]。而慢性缺氧中不同阶段的不同作用以及心肌肥厚的具体机制还需要进一步研究。
| [1] | HAGHIKIA A, STAPEL B, HOCH M, et al. STAT3 and cardiac remodeling[J]. Heart Fail Rev, 2011, 16(1): 35–47. DOI:10.1007/s10741-010-9170-x |
| [2] | KEE H J, SOHN I S, NAM K I, et al. Inhibition of histone deacetylation blocks cardiac hypertrophy induced by angiotensin Ⅱ infusion and aortic banding[J]. Circulation, 2006, 113(1): 51–59. DOI:10.1161/CIRCULATIONAHA.105.559724 |
| [3] | NAITO A T, SHIOJIMA I, AKAZAWA H, et al. Developmental stage-specific biphasic roles of Wnt/beta-catenin signaling in cardiomyogenesis and hematopoiesis[J]. Proc Natl Acad Sci U S A, 2006, 103(52): 19812–19817. DOI:10.1073/pnas.0605768103 |
| [4] | LIN J C, KUO W W, BASKARAN R, et al. Enhancement of beta-catenin in cardiomyocytes suppresses survival protein expression but promotes apoptosis and fibrosis[J]. Cardiol J, 2017, 24(2): 195–205. DOI:10.5603/CJ.a2016.0087 |
| [5] | LI Q, HANNAH S S. Wnt/beta-catenin signaling is downregulated but restored by nutrition interventions in the aged heart in mice[J]. Arch Gerontol Geriatr, 2012, 55(3): 749–754. DOI:10.1016/j.archger.2012.06.013 |
| [6] | DEJANA E. The role of wnt signaling in physiological and pathological angiogenesis[J]. Circ Res, 2010, 107(8): 943–952. DOI:10.1161/CIRCRESAHA.110.223750 |
| [7] | CLEVERS H. Wnt/beta-catenin signaling in development and disease[J]. Cell, 2006, 127(3): 469–480. DOI:10.1016/j.cell.2012.05.012 |
| [8] |
蹇朝, 马瑞彦, 王咏, 等. 缺氧诱导因子-1α在紫绀型先心病患儿心肌中的表达[J].
第三军医大学学报, 2009, 31(12): 1189–1192.
JIAN Z, MA R Y, WANG Y, et al. Eepression of hypoxia inducible factor-1alpha in the myocardium of infants with cyanotic congenital heart defect[J]. J Third Mil Med Univ, 2009, 31(12): 1189–1192. DOI:10.3321/j.issn:1000-5404.2009.12.019 |
| [9] | KOLAR F, OSTADAL B. Molecular mechanisms of cardiac protection by adaptation to chronic hypoxia[J]. Physiol Res, 2004, 53 Suppl 1: S3–S13. |
| [10] | BREMBECK F H, ROSARIO M, BIRCHMEIER W. Balancing cell adhesion and Wnt signaling, the key role of beta-catenin[J]. Curr Opin Genet Dev, 2006, 16(1): 51–59. DOI:10.1016/j.gde.2005.12.007 |
| [11] | BAURAND A, ZELARAYAN L, BETNEY R, et al. Beta-catenin downregulation is required for adaptive cardiac remodeling[J]. Circ Res, 2007, 100(9): 1353–1362. DOI:10.1161/01.RES.0000266605.63681.5a |
| [12] | CHEN X, SHEVTSOV S P, HSICH E, et al. The beta-catenin/T-cell factor/lymphocyte enhancer factor signaling pathway is required for normal and stress-induced cardiac hypertrophy[J]. Mol Cell Biol, 2006, 26(12): 4462–4473. DOI:10.1128/MCB.02157-05 |
| [13] | JIN Y, WANG W, CHAI S, et al. Wnt5a attenuates hypoxia-induced pulmonary arteriolar remodeling and right ventricular hypertrophy in mice[J]. Exp Biol Med (Maywood), 2015, 240(12): 1742–1751. DOI:10.1177/1535370215584889 |
| [14] | GARCIA-GRAS E, LOMBARDI R, GIOCONDO M J, et al. Suppression of canonical Wnt/beta-catenin signaling by nuclear plakoglobin recapitulates phenotype of arrhythmogenic right ventricular cardiomyopathy[J]. J Clin Invest, 2006, 116(7): 2012–2021. DOI:10.1172/JCI27751 |



