胃癌是常见的消化道恶性肿瘤之一,其死亡率在恶性肿瘤中高居第3位[1-2]。虽然近年来胃癌的诊断和治疗水平有了较大进步,但由于胃癌的发生和发展机制远未明晰,造成胃癌的诊断和治疗仍面临诸多挑战。因此,进一步探索胃癌的发病机制和治疗手段显得尤为紧迫。
目前,普遍认为胃癌的发生和发展是一个多因素和多阶段的过程,涉及癌基因和抑癌基因的表达失调[3]。微小RNA (microRNA,miRNA)是一类内生的、非编码RNAs (长度19~25 nt),可以通过结合到靶基因的3′UTR来调节靶基因的功能,并在肿瘤的病理过程中参与调节肿瘤细胞的增殖、迁移和凋亡等进程[4-5]。最近的研究表明,miRNA与胃癌的发生和发展关系密切。例如miR-107的表达在胃癌中明显上调,下调其表达可以明显抑制胃癌细胞的增殖、迁移与侵袭[6];而miR-26b在胃癌组织中的表达明显下调,且与不良预后相关,上调其表达可以明显抑制胃癌细胞的迁移[7]。OH等[8]通过miRNA基因芯片发现miR-671在胃癌组织中明显低表达,但是miR-671在胃癌发生与发展中的作用还不清楚。本研究拟进一步研究miR-671在胃癌组织和胃癌细胞系中的表达,同时研究miR-671对胃癌细胞增殖、迁移和侵袭的影响。
1 材料与方法 1.1 胃癌组织标本和细胞系胃癌组织标本来自本院2015年6月至2016年3月手术切除的8例胃癌患者(8例胃癌组织及其与对应病例匹配的癌旁正常组织)。患者均未接受过放化疗,并且均签署了知情同意书。本研究经过本院伦理委员会审批通过(2016)。GES-1、SGC7901、MKN28和MKN45细胞均由本实验室保存。
1.2 主要试剂RPMI1640培养基(美国Life Technologies公司),胎牛血清(美国Invitrogen公司),TRIzol(美国Invitrogen公司),反转录试剂盒(美国Promega公司),RT-PCR试剂盒(大连TaKaRa公司),Lipofectamine 2000(美国Invitrogen公司),CCK-8(上海Beyotime公司),Transwell小室(美国BD Bioscience公司)。
1.3 实时荧光定量PCR (quantitative real-time PCR,qRT-PCR)胃癌组织中总RNA提取:将组织在有液氮的条件下研磨成粉末,然后加入1 mL TRIzol,作用15 min后按照说明书依次加入氯仿、异丙醇、75%乙醇提取总RNA;细胞中RNA提取:将细胞中培养基去掉并用PBS洗涤后,加入1 mL TRIzol,作用15 min后按照说明书依次加入氯仿、异丙醇、75%乙醇提取总RNA。
总RNA提取完成后,测定RNA浓度[D(260)/D(280)]。然后,通过反转录引物利用反转录试剂盒将RNA反转录合成cDNA。最后,miR-671上、下游引物用SYBR Premix Ex Taq kit试剂盒测定miR-671的相对表达量,并以U6基因作为内参。miR-671反转录引物:5′-GTCGTATCCAGTGCAGGGTCCGAGGTGCAC-TGGATACGACCTCCAGCC-3′;miR-671上游引物:5′-AGGAAGCCCTGGAGGGG-3′;U6反转录引物:5′-GTC-GTATCCAGTGCAGGGTCCGAGGTGCACTGGATACGA-CAAAATATGGAAC-3′;U6上游引物:5′-GTGCTCGCTTCGGCAGC-3′;共用下游引物:5′-CAGTGCAGGGTCC-GAGGT-3′。
反应条件如下:95 ℃条件下30 s,预变性,然后95 ℃,3 s,60 ℃条件下30 s,共进行40个循环。利用2-△△Ct法进行数据处理。
1.4 细胞转染取对数生长期的MKN45细胞,经消化后,在1 000 r/min条件下离心5 min,然后将细胞按50%的汇合度接种到6孔板中,12 h后按100 nmol/L的浓度进行miR-671 mimic NC和miR-671 mimic的转染。
1.5 CCK-8实验通过CCK-8实验检测miR-671对MKN45细胞增殖的影响。将MKN45细胞接种于96孔板中,将实验分成空白对照组(未处理组)、miR-671 mimic NC(miR-671表达对照组)和miR-671 mimic(miR-671表达组),分别于1、2、3、4 d进行CCK-8检测。每孔中加入10 μL CCK-8,孵育3.5 h后在450 nm处检测光密度值[D(450)]。
1.6 划痕实验取对数生长期的MKN45细胞,经消化后,在1 000 r/min条件下离心5 min,然后将细胞按50%的汇合度接种到6孔板中,待细胞汇合度达到100%时,用1 mL枪头比着直尺垂直画线,将细胞中原有培养液吸去,并用PBS冲洗细胞3次,去掉细胞碎片,加入新鲜培养基继续培养72 h。
1.7 Transwell小室实验取对数生长期的MKN45细胞,经消化后,在1 000 r/min条件下离心5 min,用新鲜培养基重悬后进行细胞计数,按每孔1×105个细胞接种于小室的上室中,下室内加入含有10%胎牛血清的培养基,继续培养48 h,然后用1%的结晶紫染色15 min,用PBS清洗,最后进行细胞计数。
1.8 统计学处理采用SPSS 22.0统计软件进行数据分析,实验结果以x±s表示,两组之间的差异比较行t检验。检验水准:α=0.05。
2 结果 2.1 胃癌组织和胃癌细胞细胞系中miR-671的表达qRT-PCR检测结果显示:miR-671在癌旁组织中的相对表达量为(1.81±0.05),而在胃癌组织中的表达量为(0.44±0.35),因此,与癌旁组织相比,miR-671在胃癌组织中的表达明显下调(P < 0.01)。胃癌细胞系qRT-PCR检测结果显示:与正常胃黏膜上皮细胞(GES-1) 相比,3株肿瘤细胞系(SGC7901、MKN28和MKN45) 中miR-671的相对表达均明显下调(P < 0.01,图 1)。
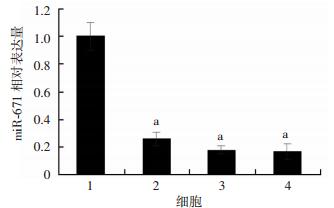
|
| 1: GES-1细胞;2:SGC7901细胞;3:MKN28细胞;4:MKN45细胞 a: P < 0.01, 与GES-1细胞比较 图 1 qRT-PCR检测miR-671在胃癌细胞系中的相对表达 |
2.2 miR-671 mimic转染MKN45细胞后表达验证
将细胞分为空白对照组、miR-671 mimic NC组和miR-671 mimic组。qRT-PCR检测结果显示:与miR-671 mimic NC组相比,miR-671 mimic组miR-671表达明显升高(P < 0.01,图 2)。
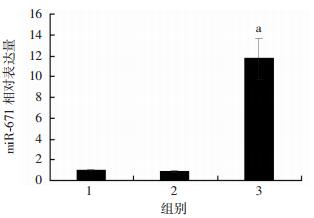
|
| 1:空白对照组;2:miR-671 mimic NC组;3:miR-671 mimic组 a: P < 0.01, 与miR-671 mimic NC组比较 图 2 qRT-PCR检测MKN45转染后miR-671的相对表达 |
2.3 miR-671上调后对MKN45细胞增殖能力的影响
CCK-8实验结果表明:与空白对照组MKN45细胞相比,miR-671 mimic NC组细胞在1、2、3、4 d的增殖能力差异没有统计学意义(P>0.05);与miR-671 mimic NC组细胞相比,miR-671 mimic组细胞在2、3、4 d的增殖能力均明显降低(P < 0.01,图 3)。
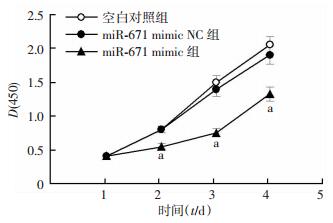
|
| a: P < 0.01, 与miR-671 mimic NC组比 图 3 miR-671上调后对MKN45细胞增殖能力的影响 |
2.4 miR-671上调后对MKN45细胞迁移能力的影响
划痕实验结果表明:与空白对照组MKN45细胞相比,miR-671 mimic NC组细胞的迁移能力差异没有统计学意义(P>0.05);与miR-671 mimic NC组细胞相比,miR-671 mimic组细胞的迁移能力明显降低(P < 0.01,图 4)。
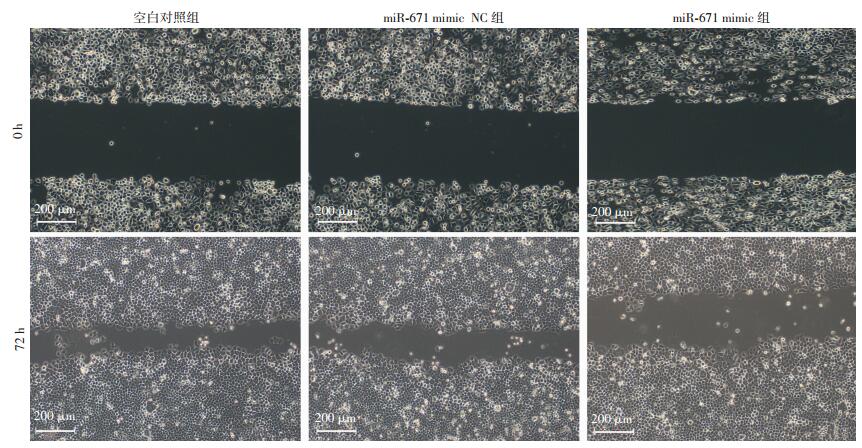
|
| 图 4 miR-671上调后对MKN45细胞迁移能力的影响(LM) |
2.5 miR-671上调后对MKN45细胞侵袭能力的影响
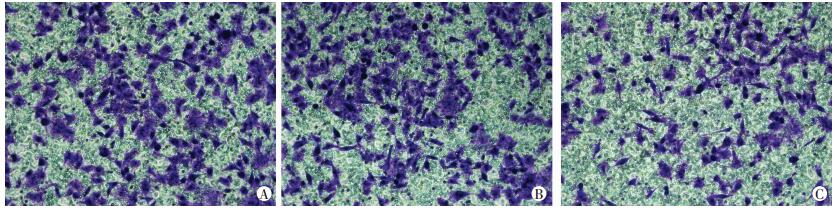
Transwell小室实验结果表明:空白对照组、miR-671 mimic NC组和miR-671 mimic组的细胞侵袭数分别为(154±11)、(160±13) 和(74±13),与miR-671 mimic NC组相比,miR-671 mimic组细胞的侵袭能力明显降低(P < 0.01,图 5)。
|
| A:空白对照组;B:miR-671 mimic NC组;C:miR-671 mimic组 图 5 miR-671上调后对MKN45细胞侵袭能力的影响(结晶紫染色×400) |
3 讨论
miRNAs在多种肿瘤中扮演重要角色[9]。在胃癌中,前期miRNAs微阵列已经筛选出了在肿瘤和正常组织中差异表达的miRNAs,并阐明了部分miRNAs在胃癌发生、发展中的作用,如miR-375通过抑制PDK1和14-3-3 zeta来调节胃癌细胞的存活[10]。但是,许多在胃癌中异常表达的miRNAs的功能还不清楚。本研究发现miR-671在8例胃癌组织中的表达较8例癌旁正常组织明显下调,并且在胃癌细胞系中的表达明显低于正常胃黏膜上皮细胞。这与OH等[8]通过miRNA基因芯片发现miR-671在胃癌组织中明显低表达的结果一致。我们推测miR-671在胃癌中很有可能发挥抑癌基因的作用。
为了验证推断,我们通过miR-671 mimic来实现miR-671在MKN45细胞中的高表达,然后探讨miR-671上调对MKN45细胞增殖、迁移和侵袭能力的影响。我们发现miR-671上调能明显抑制MKN45细胞的增殖能力,同时抑制其迁移和侵袭能力。这表明miR-671在胃癌中具有抑癌基因。上述结果与miR-671在其他肿瘤中的作用类似。RUTNAM等[11]在乳腺癌研究中发现miR-671上调后可以通过结合到FN1和CD44 3′UTR来抑制它们的蛋白表达,进而抑制乳腺癌细胞的转移和粘附。CD44已被证明与胃癌的起始和发展关系密切[12]。HU等[13]的研究表明抑制CD44的表达可以抑制CD44阳性胃癌细胞的侵袭。而YASUI等[14]的研究表明CD44的表达与胃腺癌中增殖相关指标Ki-67呈正相关。上述研究进一步佐证了我们在胃癌中发现的miR-671的重要作用。miRNAs作用的发挥往往是通过直接作用于下游靶基因的3′UTR并抑制其表达来实现的。虽然在乳腺癌中miR-671可以直接抑制CD44和FN1的表达,但是在胃癌中miR-671是否也能直接抑制CD44和FN1的表达还需要进一步研究。
| [1] | FERRO A, PELETEIRO B, MALVEZZI M, et al. Worldwide trends in gastric cancer mortality (1980-2011), with predictions to 2015, and incidence by subtype[J]. Eur J Cancer, 2014, 50(7): 1330–1344. DOI:10.1016/j.ejca.2014.01.029 |
| [2] | DA SILVA OLIVEIRA K C, THOMAZ ARA JO T M, Albuquerque C I, et al. Role of miRNAs and their potential to be useful as diagnostic and prognostic biomarkers in gastric cancer[J]. World Journal of Gastroenterology, 2016, 22(35): 7951. DOI:10.3748/wjg.v22.i35.7951 |
| [3] | YOU J S, JONES P A. Cancer genetics and epigenetics: two sides of the same coin[J]. Cancer Cell, 2012, 22(1): 9–20. DOI:10.1016/j.ccr.2012.06.008 |
| [4] | MALUMBRES M. miRNAs and cancer: an epigenetics view[J]. Mol Aspects Med, 2013, 34(4): 863–874. DOI:10.1016/j.mam.2012.06.005 |
| [5] | YUE L, DENG X, ZENG X, et al. The Role of Mir-148a in Cancer[J]. Journal of Cancer, 2016, 7(10): 1233–1241. DOI:10.7150/jca.14616 |
| [6] | WANG S, MA G, ZHU H, et al. miR-107 regulates tumor progression by targeting NF1 in gastric cancer[J]. Sci Rep, 2016, 6: 36531. DOI:10.1038/srep36531 |
| [7] | TSAI M M, HUANG H W, WANG C S, et al. MicroRNA-26b inhibits tumor metastasis by targeting the KPNA2/c-jun pathway in human gastric cancer[J]. Oncotarget, 2016, 7(26): 39511–39526. DOI:10.18632/oncotarget.8629 |
| [8] | OH H K, TAN A L, DAS K, et al. Genomic loss of miR-486 regulates tumor progression and the OLFM4 antiapoptotic factor in gastric cancer[J]. Clin Cancer Res, 2011, 17(9): 2657–2667. DOI:10.1158/1078-0432.CCR-10-3152 |
| [9] | NICOLOSO M S, SPIZZO R, SHIMIZU M, et al. Micro RNAs-the micro steering wheel of tumour metastases[J]. Nat Rev Cancer, 2009, 9(4): 293–302. DOI:10.1038/nrc2619 |
| [10] | TSUKAMOTO Y, NAKADA C, NOGUCHI T, et al. MicroRNA-375 is downregulated in gastric carcinomas and regulates cell survival by targeting PDK1 and 14-3-3zeta[J]. Cancer Res, 2010, 70(6): 2339–2349. DOI:10.1158/0008-5472.CAN-09-2777 |
| [11] | RUTNAM Z J, YANG B B. The non-coding 3′UTR of CD44 induces metastasis by regulating extracellular matrix functions[J]. J Cell Sci, 2012, 125(Pt 8): 2075–2085. DOI:10.1242/jcs100818 |
| [12] | JANG B I, LI Y, GRAHAM D Y, et al. The Role of CD44 in the Pathogenesis, Diagnosis, and Therapy of Gastric Cancer[J]. Gut Liver, 2011, 5(4): 397–405. DOI:10.5009/gnl.2011.5.4.397 |
| [13] | HU Y, WANG J, QIAN J, et al. Long noncoding RNA GAPLINC regulates CD44-dependent cell invasiveness and associates with poor prognosis of gastric cancer[J]. Cancer Res, 2014, 74(23): 6890–6902. DOI:10.1158/0008-5472.CAN-14-0686 |
| [14] | YASUI W, KUDO Y, NAKA K, et al. Expression of CD44 containing variant exon 9(CD44v9) in gastric adenomas and adenocarcinomas: relation to the proliferation and progression[J]. Int J Oncol, 1998, 12(6): 1253–1258. DOI:10.3892/ijo.12.6.1253 |



