泌乳素(prolactin,Prl)家族成员众多,可调节众多生物学进程[1-2]。目前发现小鼠Prl基因家族至少包含23个已经明确的基因,包括Prl2a1、Prl2b1、Prl2c2、Prl3c1、Prl3d1、Prl8a8等。这些基因主要表达于脑垂体、子宫和/或胎盘中。研究表明,Prl家族成员在胎盘中表达存在时空表达特异性,参与控制妊娠期母胎适应性,在妊娠中发挥着重要的作用[3]。
Prl3c1是Prl家族成员之一。Prl3c1又名Plp-j,Prlpj和Prlpi,由TOFT等[4]于1999年研究发现。与Prl多数其他家族成员不一样的是,Prl3c1主要由胚胎植入位点的蜕膜细胞表达,而非滋养层细胞。小鼠Prl3c1 mRNA表达始于妊娠早期,第7天出现高表达,第9天表达开始下降,到第11天时表达不能检测出来。Prl3c1可促进子宫基质细胞生长,但对内皮细胞生长起抑制效应,可能调控蜕膜细胞和子宫内膜血管发育[5]。PRL family 8,subfamily a,member 2 (Prl8a2)可调节蜕膜Prl3c1表达:在Prl8a2基因敲除小鼠,Prl3c1表达水平明显下降。这些研究表明Prl3c1对妊娠维持发挥重要作用。
本课题组发现Prl3c1也表达于睾丸[6]。原位杂交、免疫组化及免疫荧光方法显示Prl3c1表达于小鼠睾丸间质细胞,亚细胞定位于细胞质。Prl3c1 mRNA和蛋白表达水平在18 d组最低,成年组最高,老年组次之。鉴于其表达水平与体内睾酮水平随年龄变化趋势一致,推测其体内功能可能与间质细胞功能有关。因此本研究拟制备Prl3c1过表达TG小鼠,并初步研究其功能。
1 材料与方法 1.1 材料2月龄C57BL /6 WT小鼠(16只,雌雄各半)购于重庆医科大学实验动物中心(SYXK2012-0001),用于Prl3c1 TG小鼠制备、繁殖及作为对照小鼠。自由饮水和采食,所有操作均符合伦理学要求。抗PRL3C1多克隆抗体自己制备[6]。蛋白提取Kit,Beyo ECL Plus Western blot检测Kit购自碧云天公司。睾酮ELISA检测试剂盒购于USCN公司。
1.2 Prl3c1转基因载体构建设计引物(表 1)扩增Insl3、Prl3c1、Insl3PA片段,通过融合引物,扩增融合片段Insl3-Flag、Flag-Prl3c1、Insl3PA (poly A序列),形成Insl3-Flag-Prl3c1-Insl3PA片段。Insl3PA后面通过引物引入AflⅡ及MfeⅠ位点。以pcDNA3.1质粒为模板,设计引物扩增EGFP片段(含启动子CMV及poly A),EGFP前后两端引入AflⅡ及MfeⅠ位点。将Insl3-Flag-Prl3c1-Insl3PA片段连接到pEASY-Blunt上,形成pEASY-Insl3-Flag-Prl3c1-Insl3PA;将EGFP连接到18-T simple载体上,形成18-T-EGFP。MfeⅠ及AflⅡ双酶切pEASY-Insl3-Flag-Prl3c1-Insl3PA和18-T-EGFP,回收目的片段,以pEASY-Insl3-Flag-Prl3c1-Insl3PA形成骨架载体,形成最终转基因载体pPrl3c1(图 1)。
| 扩增片段 | 引物名称 | 引物序列 | 片段大小 |
| Insl3 | Insl3-Flag-上游 | 5′-GTCGACTGGTTTGTGACTGGAGTTGGGGGTGTAGA-3′ | 732 bp |
| Insl3-Flag-下游 | 5′-TGATAGCTGCTTGTCATCGTCGTCCTTGTAGTCCATGGTGGCAGGAGGCA-3′ | ||
| Prl3c1 | Flag-Prl3c1-上游 | 5′-CATGGACTACAAGGACGACGATGACAAGCAGCTATCATTGACTCAAGCAC-3′ | 689 bp |
| Flag-Prl3c1-下游 | 5′-AGGACGCACCGCCTGAGCCCTGTGCCCCTTTAGCAAATGGTTTTGATTTT-3′ | ||
| Insl3PA | Prl3c1-Insl3PA-上游 | 5′-CCATTTGCTAAAGGGGCACAGGGCTCAGGCGGTGCGTCC-3′ | 245 bp |
| Prl3c1-Insl3PA-下游 | 5′-CAATTGACCGGTCTTAAGTATGAAGTTGCTTTTTTATTTAGAC-3′ | ||
| EGFP | EGFP-上游 | 5′-CAATTGGTTGACATTGATTATTG-3′ | 1681 bp |
| EGFP-下游 | 5′-CTTAAGCCATAGAGCCCACCGCATCCCCAG-3′ |
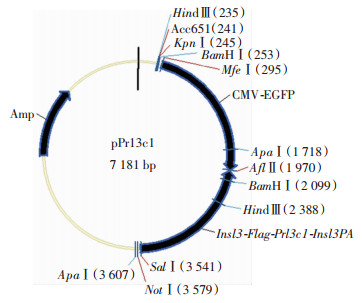
|
| 图 1 构建的pPrl3c1转基因载体示意图谱 |
1.3 受精卵原核注射
线性化转基因载体浓度调整至5 ng/μL,显微注射到C57BL/6J小鼠受精卵中,将注射完毕的受精卵移植入代孕母鼠体内,在代孕周期结束后成功分娩获得F0代首建鼠。
1.4 PCR鉴定Prl3c1 TG小鼠TG小鼠在出生14 d后剪尾端组织,提取基因组DNA,用PCR法对TG小鼠进行基因型鉴定。PCR上游引物为:5′-TGGTTTGTGACTGGAGTTGGGGGTGTAGAA-3′,下游引物为Prl3c1-Insl3PA-R。反应条件:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 90 s,共35个循环。随后以琼脂糖凝胶电泳对PCR产物进行鉴定,Prl3c1阳性小鼠引物产生片段大小为1.5×103 bp。阳性小鼠用于繁殖。
1.5 免疫荧光睾丸组织切片(5 μm)经脱蜡、梯度酒精脱水后,进行抗原修复,用0.01 mol/L PBST漂洗3次,山羊血清室温封闭30 min。与兔抗FLAG抗体(1 :100) 和羊抗HSD3B(1 :100) 孵育后,用PBS洗涤,与TRITC标记抗兔IgG和FITC标记抗羊IgG孵育1 h,荧光显微镜下观察。
1.6 HE染色将小鼠睾丸置于10%多聚甲醛液中固定,在梯度酒精脱水后石蜡包埋并切片(5 μm)用于HE染色,观察形态变化,并测量睾丸生精小管直径与周长。
1.7 睾酮测定取饲养至3月龄TG小鼠与WT小鼠,测定血清基础睾酮水平;并测定腹腔注射5 U/10 g HCG刺激6 h后,TG小鼠(TG+HCG组)与WT小鼠(WT+HCG组)睾酮水平(n=6)。睾酮测定按照产品说明书。
1.8 Western blot取0.1 g睾丸组织,用蛋白质提取试剂盒提取培养细胞的总蛋白,用BCA蛋白定量检测试剂盒测定蛋白含量。50 μg总蛋白进行聚丙烯酰胺凝胶电泳,电转移至PVDF膜,10%脱脂奶粉封闭后,依次与一抗(抗Prl3c1抗体、抗FLAG抗体、抗STAR或抗CYP11A1)、辣根过氧化物酶(HRP)标记的二抗于37 ℃孵育1 h,BeyoECL Plus化学发光试剂显色,检测。
1.9 统计学分析数据采用x±s表示,不同组别数据比较采用单因素方差分析进行均值多重比较。
2 结果 2.1 Prl3c1转基因载体的构建及鉴定将Prl3c1编码序列插入睾丸特异表达的Insl3基因启动子的下游,成功构建Prl3c1转基因载体(图 2)。小鼠出生14 d后对F0代小鼠剪尾端鉴定基因型与测序证明,最终得到3只阳性F0小鼠(图 3),用于繁殖。后续实验表明基于3只阳性F0小鼠繁殖产生子代的Prl3c1转基因表达与生殖表型及功能差异无统计学意义。
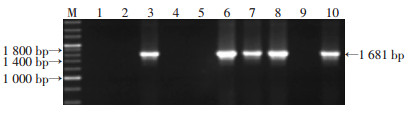
|
| M:200 bp标准,1~10:10个菌液单克隆 图 2 转基因片段Insl3-Flag-Prl3c1-Insl3PA PCR鉴定 |
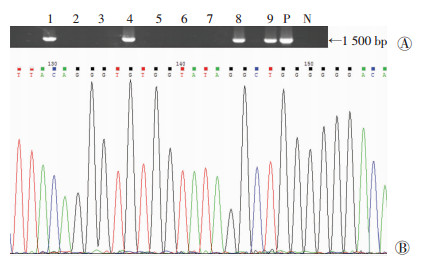
|
| 1~9:9只原代F0小鼠PCR结果;P:阳性质粒对照;N:阴性对照 图 3 TG小鼠PCR分型(A)与测序验证(B) |
2.2 免疫荧光鉴定Prl3c1转基因构建体在睾丸间质细胞中的表达
为了验证外源转基因是否在睾丸中特异表达于间质细胞,通过抗FLAG标签抗体免疫荧光检测,我们发现FLAG标记蛋白(FLAG-PRL3C1) 与间质细胞特异基因HSD3B共定位于间质细胞,说明Prl3C1转基因成功表达于小鼠睾丸间质细胞(图 4)。通过Western blot检测分析PRL3C1与FLAG-PRL3C1蛋白,可观察到TG小鼠总的PRL3C1表达量较WT小鼠明显增加(P<0.01),FLAG-PRL3C1可在TG小鼠检测到,而WT小鼠无表达(图 5),进一步证实TG小鼠的成功构建。其他重要组织器官,如心脏、肾脏、附睾、肺等均未检测到FLAG-PRL3C1表达。
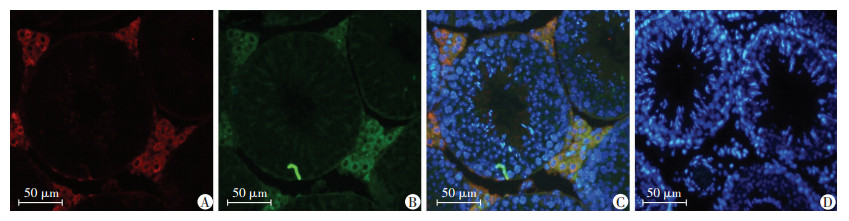
|
| A:TG小鼠睾丸抗FLAG荧光染色;B:TG小鼠睾丸抗HSD3B荧光染色;C:TG小鼠睾丸DAPI染核(A、B图融合);D:WT小鼠睾丸抗FLAG、抗HSD3B荧光染色与DAPI染核融合图像 图 4 免疫荧光实验分析Prl3c1转基因载体在Prl3c1 TG与WT小鼠睾丸中表达情况 |

|
| 1: WT小鼠; 2: Prl3c1 TG小鼠 图 5 Western blot检测Prl3c1转基因载体在WT小鼠与Prl3c1 TG小鼠睾丸中表达情况 |
2.3 HE染色观察结果
睾丸切片HE染色显示,3月龄Prl3c1 TG小鼠与WT小鼠的生精小管均边界完整,各级生精细胞排列紧密有序,间质区丰富,未见明显的组织病变特征差异(图 6)。测定睾丸生精小管直径与周长,WT小鼠为(178.0±14.9)μm与(573.0±37.9)μm,Prl3c1 TG小鼠为(172.3±13.6)μm与(560.5±27.9)μm,差异无统计学意义。
|
| 图 6 WT小鼠(A)与Prl3c1 TG小鼠(B)睾丸组织病理学变化 (HE ×200) |
2.4 上调Prl3c1基因不影响睾酮基础水平,但减弱HCG诱导的睾酮产生
WT组小鼠(2.61±0.34) 与Prl3c1 TG组小鼠(2.51±0.35) 基础睾酮水平差异无统计学意义(P>0.05);而在HCG刺激后,WT小鼠与TG小鼠睾酮水平均明显增加,但WT小鼠睾酮增加幅度明显高于TG小鼠,二者差异具有统计学意义[(7.56±1.17)vs(5.35±0.83),P<0.01],表明Prl3c1与睾酮产生有关。
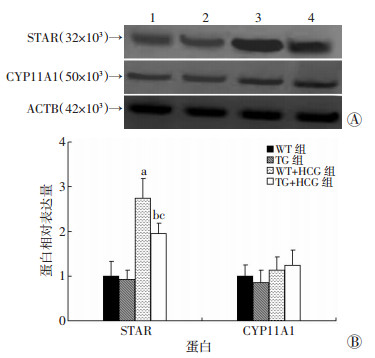
2.5 Prl3c1过表达抑制HCG诱导的STAR表达上调Western blot检测结果(图 7)显示WT组与TG组小鼠在HCG刺激后,与各自对照组比较,STAR均明显上调(P<0.01),但WT+HCG组增加更明显,与TG+HCG组比较,差异有统计学意义(P<0.01)。而CYP11A在WT组与TG组经HCG刺激后均无明显改变。
|
| A:Western blot检测结果1: WT组,2: TG组,3: WT+HCG组,4: TG+HCG组; B:STAR与CYP11A1蛋白表达半定量分析(n=6,x±s) a:P<0.01,与WT组比较;b:P<0.01,与TG组比较;c:P<0.01,与WT+HCG组比较 图 7 Western blot检测STAR与CYP11A1在小鼠睾丸中表达 |
3 讨论
我们发现Prl3c1基因表达于雄性睾丸间质细胞,其在睾丸中生物学意义未明。为了研究其体内功能,我们制备了Prl3c1转基因载体,显微受精卵原核注射后获得了Prl3c1 TG小鼠。
Insl3基因在雄性特异表达于睾丸间质细胞[7]。SHIRNESHAN等[8]报道发现Insl3基因启动子可有效介导外源insulin基因表达于小鼠睾丸间质细胞。因此,我们利用Insl3基因启动子介导Prl3c1表达。此外,为便于区分鉴定外源转基因表达的PRL3C1与睾丸自身表达PRL3C1蛋白,在转基因载体Prl3c1基因片段前加入了Flag标签序列,可以利用抗FLAG标签抗体检测。免疫荧光检测发现转基因表达的FLAG-PRL3C1与睾丸间质细胞特异基因HSD3B共定位于间质细胞,生精小管中的支持细胞与生精细胞均无阳性染色,说明Insl3基因启动子可介导Prl3c1在睾丸间质细胞中的特异表达。进一步通过Western blot检测蛋白的表达情况,TG小鼠可检测到FLAG-PRL3C1表达,而WT小鼠不能检测到,且总PRL3C1表达水平显著高于WT小鼠,条带大小与预期一致,提示构建的转基因载体在小鼠睾丸间质细胞有效的表达。
成年雄性动物睾酮主要来源于睾丸间质细胞。睾丸睾酮主要活性是参与到性功能维持、启动生精功能,促进精子发生与成熟等[9]。因而,间质细胞对机体的效应主要体现在睾酮产生量。睾酮产生受到间质细胞自分泌、旁分泌因素的精细调控。睾丸支持细胞、各级生精细胞表达、产生的各种细胞因子、激素等主要以旁分泌途径调控睾酮产生;而特异或非特异表达于间质细胞的基因,包括细胞因子、生长因子、参与睾酮合成的各种酶等形成自分泌调控网络[10-12]。多种因素,包括衰老、化学毒物则可能通过损伤某些基因表达水平或功能,破坏自分泌、旁分泌因素的精细调控平衡网络,从而抑制睾酮产生[13-14]。
Prl3c1表达水平从出生后到成年期间呈现增加趋势,而此后表达下调,其是否属于睾酮调控网络成员之一而参与睾酮产生呢?我们在建立的Prl3c1 TG小鼠基础上,首先测定了3月龄小鼠睾酮水平。结果表明Prl3c1过表达不影响睾酮基础水平。黄体生成素/绒毛膜促性腺激素受体(luteinizing hormone/choriogonadotropin receptor,LHCGR)表达于睾丸间质细胞,HCG可以通过结合到LHCGR,刺激下游信号通路,促进间质细胞产生睾酮[15]。为了研究PRl3c1过表达是否影响间质细胞睾酮产生潜能,通过HCG刺激后,我们发现PRl3c1 TG小鼠睾酮增加水平不及WT小鼠,提示Prl3c1过表达减弱睾酮产生刺激效应,间接参与睾酮水平维持。
类固醇激素合成急性调节蛋白(steroidogenic acute regulatory protein,STAR)把细胞内储存胆固醇转运到线粒体的内膜,是细胞内胆固醇快速转运的调节因子,在类固醇激素合成过程中发挥限速步骤的作用。胆固醇转化为孕烯醇酮,是类固醇激素合成第一步,由位于线粒体内膜的细胞色素P450家族成员11A1 (cytochrome P450 family 11 subfamily A member 1,CYP11A1) 催化[16]。为进一步研究Prl3c1过表达减弱HCG刺激睾酮产生效应机制,我们通过Western blot检测结果显示,HCG刺激6 h后对CYP11A1未见明显影响,而WT与TG小鼠STAR表达均明显上调,但WT小鼠增加幅度显著高于TG小鼠,表明Prl3c1减弱HCG刺激的STAR增加。
综上,本研究成功制备Prl3c1 TG小鼠,为进一步深入研究Prl3c1基因奠定了基础。体内功能研究显示,Prl3c1过表达可减弱HCG刺激的STAR蛋白表达,从而减少睾酮产生,提示Prl3c1间接调控睾丸间质细胞睾酮产生。结合睾酮产生量与Prl3c1表达量呈现同向变化的现象,我们推测Prl3c1可能参与维持睾酮稳态。进一步深入揭示Prl3c1基因在雄性生殖中的效应对延缓衰老、防治外源化学物损伤睾丸生殖功能具有研究价值。
| [1] | ROBERTS R M, GREEN J A, SCHULZ L C. The evolution of the placenta[J]. Reproduction, 2016, 152(5). DOI:10.1530/REP-16-0325 |
| [2] | ALAM S M, KONNO T, SOARES M J. Identification of target genes for a prolactin family paralog in mouse decidua[J]. Reproduction, 2015, 149(6): 625–632. DOI:10.1530/REP-15-0107 |
| [3] | BU P, ALAM S M, DHAKAL P, et al. A prolactin family paralog regulates placental adaptations to a physiological stressor[J]. Biol Reprod, 2016, 94(5): 107. DOI:10.1095/biolreprod.115.138032 |
| [4] | TOFT D J, LINZER D I. Prolactin (PRL)-like protein J, a novel member of the PRL/growth hormone family, is exclusively expressed in maternal decidua[J]. Endocrinology, 1999, 140(11): 5095–5101. DOI:10.1210/endo.140.11.7138 |
| [5] | ALAM S M, KONNO T, SAHGAL N, et al. Decidual cells produce a heparin-binding prolactin family cytokine with putative intrauterine regulatory actions[J]. J Biol Chem, 2008, 283(27): 18957–18968. DOI:10.1074/jbc.M801826200 |
| [6] | YANG Q, HAO J, HE M, et al. Localization and expression patterns of prolactin-like protein J in mouse testis[J]. Mol Med Rep, 2014, 10(1): 255–261. DOI:10.3892/mmr.2014.2218 |
| [7] | LOTTRUP G, NIELSEN J E, MAROUN L L, et al. Expression patterns of DLK1 and INSL3 identify stages of Leydig cell differentiation during normal development and in testicular pathologies, including testicular cancer and Klinefelter syndrome[J]. Hum Reprod, 2014, 29(8): 1637–50. DOI:10.1093/humrep/deu124 |
| [8] | SHIRNESHAN K, BINDER S, BOHM D, et al. Directed overexpression of insulin in Leydig cells causes a progressive loss of germ cells[J]. Mol Cell Endocrinol, 2008, 295(1-2): 79–86. DOI:10.1016/j.mce.2008.07.007 |
| [9] | NETO F T, BACH P V, NAJARI B B, et al. Spermatogenesis in humans and its affecting factors[J]. Semin Cell Dev Biol, 2016, 59: 10–26. DOI:10.1016/j.semcdb.2016.04.009 |
| [10] | LARDONE M C, ARGANDOÑA F, FLÓREZ M, et al. Overexpression of CYP19A1 aromatase in Leydig cells is associated with steroidogenic dysfunction in subjects with Sertoli cell-only syndrome[J]. Andrology, 2017, 5(1): 41–48. DOI:10.1111/andr.12289 |
| [11] | CHEN M, WANG X, WANG Y, et al. Wt1 is involved in leydig cell steroid hormone biosynthesis by regulating paracrine factor expression in mice[J]. Biol Reprod, 2014, 90(4): 71. DOI:10.1095/biolreprod.113.114702 |
| [12] | RICCI G, CATIZONE A. Pleiotropic activities of HGF/c-Met system in testicular physiology: paracrine and endocrine implications[J]. Front Endocrinol (Lausanne), 2014, 5: 38. DOI:10.3389/fendo.2014.00038 |
| [13] | DE PEYSTER A, MIHAICH E, KIM D H, et al. Responses of the steroidogenic pathway from exposure to methyl-tert-butyl ether and tert-butanol[J]. Toxicology, 2014, 319: 23–37. DOI:10.1016/j.tox.2014.01.015 |
| [14] | MCBRIDE J A, CARSON C C 3RD, COWARD R M. Testosterone deficiency in the aging male[J]. Ther Adv Urol, 2016, 8(1): 47–60. DOI:10.1177/1756287215612961 |
| [15] | SAVCHUK I, SÖDER O, SVECHNIKOV K. Mono-2-ethylhexyl phthalate stimulates androgen production butsuppresses mitochondrial function in mouse leydig cells withdifferent steroidogenic potential[J]. Toxicol Sci, 2015, 145(1): 149–156. DOI:10.1093/toxsci/kfv042 |
| [16] | BEATTIE M C, ADEKOLA L, PAPADOPOULOS V, et al. Leydig cell aging and hypogonadism[J]. Exp Gerontol, 2015, 68: 87–91. DOI:10.1016/j.exger.2015.02.014 |



