2.646000 四川 泸州,西南医科大学附属医院耳鼻咽喉头颈外科
2. Department of Otolaryngology-Head and Neck Surgery, Affiliated Hospital of Southwest Medical University, Luzhou, Sichuan Province, 646000, China
喉癌是头颈部常见的恶性肿瘤,近年来发病率呈逐年上升趋势[1]。目前喉癌的治疗手段主要以手术切除为主放疗化疗为辅,但不少患者的生存质量受到较大影响,而且声门下型喉癌以及晚期喉癌目前的治疗效果也并不理想,预后较差。因而需要寻找新的治疗方法。恶性肿瘤的分子靶向治疗在手术放化疗的基础上已成为肿瘤学最新的热门方向。
含植物同源结构域和环指结构域泛素样蛋白1(ubiquitin-like protein containing PHD and RING finger domains 1,UHRF1) 基因是新近发现的一种癌基因,在多种癌细胞中呈现高表达状态。高表达的UHRF1被认为与癌症的发生、发展相关,相关研究证实UHRF1可通过甲基化肿瘤抑制基因如BRCA1,p16INK4A,p73等从而在细胞的恶性转化及癌细胞的增殖中发挥作用[2]。而我们前期研究发现,在喉癌组织中UHRF1的表达量明显高于癌旁组织,并与喉癌的临床分期和组织分型密切相关[3]。但UHRF1在喉癌发生、发展中的相关作用及其机制还并不清楚,因此我们采用siRNA干扰下调UHRF1在Hep-2细胞中的表达,观察细胞增殖凋亡及侵袭迁移的变化,进而讨论其能否成为喉癌治疗的新靶点。
1 材料与方法 1.1 材料人喉癌Hep-2细胞购于细胞株购自ATCC公司,RPMI1640培养基、0.25%胰蛋白酶购自美国Sigma公司,胎牛血清购自天津康源,Lipofectamine2000购自Invitrogen公司,Transwell小室和基质胶购自美国BD公司,RNA提取试剂TRIzol、逆转录试剂盒、SYBR Green均购自日本TaKaRa公司;RIPA蛋白提取试剂盒购自上海碧云天,PVDF膜、ECL化学发光试剂盒购自美国Millipore公司,兔抗人单克隆抗体UHRF1、Bax、Bcl-2、MMP-2、MMP-9、GAPDH均购自美国Abcam公司,辣根过氧化酶标记山羊抗兔IgG购自武汉博士德。
1.2 方法 1.2.1 细胞培养Hep-2喉癌细胞用含10%胎牛血清的RPMI1640培养液,置于温度37 ℃,CO2含量5%的培养箱中常规培养。
1.2.2 siRNA的设计合成与细胞转染siRNA委托上海吉玛公司设计合成,UHRF1-siRNA序列为上游:5′-GUGGCAAGAAUAGCAAGUATT-3′,下游:5′-UACUUGCUAUUCUUGCCACTT-3′,阴性对照组序列为上游:5′-UUCUCCGAACGUGUCACGUTT-3′,下游:5′-ACGUGACACGUUCGGAGAATT-3′。溶解于DEPC水后于-20 ℃冰箱长期保存。于转染前12 h选取对数生长期细胞,以每孔2 ×105个接种于6孔板内,待细胞融合度达到50%~60%左右进行转染。按说明将Lipofectamine2000与siRNA混匀后加入6孔板内。转染24~48 h后收集细胞进行后续实验。实验分为3组:空白对照组为未经处理的Hep-2细胞,阴性对照组为转染NC-siRNA的Hep-2细胞,干扰组为转染UHRF1-siRNA的Hep-2细胞。
1.2.3 qRT-PCR检测UHRF1 mRNA水平细胞转染48 h后,PBS清洗细胞1次,加入适量TRIzol提取各组细胞总RNA。定量取1 000 ng RNA,按照逆转录试剂盒说明书合成cDNA。以此cDNA为模板进行PCR扩增。以β-actin作为内参。UHRF1引物序列为:上游:5′-AGGTCAATGAGTACGTCGATGC -3′,下游:5′-TTCTCCGGGTAGTCGTCGT-3′。β-actin引物序列为:上游5′-CCACGAAACTACCTTCAACTCC-3′,下游5′-GTGATCTCCTTCTGCATCCTGT-3′。PCR扩增反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火60 s,共40个循环。目的基因的mRNA的相对表达量采用2-△△Ct公式计算。实验重复3次。
1.2.4 Western blot检测UHRF1及凋亡,侵袭相关基因的蛋白水平细胞转染48 h后,加入RIPA裂解液提取各组细胞总蛋白,BCA法测定蛋白浓度。制备10%的SDS-聚丙烯酰胺凝胶,按照测定的蛋白浓度每孔上样30 μg。电泳完毕后湿法转膜至PVDF膜上,5%脱脂奶粉室温下封闭2 h,分别加入一抗孵育(稀释比例分别为UHRF1 1 :1 000,Bax 1 :5 000,Bcl-2 1 :2 000,MMP-2 1 :1 000,MMP-9 1 :1 000,GAPDH 1 :5 000),4 ℃冰箱过夜,TBST清洗30 min后加入二抗,37 ℃孵箱孵育1 h, TBST再洗膜10 min,ECL化学发光试剂盒显影。实验重复3次。
1.2.5 Transwell小室法检测干扰UHRF1后对Hep-2细胞迁移侵袭能力的影响Transwell小室放入24孔板,无血清RPMI1640培养基稀释Matrigel基质胶(Matrigel基质胶:1640培养基为1 :7) 后均匀铺于小室内膜上,每孔20 μL。(迁移实验无需此操作步骤)收集转染24 h后的Hep-2细胞,用无血清1640培养基制成细胞悬液,计数,上室加入400 μL含5×104个细胞的悬液。下室加入600 μL含10%胎牛血清的1640培养基。放入细胞孵箱,迁移实验培养24 h,侵袭实验培养24 h。取出小室,4%多聚甲醛固定20 min,结晶紫染色20 min,PBS小心清洗,显微镜下观察计数穿过室膜的细胞数。实验重复3次。
1.2.6 MTT法检测干扰UHRF1后对Hep-2细胞增殖的影响细胞转染12 h后收集各组细胞,制成细胞悬液,每孔体积200 μL,细胞2×103个,接种于96孔板,每组细胞设6个复孔,放入孵箱中培养。分别在培养1~5 d后每孔加入20 μL质量浓度5 mg/mL的MTT溶液,继续培养4 h后,吸去上清液,每孔加入150 μL DMSO,避光震荡10 min,于酶标仪570 nm波长处检测各孔光密度值D(570),绘制生长曲线。实验重复3次。
1.2.7 流式细胞术检测细胞凋亡细胞转染24 h后收集各组细胞,PBS清洗2遍,加入500 μL的Binding Buffer重悬细胞,再加入5 μL的Annexin V-FITC混匀,避光室温孵育15 min,于上机前5 min加入5 μL的PI染色。实验重复3次。
1.3 统计学处理采用Graphpad prism 5软件分析处理,数据用x±s表示,组间均数比较采用单因素方差分析,进一步两两比较采用Tukey test。生长曲线结果采用重复测量方差分析。P < 0.05差异具有统计学意义。
2 结果 2.1 siRNA干扰后Hep-2细胞中UHRF1的mRNA表达水平和蛋白表达水平降低Hep-2细胞转染48 h后,利用qRT-PCR检测各组细胞UHRF1的mRNA表达水平,发现UHRF1-siRNA干扰组中UHRF1的mRNA表达水平(0.14±0.01) 较阴性对照组(1.13±0.07) 和空白对照组(1.00±0.07) 明显降低(P < 0.001)。Western blot检测各组细胞UHRF1的蛋白表达水平,发现UHRF1-siRNA干扰组中UHRF1的蛋白表达水平(0.52±0.01) 较阴性对照组(0.87±0.01) 和空白对照组(0.88±0.01) 明显降低(P < 0.001,图 1)。空白组和阴性对照组相比差异无统计学意义。
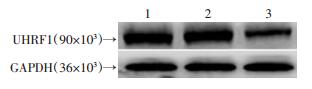
|
| 1:空白组;2:阴性对照组;3:干扰组 图 1 Western blot检测各组细胞转染siRNA 48h后Hep-2细胞中UHRF1蛋白的相对表达水平 |
2.2 下调UHRF1的表达可抑制Hep-2细胞的增殖
采用MTT法检测下调UHRF1表达后对Hep-2细胞的增殖影响,发现下调UHRF1表达后的UHRF1-siRNA干扰组D(570) 值增长明显缓于空白对照组和阴性对照组,表明细胞相对数增长变缓,细胞增殖受到明显抑制(P < 0.001,图 2)。空白对照组和阴性对照组相比差异无统计学意义。
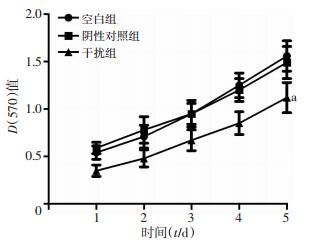
|
| a:P < 0.001, 与空白组和阴性对照组比较 图 2 MTT法检测下调UHRF1表达后对Hep-2细胞增殖的影响 |
2.3 下调UHRF1的表达可促进Hep-2细胞的凋亡
细胞转染24 h后采用流式细胞术检测Hep-2细胞凋亡率,发现下调UHRF1表达的UHRF1-siRNA干扰组的凋亡率(18.95±1.10)%较空白对照组凋亡率(5.47±2.77)%和阴性对照组凋亡率(3.95±0.66)%明显提高(P < 0.001,图 3)。空白对照组和阴性对照组相比差异无统计学意义(P > 0.05)。

|
| A:空白组;B:阴性对照组;C:干扰组 图 3 流式细胞术检测下调UHRF1表达后对Hep-2细胞凋亡的影响 |
2.4 下调UHRF1的表达可降低Hep-2细胞的侵袭迁移能力
Transwell侵袭实验检测结果(图 4)显示,下调UHRF1表达的UHRF1-siRNA干扰组的细胞穿膜数(97.7±7.5) 较空白对照组(213.7±13.1) 和阴性对照组(221.3±10.3) 比较明显减少,(P < 0.001),提示侵袭能力降低。迁移实验结果(图 5)显示,UHRF1-siRNA干扰组的细胞穿膜数(111.7±7.6) 较空白对照组(230.7±5.5) 和阴性对照组(222.7±11.2) 比较亦明显减少(P < 0.001),迁移能力降低。而空白对照组和阴性对照组比较差异无统计学意义。

|
| A:空白组;B:阴性对照组;C:干扰组 图 4 Transwell侵袭实验检测下调UHRF1表达后对Hep-2细胞侵袭能力的影响(结晶紫×100) |
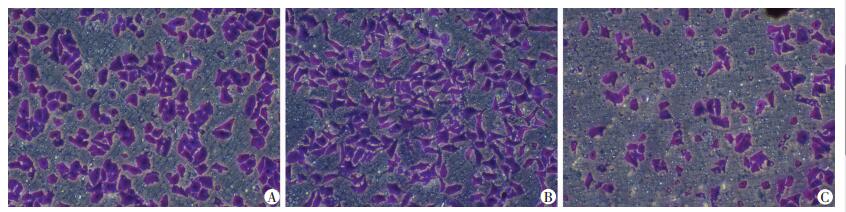
|
| A:空白组;B:阴性对照组;C:干扰组 图 5 Transwell侵袭实验检测下调UHRF1表达后对Hep-2细胞迁移能力的影响(结晶紫×100) |
2.5 下调UHRF1的表达对Hep-2细胞Bcl-2,Bax蛋白表达的影响
Western blot法检测各组细胞中凋亡相关蛋白的表达发现,下调UHRF1表达的UHRF1-siRNA干扰组(0.339±0.019) 与阴性对照组(0.165±0.002) 和空白对照组(0.159±0.003) 相比,促凋亡蛋白Bax表达明显上调(P < 0.001),而下调UHRF1表达的UHRF1-siRNA干扰组(0.27±0.02) 与阴性对照组(0.48±0.01) 和空白对照组(0.49±0.01) 相比,抑制凋亡蛋白Bcl-2的表达则明显下调(P < 0.001,图 6)。

|
| 1:空白组;2:阴性对照组;3:干扰组A:Bcl-2;B:Bax 图 6 Western blot检测各组细胞下调UHRF1表达后对Hep-2细胞中Bcl-2、Bax蛋白表达水平的影响 |
2.6 下调UHRF1的表达对Hep-2细胞MMP-2,MMP-9蛋白表达的影响
Western blot法检测各组细胞中侵袭迁移相关蛋白的表达发现,下调UHRF1表达的UHRF1-siRNA干扰组(0.29±0.01) 与阴性对照组(0.47±0.02) 和空白对照组(0.49±0.01) 相比,基质金属蛋白酶MMP-2的表达明显减少(P < 0.001);下调UHRF1表达的UHRF1-siRNA干扰组(0.11±0.01) 与阴性对照组(0.28±0.01) 和空白对照组(0.28±0.01) 相比,MMP-9的表达也明显减少(P < 0.001)(图 7)。

|
| 1:空白组;2:阴性对照组;3:干扰组A:MMP-2;B:MMP-9 图 7 Western blot检测各组细胞下调UHRF1表达后对Hep-2细胞中MMP-2, MMP-9蛋白表达水平的影响 |
3 讨论
UHRF1基因是UHRF基因家族成员之一,是新近发现的一种癌基因,它和细胞的生长和增殖密切相关[4]。在人类非肿瘤细胞中,UHRF1的表达随细胞周期而波动,在G1末期和G2/M期表达量最高[5]。但在肿瘤细胞中确呈现明显的高表达状态,如乳腺癌[6]、肺癌[7]、膀胱癌[8]、胰腺癌[9]、结肠癌[10]、宫颈癌[11]。高水平的UHRF1被认为是发生癌症的一个因素,它可以使细胞保持增殖状态并阻止其分化成熟[12-13]。我们的前期研究亦证实UHRF1在喉癌组织中高表达。那么UHRF1在喉癌的发生、发展中起何种作用,相关机制又如何呢?WANG等[14]发现慢病毒干扰UHRF1表达后的直肠癌细胞增殖能力降低,细胞周期阻滞在G0/G1期。本研究利用siRNA下调喉癌Hep-2细胞中UHRF1的表达后发现喉癌细胞的增殖能力明显下降,这与WANG等[14]的研究结果相似。QIN等[15]的研究发现在胆囊癌细胞中下调UHRF1基因的表达后可促进胆囊癌细胞凋亡,Western blot检测结果显示Bax蛋白表达上升,Bcl-2蛋白表达降低。本研究亦发现在Hep-2细胞中下调UHRF1的表达后,喉癌细胞的凋亡率明显提高,Bax蛋白表达上调,Bcl-2蛋白表达下调,这与QIN等的研究结果相似。这提示在喉癌Hep-2细胞中下调UHRF1的表达后可能通过调控与线粒体凋亡途径相关的Bax和Bcl-2蛋白提高细胞凋亡率。同时本研究发现在Hep-2细胞中下调UHRF1的表达后细胞的侵袭迁移能力明显下降。我们采用Western blot检测了与侵袭迁移密切相关的MMP-2和MMP-9蛋白发现以上两种蛋白的表达均明显下调,因此我们推测在Hep-2细胞中下调UHRF1的表达后可能通过下调MMP-2,MMP-9蛋白的表达抑制喉癌细胞的侵袭迁移能力。
综上所述,利用siRNA下调UHRF1在喉癌Hep-2细胞中的表达可以有效抑制喉癌细胞的增殖,促进其凋亡并抑制其侵袭迁移能力,UHRF1有可能成为喉癌治疗中的一个潜在的靶点。但UHRF1在喉癌中所起的作用是诸多因素共同作用引起的,本研究仅通过体外细胞实验进行了相关观察,而体内作用及其相关机制更有待进一步的深入研究。
| [1] |
孔维佳, 周梁, 许庚, 等. 耳鼻咽喉头颈外科学[M]. 北京: 人民卫生出版社, 2010: 460-464.
KONG WJ, ZHOU L, XU G, et al. Otorhinolaryngology-Head and Neck Surgery[M]. Beijing: People's Medical Publishing House, 2010: 460-464. |
| [2] | BRONNER C, KRIFA M, MOUSLI M. Increasing role of UHRF1 in the reading and inheritance of the epigenetic code as well as in tumorogenesis[J]. Biochem Pharmacol, 2013, 86(12): 1643–1649. DOI:10.1016/j.bcp.2013.10.002 |
| [3] | PI J T, LIN Y, QUAN Q, et al. Overexpression of UHRF1 is significantly associated with poor prognosis in laryngeal squamous cell carcinoma[J]. Med Oncol, 2013, 30(4): 613. DOI:10.1007/s12032-013-0613-9 |
| [4] | JENKINS Y, MARKOVTSOV V, LANG W, et al. Critical role of the ubiquitin ligase activity of UHRF1, anuclear RING finger protein, in tumor cell growth[J]. Mol Biol Cell, 2005, 16(12): 5621–5629. DOI:10.1091/mbc.E05-03-0194 |
| [5] | MOUSLI M, HOPFNER R, ABBADY A Q, et al. ICBP90 belongs to anew family of proteins with an expression that is deregulated in cancer cells[J]. Br J Cancer, 2003, 89(1): 120–127. DOI:10.1038/sj.bjc.6601068 |
| [6] | JIN W, CHEN L, CHEN Y, et al. UHRF1 is associated with epigenetic silencing of BRCA1 in sporadic breast cancer[J]. Breast Cancer Res Treat, 2010, 123(2): 359–373. DOI:10.1007/s10549-009-0652-2 |
| [7] | UNOKI M, DAIGO Y, KOINUMA J, et al. UHRF1 is anovel diagnostic marker of lung cancer[J]. Br J Cancer, 2010, 103(2): 217–222. DOI:10.1038/sj.bjc.6605717 |
| [8] | UNOKI M, KELLY J D, NEAL D E, et al. UHRF1 is anovel molecular marker for diagnosis and the prognosis of bladder cancer[J]. Br J Cancer, 2009, 101(1): 98–105. DOI:10.1038/sj.bjc.6605123 |
| [9] | CUI L, CHEN J, ZHANG Q, et al. Up-regulation of UHRF1 by oncogenic Ras promoted the growth, migration, and metastasis of pancreatic cancer cells[J]. Mol Cell Biochem, 2015, 400(1-2): 223–232. DOI:10.1007/s11010-014-2279-9 |
| [10] | SABATINO L, FUCCI A, PANCIONE M, et al. UHRF1 coordinates peroxisome proliferator activated receptor gamma (PPARG) epigenetic silencing and mediates colorectal cancer progression[J]. Oncogene, 2012, 31(49): 5061–5072. DOI:10.1038/onc.2012.3 |
| [11] | SABATINO L, FUCCI A, PANCIONE M, et al. Cell cycle and/or proliferation markers: what is the best method to discriminate cervical high-grade lesions[J]. Hum Pathol, 2005, 36(10): 1101–1107. DOI:10.1016/j.humpath.2005.07.016 |
| [12] | HOPFNER R, MOUSLI M, JELTSCH J M, et al. ICBP90, anovel human CCAAT binding protein, involved in the regulation of topoisomerase IIalpha expression[J]. Cancer Res, 2000, 60(1): 121–128. |
| [13] | MULDER K W, WANG X, ESCRIU C, et al. Diverse epigenetic strategies interact to control epidermal differentiation[J]. Nat Cell Biol, 2012, 14(7): 753–763. DOI:10.1038/ncb2520 |
| [14] | WANG F, YANG Y Z, SHI C Z, et al. UHRF1 promotes cell growth and metastasis through repression of p16(inka) in colorectal cancer[J]. Ann Surg Oncol, 2012, 19(8): 2753–2762. DOI:10.1245/s10434-011-2194-1 |
| [15] | QIN Y, WANG J, GONG W, et al. UHRF1 depletion suppresses growth of gallbladder cancer cells through induction of apoptosis and cell cycle arrest[J]. Oncol Rep, 2014, 31(6): 2635–2643. DOI:10.3892/or.2014.3145 |



