心肌病是一组由于心室结构改变和心肌壁功能受损所导致心脏功能进行性障碍的病变,严重威胁人类健康。心肌病发病机制复杂,最新研究发现,胰岛素抵抗与心肌病的发生关系密切,积极改善胰岛素抵抗已成为防治心肌病的有效途径[1]。二氢杨梅素(dihydromyricetin, DHM)是一种黄酮类化合物,主要存在于藤茶、枳椇子、乌墨等药食两用植物中,具有多种生物学以及药理活性作用, 包括抗氧化、抗炎、保肝和抗癌疗效[2-6],并对胰岛素抵抗和2型糖尿病有一定的防治作用[7]。然而,DHM对胰岛素抵抗引起的心脏功能不全、心肌病的作用及其可能作用机制尚待探明。过氧化物酶体增殖活化受体γ共激活因子-1α(peroxisome proliferator activator receptor gamma coactivator-1alpha,PGC-1α)主要表达在骨骼肌、心脏、肝、肾等能量需求高和线粒体丰富的组织,它通过结合下游的转录因子蛋白水解酶剪切Ⅲ型纤连蛋白组件包含蛋白5(fibrone-ctin typeⅢ domain-containing protein 5, FNDC5) 参与调控呼吸代谢、氧化磷酸化和线粒体功能,对维持心脏功能有重要意义[8]。因此,本研究观察了DHM对ob/ob肥胖小鼠心脏功能的影响,并探讨了PGC-1α/FNDC5通路在其中的可能作用,旨在阐明DHM对胰岛素抵抗引起的心脏功能障碍的作用及其潜在的作用机制,为其应用于心肌病的防治提供新的实验依据。
1 材料与方法 1.1 实验动物8周龄瘦素(leptin)突变型ob/ob雄性小鼠36只,同窝野生型C57BL/6J小鼠10只,购自南京大学模式动物研究所,饲养于SPF级动物中心,相对湿度50%~ 60%, 室温(23±1)℃,明暗周期12 h,自由进食和饮水。以10只野生型C57BL/6J小鼠作为正常对照(WT组),ob/ob小鼠采用随机数字表法分为3组:胰岛素抵抗模型组(ob/ob组),DHM 50 mg/kg干预组(ob/ob+DHM 50 mg/kg),DHM 100 mg/kg干预组(ob/ob+DHM 100 mg/kg),每组12只。干预16周后进行以下指标检测。
1.2 主要试剂DHM(纯度>98%)购自成都曼斯特公司,PGC-1α抗体购自美国Santa Cruz公司,FNDC5抗体购自美国Abcam公司,ACTB(β-actin)抗体购自上海生工生物公司,血糖检测仪、血糖试纸购自欧姆龙(中国)有限公司。
1.3 葡萄糖耐量、胰岛素抵抗检测 1.3.1 葡萄糖耐量实验于干预16周末,采用随机数字表法从各组中选6只小鼠禁食12 h后进行葡萄糖耐量检测。预先配好浓度为0.2 g/mL葡萄糖溶液,称量小鼠体质量,按照2 mg/g葡萄糖比例灌胃,分别收集0、30、60、90、120 min时间点小鼠尾部末梢血液,用血糖仪检测其血糖。
1.3.2 胰岛素耐量实验于干预16周末,采用随机数字表法从各组中选6只小鼠禁食6 h后测量胰岛素耐量水平,观察其对胰岛素的敏感性,预先配制好浓度为0.1 U/mL胰岛素溶液,分别称量小鼠体质量,按照1 mU/g胰岛素的比例,经腹腔注射,分别收集0、30、60、90、120 min时间点小鼠尾部末梢血液,用血糖仪检测其血糖。
1.4 超声心动图检查心脏功能通过腹腔内注射戊巴比妥钠(50 mg/kg)全身麻醉小鼠, 仰卧位固定在温度恒定的操作台上, 剔除胸毛,应用小动物超声检测仪进行心脏收缩末期室间隔厚度(interventricular septal thickness at end-systole, IVSs)、舒张期左室内径(left ventricular end-diastolic dimension, LVIDd)、收缩期左室内径(left ventricular end-systolic dimension, LVIDs)、舒张期左室后壁厚度(diastolic left ventricle posterior wall thickness, LVPWd)、收缩期左室后壁厚度(systolic left ventricle posterior wall thickness, LVPWs)、左心室射血分数(ejection fraction, EF)、左心室短轴缩短率(fractional shortening, FS)和舒张早期峰值血流速度(E峰)与舒张晚期峰值血流速度(A峰)的比值(E/A)的检测。
1.5 HE染色和Masson染色动物采血处死后,迅速将心脏取出,取心肌同一部分置入4%多聚甲醛固定,石蜡包埋切片,分别进行HE染色和Masson染色。
1.6 Western blot检测各取小鼠心肌组织约0.1 g,打碎组织经裂解后,提取上层清液,使用BCA测定蛋白浓度。配制浓度为12%的分离胶,取各组60 μg蛋白上样,在SDS-PAGE电泳进行蛋白质分离,并转移至PVDF膜。根据蛋白相对分子质量的位置,将目的蛋白相对分子质量范围的膜剪切下,5%脱脂牛奶封闭2 h后,一抗(PGC-1α, FNDC5;1 :1 000)4 ℃孵育过夜。TBS溶液洗膜3次后与辣根过氧化物酶标记的二抗(1 :8 000) 孵育2 h,再次洗膜3次后,采用VILBER FUSION FX7成像系统自动曝光。
1.7 免疫组化检测心肌组织中FNDC5蛋白表达取石蜡包埋的心肌组织切片(厚度2 μm),脱蜡至水,3% H2O2封闭15 min,5% BSA封闭30 min,一抗(浓度1 :800)4 ℃孵育过夜,二抗(山羊抗兔IgG)室温孵育1 h,三抗(SABC试剂)室温孵育1 h,DAB显色2 min,常规贴片、脱水、透明、封片。
1.8 统计学分析采用SPSS 19.0统计软件,计量资料以x±s表示,多组间比较采用单因素方差分析。检验水准:α=0.05。
2 结果 2.1 DHM对ob/ob小鼠的葡萄糖耐量和胰岛素抵抗的影响与WT组相比,ob/ob组葡萄糖耐量、胰岛素耐量明显受损。DHM干预16周后,ob/ob+DHM 50 mg/kg组对葡萄糖耐量和胰岛素耐量没有明显的改善;ob/ob+DHM 100 mg/kg组能够显著改善葡萄糖耐量和胰岛素耐量(P < 0.05,图 1)。
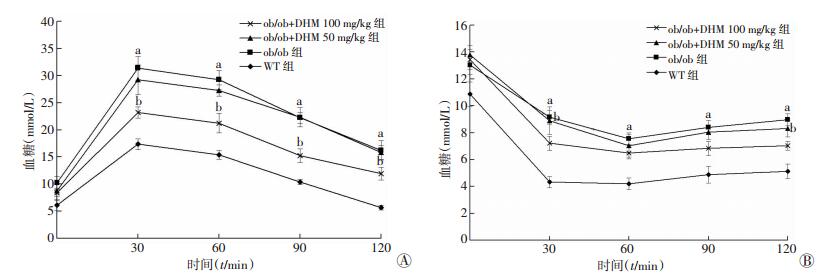
|
| A:小鼠葡萄糖耐量测试;B:小鼠胰岛素耐量测试 a:P < 0.05,与WT组比较;b:P < 0.05,与ob/ob组比较 图 1 DHM对ob/ob小鼠葡萄糖耐量和胰岛素耐量的影响(n=6,x±s) |
2.2 DHM对ob/ob小鼠心功能的影响
超声心动图结果显示,与WT组相比,ob/ob组LVIDd、LVIDs、LVPWd和E/A比值都有降低的趋势,但差异没有统计学意义(P>0.05);IVSs、LVPWs、FS和EF明显降低(P < 0.05)。与ob/ob组相比,DHM干预后显著改善ob/ob小鼠IVSs、LVPWs、EF、FS的降低(P < 0.05,表 1)。
| 组别 | IVSs(mm) | LVIDd(mm) | LVIDs(mm) | LVPWd(mm) | LVPWs(mm) | E/A | EF(%) | FS(%) |
| WT组 | 1.64±0.06 | 3.38±0.35 | 2.34±0.41 | 1.23±0.38 | 1.81±0.16 | 2.12±0.72 | 84.25±1.94 | 46.5±1.12 |
| ob/ob组 | 1.26±0.14a | 2.90±0.08 | 1.98±0.01 | 0.99±0.12 | 1.36±0.15a | 1.66±0.17 | 63.00±1.41a | 30.00±3.08a |
| ob/ob+DHM50 mg/kg组 | 1.98±0.12b | 3.55±0.63 | 2.13±0.64 | 0.98±0.08 | 1.58±0.07 | 1.55±0.31 | 70.25±6.21 | 36.75±7.28 |
| ob/ob+DHM100 mg/kg组 | 2.21±0.18b | 3.00±0.30 | 1.19±0.14 | 1.22±0.11 | 2.09±0.07b | 1.52±0.29 | 75.75±5.11b | 44.00±5.65b |
| a:P < 0.05,与WT组比较;b:P < 0.05,与ob/ob组比较 | ||||||||
2.3 DHM对心肌组织的影响
小鼠心肌HE染色结果显示,ob/ob组心肌细胞排列整齐,核染色清晰,细胞形态大体完整,与WT组相比并无明显差异。DHM干预组与ob/ob组相比差异也无统计学意义(图 2)。
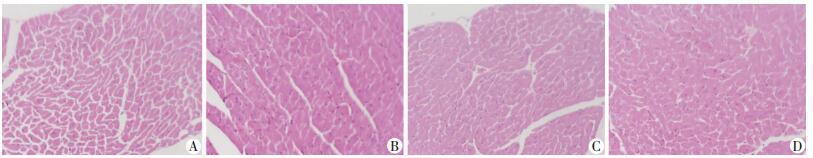
|
| A:WT组;B:ob/ob组;C:ob/ob+DHM 50 mg/kg组;D:ob/ob+DHM 100 mg/kg组 图 2 HE染色观察DHM对ob/ob小鼠心肌组织的影响(LM ×200) |
2.4 DHM对心肌组织胶原沉积的影响
小鼠心肌组织Masson染色结果显示:ob/ob组小鼠较WT组没有明显细胞肥大变形、间质纤维变粗及纤维化。DHM干预组与ob/ob组相比也差异无统计学意义(图 3)。
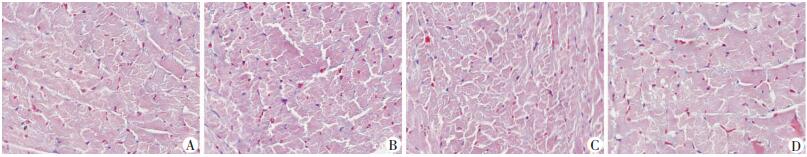
|
| A:WT组;B:ob/ob组;C:ob/ob+DHM 50 mg/kg组;D:ob/ob+DHM 100 mg/kg组 图 3 Masson染色观察DHM对ob/ob小鼠心肌纤维化的影响(LM ×400) |
2.5 DHM对心肌组织PGC-1α/FNDC5信号通路的影响
Western blot检测结果显示,与WT组相比,ob/ob组PGC-1α和FNDC5蛋白表达水平明显降低(P < 0.05),DHM 100 mg/kg干预后,与ob/ob组相比,PGC-1α和FNDC5蛋白表达水平增高(P < 0.05,图 4);免疫组化结果同样证实了ob/ob组FNDC5的表达降低,DHM干预后能够显著增加心肌组织FNDC5的表达(图 5)。
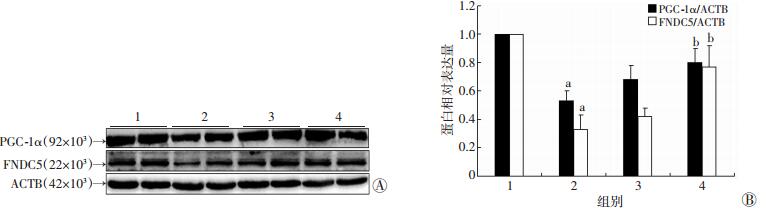
|
| 1: WT组;2: ob/ob组;3: ob/ob+DHM 50 mg/kg组;4: ob/ob+DHM 100 mg/kg组A: Western blot检测PGC-1α、FNDC5表达;B: PGC-1α、FNDC5蛋白半定量分析(n=6,x±s) a: P < 0.05,与WT组比较;b:P < 0.05,与ob/ob组比较 图 4 blot检测DHM对ob/ob小鼠心肌组织中PGC-1α、FNDC5蛋白表达的影响 |
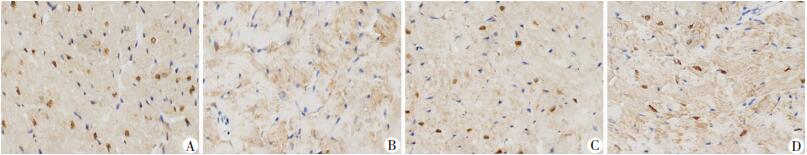
|
| A:WT组;B:ob/ob组;C:ob/ob+DHM 50 mg/kg组;D:ob/ob+DHM 100 mg/kg组 图 5 免疫组化检测DHM对ob/ob小鼠心肌组织中FNDC5蛋白表达的影响(SABC ×400) |
3 讨论
胰岛素抵抗与代谢综合征及糖尿病的发生、发展关系极为密切。改善胰岛素抵抗,提高胰岛素敏感性是治疗代谢综合征、糖尿病等的重要手段之一。研究证实胰岛素抵抗与心肌病的发生呈明显的正相关[9]。心肌病患者中糖尿病的发病率高于非心肌病者,更进一步研究显示胰岛素抵抗患者中心肌病的发病率也呈现出显著增高的趋势,且胰岛素抵抗与左室肥厚、左心功能不全呈正相关[10]。因此,改善胰岛素抵抗引起的心肌病对于代谢综合征、糖尿病等慢性病的防治具有重要意义。本研究采用瘦素突变型(ob/ob)肥胖小鼠作为肥胖胰岛素抵抗模型小鼠。发现喂养16周后,ob/ob小鼠葡萄糖耐量、胰岛素耐量明显受损,超声心动图结果显示左心室功能不全,表现为FS和EF显著降低,而LVID、LVIDs等指标无明显改变。HE染色和Masson染色也并未发现心肌有明显的肥大和心肌胶原沉积。DHM 100 mg/kg干预16周后,结果发现ob/ob小鼠的葡萄糖耐量、胰岛素耐量、心脏的FS和EF得到明显改善。这提示ob/ob小鼠发生了明显的胰岛素抵抗,导致了左室功能不全,DHM干预后显著改善了胰岛素抵抗和左心功能不全,但是对器质性指标无显著影响。因此,我们推测DHM可能是通过调节心肌能量代谢相关信号分子来改善胰岛素抵抗引起的心脏能不全。
心脏的能量储备相对有限,严格调控心脏线粒体系统对维持心脏运作具有重要意义[11]。PGC-1α主要表达在骨骼肌、心脏、肝、肾等能量需求高和线粒体丰富的组织,是维持能量动态平衡关键调控因子[12]。FNDC5是新近发现的PGC-1α下游重要的转录调控因子,可水解产生鸢尾素,其与线粒体的功能调节、脂肪氧化代谢明显相关[13]。业已证实,PGC-1α/FNDC5信号通路与心脏功能密切相关[14]。心肌病、心功能不全、心力衰竭时,心肌组织中PGC-1α、FNDC5的蛋白表达量、血清FNDC5的水解片段鸢尾素水平显著降低,并引起线粒体呼吸功能障碍,线粒体氧化代谢的底物由脂肪酸供能变成葡萄糖供能为主。而激活PGC-1α表达(如运动)后,FNDC5、鸢尾素的表达相应增高,心脏功能也呈现出明显的增强[15]。因此,寻找能够增加心肌PGC-1α表达的激活剂对于慢性心脏功能损伤的防治具有重要意义。本课题组之前的研究表明DHM能够激活骨骼肌组织的PGC-1α,增加线粒体的合成,提高高原耐受能力。更重要的是,DHM能够激活骨骼肌组织的PGC-1α,继而增加FNDC5的表达,提高血清中FNDC5的剪切物鸢尾素的水平。那么,DHM是否也可能通过PGC-1α/FNDC5信号通路来改善心脏功能?本研究发现ob/ob组小鼠心肌组织中PGC-1α、FNDC5蛋白表达显著降低,DHM干预后能够明显改善PGC-1α、FNDC5蛋白表达。免疫组化结果同样提示DHM逆转了ob/ob小鼠FNDC5表达降低。
综上所述,本研究结果显示DHM明显改善ob/ob小鼠胰岛素抵抗和心功能不全,进一步提示DHM的保护作用与心脏能量代谢相关分子(PGC-1α/FNDC5) 相关,为胰岛素抵抗引起的心肌病的防治提供了新的研究思路和实验依据。
| [1] | INGELSSON E, SUNDSTRÖM J, ARNLÖV J, et al. Insulin resistance and risk of congestive heart failure[J]. JAMA, 2005, 294(3): 334–341. DOI:10.1001/jama.294.3.334 |
| [2] | SHEN Y, LINDEMEYER A K, GONZALEZ C, et al. Dihydromyricetin as a novel anti-alcohol intoxication medication[J]. J Neurosci, 2012, 32(1): 390–401. DOI:10.1523/JNEUROSCI.4639-11.2012 |
| [3] | XIA J, GUO S, FANG T, et al. Dihydromyricetin induces autophagy in HepG2 cells involved in inhibition of mTOR and regulating its upstream pathways[J]. Food Chem Toxicol, 2014, 66: 7–13. DOI:10.1016/j.fct.2014.01.014 |
| [4] | ZHANG Q, LIU J, LIU B, et al. Dihydromyricetin promotes hepatocellular carcinoma regression via a p53 activation-dependent mechanism[J]. Sci Rep, 2014, 4: 4628. DOI:10.1038/srep04628 |
| [5] | WU S, LIU B, ZHANG Q, et al. Dihydromyricetin reduced Bcl-2 expression via p53 in human hepatoma HepG2 cells[J]. PLoS One, 2013, 8(11): e76886. DOI:10.1371/journal.pone.0076886 |
| [6] | LIAO W, NING Z, MA L, et al. Recrystallization of dihydromyricetin from Ampelopsis grossedentata and its anti-oxidant activity evaluation[J]. Rejuvenation Res, 2014, 17(5): 422–429. DOI:10.1089/rej.2014.1555 |
| [7] | SHI L, ZHANG T, LIANG X, et al. Dihydromyricetin improves skeletal muscle insulin resistance by inducing autophagy via the AMPK signaling pathway[J]. Mol Cell Endocrinol, 2015, 409: 92–102. DOI:10.1016/j.mce.2015.03.009 |
| [8] | WRANN C D, WHITE J P, SALOGIANNNIS J, et al. Exercise induces hippocampal BDNF through a PGC-1α/FNDC5 pathway[J]. Cell Metab, 2013, 18(5): 649–659. DOI:10.1016/j.cmet.2013.09.008 |
| [9] | WITTELES R M, FOWLER M B. Insulin-resistant cardiomyopathy clinical evidence, mechanisms, and treatment options[J]. J Am Coll Cardiol, 2008, 51(2): 93–102. DOI:10.1016/j.jacc.2007.10.021 |
| [10] | FANG Z Y, PRINS J B, MARWICK T H. Diabetic cardiomyopathy: evidence, mechanisms, and therapeutic implications[J]. Endocr Rev, 2004, 25(4): 543–567. DOI:10.1210/er.2003-0012. |
| [11] |
张平, 郭莹, 张宇, 等. PGC-1α与心脏生理和疾病关系的研究进展[J].
山东医药, 2012, 52(28): 88–90, 93.
ZHANG P, GUO Y, ZHANG Y, et al. Progress in the relation between PGC-1α and cardiac physiology and diseases[J]. Shandong Med J, 2012, 52(28): 88–90, 93. DOI:10.3969/j.issn.1002-266X.2012.28.037 |
| [12] | WANG Q, LI C, ZHANG Q, et al. The effect of Chinese herbs and its effective components on coronary heart disease through PPARs-PGC1α pathway[J]. BMC Complement Altern Med, 2016, 16(1): 514. DOI:10.1186/s12906-016-1496-z |
| [13] | XU X, YING Z, CAI M, et al. Exercise ameliorates high-fat diet-induced metabolic and vascular dysfunction, and increases adipocyte progenitor cell population in brown adipose tissue[J]. AJP: Regulatory, Integrative and Comparative Physiology, 2011, 300(5): R1115–R1125. DOI:10.1152/ajpregu.00806.2010 |
| [14] | ZADEGAN F G, GHAEDI K, KALANTAR S M, et al. Cardiac differentiation of mouse embryonic stem cells is influenced by a PPAR γ/PGC-1α-FNDC5 pathway during the stage of cardiac precursor cell formation[J]. Eur J Cell Biol, 2015, 94(6): 257–266. DOI:10.1016/j.ejcb.2015.04.002 |
| [15] | AYDIN S, KULOGLU T, AYDIN S, et al. Cardiac, skeletal muscle and serum irisin responses to with or without water exercise in young and old male rats: cardiac muscle produces more irisin than skeletal muscle[J]. Peptides, 2014, 52: 68–73. DOI:10.1016/j.peptides.2013.11.024 |



