结直肠癌(colorectal cancer,CRC)是人类最常见的消化系统恶性肿瘤之一。随着我国的环境及饮食结构的变化,其发生率和死亡率呈明显上升趋势[1]。代谢重编程是肿瘤发生、发展过程中的重要特征[2],其中糖代谢发挥着重要作用,抑制糖酵解可以明显抑制肿瘤增殖和侵袭转移,表明糖酵解在肿瘤的发生、发展中具有重要作用[3]。目前研究证实结直肠癌为糖酵解异常增强的恶性肿瘤[4]。
6-磷酸果糖激酶-2(6-phosphofructokinase-2,PFKFB)是合成2, 6-双磷酸果糖(2, 6-diphosphate fructose,F-2, 6-P2) 的酶,广泛存在于各种生物细胞中,而F-2, 6-P2是6-磷酸果糖激酶-1(6-phosphofructo-1-kinase,PFK-1) 的变构激活剂和糖酵解的最有效的刺激剂。PFKFB家族通过调节F-2, 6-P2表达进而调控细胞内的糖酵解水平[5]。目前已知的同工酶有PFKFB1、PFKFB2、PFKFB3、PFKFB4四种,分别由不同的基因PFKFB1~4编码,位于不同的染色体上[6]。这些酶的表达水平和活性由激素和代谢物调控[7-8]。所有同工酶均含有激酶和磷酸酶活性的高度保守的核心结构。
现有研究表明PFKFB能够发挥促癌因子的作用[9],但其在结直肠癌中的表达及其与患者预后的关系尚不十分清楚。因此,本研究检测了PFKFB在结直肠癌和癌旁组织中的表达情况,评估PFKFB与HIF-1α之间的表达相关性,并探讨其与患者临床病理特征、预后等的关系。
1 资料与方法 1.1 临床病例收集第三军医大学西南医院2015年1-8月手术切除结直肠癌标本共90例,含对应癌旁组织标本(距肿瘤边缘3 cm以内)90例。所得标本经4%中性多聚甲醛固定,常规石蜡包埋,制作成3 μm厚切片。经HE染色后,经由两名资深病理医师共同做出病理学诊断并评分。采用组织芯片制作仪(Beecher公司,美国)制作组织芯片(取样针直径1 mm)。每例标本取2~3个点,共制作蜡块2个,含90例结直肠癌样本及90对应癌旁组织。
1.2 试剂和仪器兔抗人PFKFB1、PFKFB2、PFKFB3、PFKFB4、HIF-1α单克隆抗体(英国Biorbyt公司),免疫组化试剂盒(S-P9001,中杉金桥公司),DAB显色试剂盒(ZLI-9017,中杉金桥公司),EDTA(ZLI-9069,中杉金桥公司),中性树胶(G8590,Solarbio公司)。
1.3 实验方法 1.3.1 免疫组化染色石蜡组织切片于60 ℃烤箱烤片,二甲苯脱蜡、酒精浓度梯度降序复水,磷酸盐缓冲液PBS洗涤3次,每次3 min;3%过氧化氢室温孵育10 min,PBS洗涤3次,每次3 min;高温水浴条件下用EDTA缓冲液行抗原修复15 min,于室温待其自然冷却;PBS洗涤3次,每次5 min,用山羊血清封闭20 min,37 ℃;滴加一抗PFKFB1(1:300)、PFKFB2(1:250)、PFKFB3(1:300)、PFKFB4(1:200)、HIF-1α(1:200),37 ℃孵育1 h,4 ℃孵育过夜(总时间>18 h)。室温下复温1 h;PBS洗涤3次,每次5 min,滴加生物素标记山羊抗兔二抗于37 ℃孵育20~30 min;PBS洗涤3次,每次5 min,滴加辣根酶链霉卵白素于37 ℃孵育20 min;PBS洗涤3次,每次5 min,1:1新鲜配制的DAB显色液显色;自来水冲洗10 min;苏木精复染22 s,自来水冲洗10 min;放入60 ℃双蒸水10 min;酒精浓度梯度升序、二甲苯脱水,风干后用盖玻片、中性树胶封片。
1.3.2 结果判定免疫组化染色结果由资深病理医师参照相关免疫组化反应结果的判断标准对免疫组化结果进行判定[10],以细胞出现棕黄色颗粒为阳性结果。采用半定量法依照染色强度及染色细胞百分比进行判定。染色强度计分方法:无阳性染色0分,淡黄色1分,棕黄色2分,棕褐色3分;阳性染色细胞构成比计分方法:无阳性染色细胞0分,阳性细胞百分比≤10%为1分,阳性细胞百分比11%~50%为2分,阳性细胞百分比51%~75%为3分,阳性细胞百分比>75%为4分。最终评分为染色强度分数与阳性细胞百分比分数的乘积,0~6分为低表达,7分以上为高表达。
1.4 统计学处理采用SPSS 19.0统计软件。检测因素和临床病理学的关联特征采用Pearsons χ2检验和Spearman秩相关检验。生存分析建模时间是从结肠癌患者手术日期到死亡日期为止计算。死于结肠癌以外的原因和生存的患者在研究结束时被认定为删失。生存分析使用Kaplan-Meier方法计算总生存期(OS)。对数秩检测和KM生存曲线用于比较全部结肠癌患者及各亚组患者中蛋白的高表达和低表达的预后情况。Cox回归分析用于对预后因素行多变量分析。双尾检验,检验水准为0.05。
2 结果 2.1 结直肠癌组织与癌旁组织中PFKFB蛋白的表达免疫组化结果显示,PFKFB1、PFKFB2、PFKFB4蛋白主要在肿瘤细胞质中阳性表达,成灶状和弥漫分布。而PFKFB3蛋白在肿瘤细胞的细胞质和细胞核内均有阳性表达,成灶状和弥漫分布,并且相较正常肠黏膜组织,其细胞核内的表达明显增强(图 1)。90例结直肠癌标本中PFKFB1、PFKFB2、PFKFB3、PFKFB4及HIF1-α高表达例数分别为57、59、59、51和60,高表达率均显著高于相应癌旁组织,二者之间差异具有统计学意义(P < 0.05)。

|
| 图 1 免疫组织化学技术检测PFKFB家族及HIF-1α在结直肠癌组织和癌旁组织中的表达 |
2.2 结直肠癌中PFKFB蛋白与临床病理参数的关系
结直肠癌中PFKFB3蛋白表达高于癌旁组织,与肿瘤大小(P=0.044)、临床分期(P=0.022)、淋巴结转移(P=0.031)、M分期(P < 0.001) 及预后(P < 0.001) 有关,即其表达愈高,临床分期愈晚,淋巴结愈易发生转移,肿瘤也愈易远处转移,预后愈差,但与患者性别、年龄、肿瘤病理分级、T分期等无明显关联(P > 0.05,图 1、表 1)。PFKFB1、PFKFB2、PFKFB4蛋白的表达与肿瘤的转移、临床分期及预后等无明显关联(P > 0.05)。
| 临床参数 | n | PFKFB1 | PFKFB2 | PFKFB3 | PFKFB4 | HIF1-α | |||||||||
| 高表达 | P | 高表达 | P | 高表达 | P | 高表达 | P | 高表达 | P | ||||||
| 癌旁组织 | 90 | 12 | < 0.001 | 6 | < 0.001 | 21 | 0.001 | 7 | < 0.001 | 24 | 0.002 | ||||
| 癌组织 | 90 | 57 | 59 | 58 | 51 | 60 | |||||||||
| 年龄(岁) | |||||||||||||||
| ≥65 | 52 | 32 | 0.683 | 33 | 0.781 | 33 | 0.959 | 28 | 0.633 | 35 | 0.837 | ||||
| < 65 | 38 | 25 | 26 | 25 | 23 | 25 | |||||||||
| 性别 | |||||||||||||||
| 男 | 47 | 28 | 0.312 | 33 | 0.407 | 27 | 0.351 | 27 | 0.773 | 32 | 0.701 | ||||
| 女 | 43 | 29 | 26 | 31 | 24 | 28 | |||||||||
| 肿瘤最大径(cm) | |||||||||||||||
| ≥5 | 52 | 33 | 0.631 | 32 | 0.248 | 37 | 0.044 | 24 | 0.035 | 38 | 0.221 | ||||
| < 5 | 38 | 24 | 27 | 21 | 27 | 22 | |||||||||
| 淋巴结转移 | |||||||||||||||
| 有转移 | 31 | 18 | 0.268 | 22 | 0.629 | 23 | 0.031 | 19 | 0.586 | 26 | 0.005 | ||||
| 无转移 | 59 | 39 | 37 | 35 | 33 | 34 | |||||||||
| T分期 | |||||||||||||||
| T1 | 3 | 2 | 0.519 | 2 | 0.923 | 1 | 0.176 | 2 | 0.921 | 2 | 0.001 | ||||
| T2 | 10 | 5 | 4 | 5 | 5 | 4 | |||||||||
| T3 | 49 | 33 | 34 | 30 | 29 | 30 | |||||||||
| T4 | 28 | 17 | 19 | 22 | 15 | 24 | |||||||||
| 病理分级 | 0.052 | ||||||||||||||
| 低分级 | 76 | 49 | 0.579 | 53 | 0.043 | 45 | 0.113 | 46 | 0.079 | 49 | |||||
| 高分级 | 14 | 8 | 6 | 13 | 5 | 11 | |||||||||
| N分期 | |||||||||||||||
| N0 | 31 | 18 | 0.543 | 37 | 0.889 | 35 | 0.047 | 33 | 0.430 | 34 | 0.007 | ||||
| N1 | 23 | 14 | 14 | 17 | 15 | 18 | |||||||||
| N2 | 8 | 4 | 8 | 6 | 4 | 8 | |||||||||
| M分期 | |||||||||||||||
| M0 | 87 | 56 | 0.494 | 57 | 0.508 | 55 | < 0.001 | 49 | 0.704 | 57 | < 0.001 | ||||
| M1 | 3 | 1 | 2 | 3 | 2 | 3 | |||||||||
| 临床分期 | |||||||||||||||
| Ⅰ期 | 11 | 7 | 0.615 | 4 | 0.646 | 5 | 0.022 | 6 | 0.949 | 4 | 0.001 | ||||
| Ⅱ期 | 46 | 31 | 32 | 28 | 25 | 28 | |||||||||
| Ⅲ期 | 30 | 18 | 21 | 22 | 18 | 25 | |||||||||
| Ⅳ期 | 3 | 1 | 2 | 3 | 2 | 3 | |||||||||
| 预后 | |||||||||||||||
| 生存 | 37 | 20 | 0.100 | 24 | 0.987 | 28 | < 0.001 | 31 | 0.988 | 25 | < 0.001 | ||||
| 死亡 | 53 | 37 | 35 | 30 | 20 | 35 | |||||||||
2.3 结直肠癌中HIF-1α蛋白与临床病理参数以及PFKFB家族的关系
结直肠癌中HIF-1α蛋白表达高于癌旁组织,与临床分期(P=0.001)、T分期(P=0.001)、淋巴结转移(P=0.005)、M分期(P < 0.001) 及预后(P < 0.001) 有关,即其表达愈高,临床分期愈晚,T分期愈高,淋巴结愈易发生转移,肿瘤也愈易远处转移,预后愈差,但与患者性别、年龄、肿瘤大小、肿瘤病理分级等无明显关联(P > 0.05,图 1、表 1)。我们利用Spearman秩相关分析发现,PFKFB1、PFKFB2、PFKFB4和HIF-1α的表达无明显相关性(P > 0.05)。而PFKFB3和HIF-1α两种蛋白在结直肠癌中的表达存在显著相关性(r=0.627,P < 0.001)。
2.4 结直肠癌PFKFB3蛋白表达与临床预后的关系为了明确PFKFB3蛋白在结直肠癌中的表达与临床预后的关系,我们对90例结直肠癌中PFKFB3的表达与患者总生存时间进行了生存分析,发现PFKFB3的高表达组与低表达组肿瘤患者的生存曲线分布差异有统计学意义(P=0.008),表现为PFKFB3高表达的患者比低表达的患者预后更差。我们将患者按照肿瘤的大小、临床分期、是否有淋巴结转移分组后进行生存分析,发现在肿瘤最大直径<5 cm,临床分期Ⅰ、Ⅱ期以及淋巴结无转移的肿瘤患者中PFKFB3的高表达组与低表达组的生存曲线分布差异无统计学意义(P=0.490,P=0.310,P=0.189);肿瘤最大直径≥5 cm,临床分期Ⅲ、Ⅳ期和淋巴结有转移的肿瘤患者中PFKFB3的高表达组与低表达组的生存曲线分布差异有统计学意义(P=0.009,P=0.012,P=0.045),都表现为PFKFB3高表达组患者生存状况要显著差于PFKFB3低表达组患者。此结果说明了在肿瘤最大直径≥5 cm,临床分期Ⅲ、Ⅳ期和淋巴结出现转移的肿瘤患者中PFKFB3高表达更具有作为预后不良指标的意义(图 2)。
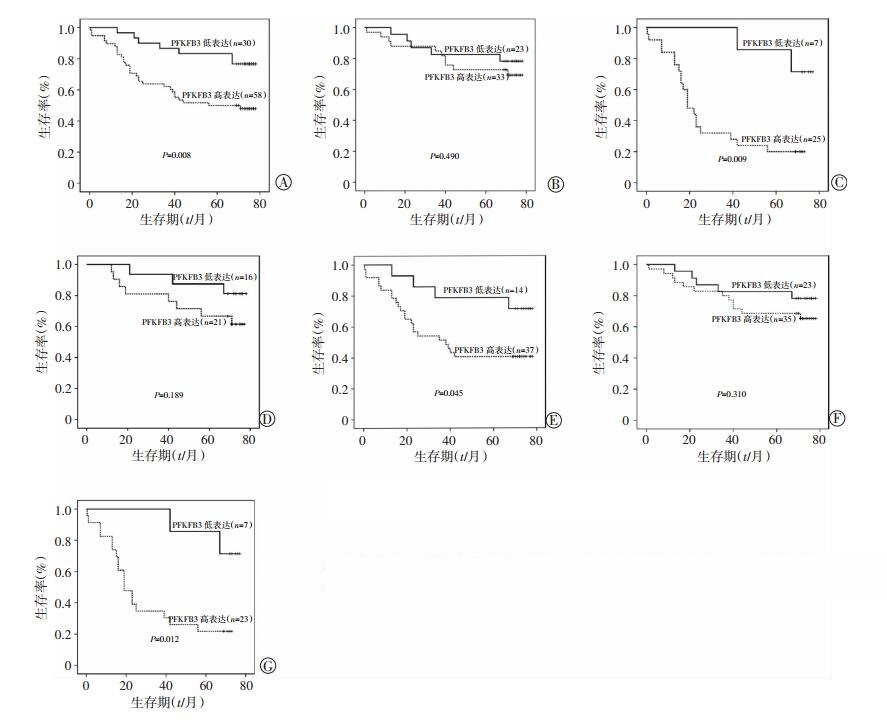
|
| A:全部患者; B:临床分期Ⅰ期和Ⅱ期; C:临床分期Ⅲ期和Ⅳ期; D:肿瘤最大径<5 cm; E:肿瘤最大径>5 cm; F:淋巴结无转移; G:淋巴结有转移 图 2 结直肠癌患者PFKFB3相关Kaplan-Meier生存分析 |
2.5 结直肠癌PFKFB3蛋白表达作为临床诊断和预后指标多因素分析
COX多因素回归分析结果显示,在淋巴结转移、肿瘤大小、病理分级、临床分期、PFKFB3表达这几个因素中,对患者生存有影响的是临床分期和PFKFB3的表达。其中临床高分期(风险比HR=5.001,95%CI=1.021~24.488,P=0.047,表 2)、PFKFB3高表达(HR=2.561,95%CI=1.021~24.488,P=0.027,表 2)是结直肠癌患者预后的危险因素。因此,PFKFB3的表达和临床分期可作为结直肠癌的预后指标。
| 变量 | 危险因素 | HR(95%CI) | P |
| 淋巴结转移 | 有转移 | 0.612(0.136~2.754) | 0.523 |
| 肿瘤最大直径 | ≥5 cm | 0.554(0.270~1.138) | 0.108 |
| 病理分级 | 高分级 | 1.332(0.592~2.998) | 0.488 |
| 临床分期 | Ⅲ、Ⅳ期 | 5.001(1.021~24.488) | 0.047 |
| PFKFB3表达 | 高表达 | 2.561(1.112~5.899) | 0.027 |
3 讨论
PFKFB是肿瘤糖酵解的重要调节因子,已证实PFKFB家族对一些肿瘤的发生、发展起着重要的作用。然而,临床上PFKFB与结直肠癌的关系尚不十分明确。本研究报道了PFKFB家族在结直肠癌中的表达及其预后价值,能够作为结直肠癌临床预后的指标,其进一步关系还有待深入证实与研究。
PFKFB是合成2, 6-双磷酸果糖的酶,在所有的PFKFB同工酶中,PFKFB3具有的激酶活性比双磷酸酶活性要高700倍左右[11],有利于细胞内F-2, 6-P2的生成和糖酵解的进行。目前研究显示PFKFB3可以促进正常的血管生成以及多种肿瘤细胞的生长[12]。最近的研究发现,癌基因结肠癌转移相关基因-1(MACC1) 和PFKFB2蛋白的过表达与肝癌TNM分期及患者预后密切相关,MACC1可能部分通过调控PFKFB2磷酸化和糖代谢来影响肿瘤的生长[13]。PFKFB4是胶质瘤干样细胞[14]和前列腺癌细胞[15]生存所必需的,但不影响正常细胞的存活。四种PFKFB同工酶也具有一定的组织特异性:PFKFB1主要存在于肝脏和骨骼肌组织中;PFKFB2在心脏,肾脏,胰腺和淋巴组织中较多;PFKFB4主要分布于脑和睾丸;而PFKFB3分布范围较广,特别是在胎盘、脑和大多数肿瘤细胞中[16]。以上说明,PFKFB家族在多种肿瘤中的作用同糖代谢密切相关,可能通过相互调控来促进肿瘤的恶性进展。它们在体内的分布也具有空间特异性,分别行使不同的功能,在不同的肿瘤中所起的促癌作用的大小也不尽相同。因此,有必要检测其在肿瘤中的表达情况并分析其在临床当中的预后价值。本研究应用高通量组织芯片及免疫组化技术检测了90例结直肠癌组织及相应癌旁组织中PFKFB3及其同工酶的表达,结果发现在癌旁组织中PFKFB3低表达,而癌组织中PFKFB3高表达。这和已有研究PFKFB3在其他肿瘤中表达上调的结果相一致,并且癌组织中PFKFB3表达的上调与肿瘤的大小、临床分期、淋巴结转移及预后相关,PFKFB3高表达能够提示结直肠癌患者预后较差,并且在结直肠癌临床分期为Ⅲ、Ⅳ期、有淋巴结转移和肿瘤最大直径≥5 cm的肿瘤患者中,PFKFB3高表达能够作为患者预后不良的独立指标。另外,PFKFB3在结肠癌细胞核内的表达也明显增强,而已知糖酵解过程发生于细胞液,说明PFKFB3在结肠癌中大量转运入核内可能通过另一种机制促进了结肠癌的进展。已有研究表明,在宫颈癌和肺癌细胞中,PFKFB3蛋白大量进入核内,其产物F-2, 6-P2能够激活细胞周期蛋白依赖性激酶(Cdks),并通过Cdk1介导的p27的磷酸化作用进而调控细胞的增殖和凋亡[17]。本研究中观察到的PFKFB3核内高表达的现象可能也是通过同一机制来影响结肠癌细胞的周期和凋亡。
研究表明,肿瘤细胞在线粒体氧化磷酸化途径供给ATP不足时,采用糖酵解方式提供能量来满足其快速生长的需要,甚至在有氧的条件下,肿瘤细胞仍然采用糖酵解方式进行糖代谢以提供能量,即“有氧糖酵解”(aerobic-glycolysis),亦称为“Warburg效应”[18]。肿瘤细胞这种由需氧到缺氧的适应需要促进葡萄糖转运和相关基因的激活。缺氧对基因表达的调节与HIF-1α基因的激活有关,HIF-1α可以与低氧反应基因中的特异性增强子元件结合[19]。HIF-1α[20]和p38/MK2信号通路[21]可以转录激活PFKFB3的表达,PFKFB3丝氨酸第461位点磷酸化也可以上调其表达,促进肿瘤细胞的增殖[22]。已有研究显示,PFKFB1、PFKFB2基因在体内是由缺氧诱导表达的,而且缺氧诱导的强度具有器官、组织或细胞水平特异性[23]。此外,过渡金属、铁螯合剂和氧化戊二酸类似物通过抑制能够负性调控HIF-1α水平和活性来模拟缺氧条件的羟化酶,也能诱导PFKFB3的表达[24-26]。在胃腺癌细胞和胰腺癌细胞中发现,PFKFB4蛋白对缺氧的反应性最大,在几种同工酶中表达最高。此外,在胰腺癌和胃癌细胞中PFKFB-3和PFKFB-4 mRNA的表达与HIF-1α、VEGF和GLUT1基因的表达呈正相关[27]。这说明PFKFB家族的功能同HIF-1α紧密相关,通过相互调控来促进肿瘤的进展。本研究免疫组化结果显示,HIF-1α在结直肠癌中高表达;Spearman相关分析表明,在结直肠癌中PFKFB1、PFKFB2、PFKFB4和HIF-1α的表达无明显相关性(P > 0.05),而PFKFB3和HIF-1α两种蛋白在结直肠癌中的表达存在显著正相关(r=0.627,P < 0.01)。进一步证实了结直肠癌中存在明确的缺氧现象,并且缺氧同PFKFB3基因的激活与表达上调相关,从而促进肿瘤的糖酵解。
因此,我们认为PFKFB3高表达可能促进结直肠癌的发生、发展,在结直肠癌中作为一种肿瘤促进因子发挥作用,并且与HIF-1α具有协同促癌作用,能够对结直肠癌,特别对晚期肿瘤患者的预后具有预测价值。这些发现还需要在回顾性和前瞻性研究中得到进一步证实,PFKFB3在结直肠癌中的功能和特性也需要更详细的阐释。我们今后将扩大样本量统计PFKFB3 mRNA及蛋白水平在结直肠癌组织中的表达,进一步在结肠癌细胞系中进行体外实验及动物体内实验,探明PFKFB3的高表达是否可以促进结直肠癌发生、发展及其具体分子机制,以明确PFKFB3是否可作为结直肠癌临床治疗的潜在靶点,为结直肠癌的临床治疗开辟新的途径。
| [1] | American Cancer Society. Colorectal Cancer Facts & Figures 2011-2013[EB/OL]. 2011, [2016-10-20]. |
| [2] | Tennant D A, Durán R V, Gottlieb E. Targeting metabolic transformation for cancer therapy[J]. Nat Rev Cancer, 2010, 10(4): 267–277. DOI:10.1038/nrc2817 |
| [3] | Cairns R A, Harris I S, Mak T W, et al. Regulation of cancer cell metabolism[J]. Nat Rev Cancer, 2011, 11(2): 85–95. DOI:10.1038/nrc2981 |
| [4] | Gold J. Metabolic profiles in human solid tumors.I.A new technic for the utilization of human solid tumors in cancer research and its application to the anerobic glycolysis of isologous benign and malignant colon tissues[J]. Cancer Res, 1966, 26(4): 695–705. |
| [5] | Guo Y, Feng L, Zhou Y, et al. Systematic review with meta-analysis: HIF-1α attenuates liver ischemia-reperfusion injury[J]. Transplant Rev (Orlando), 2015, 29(3): 127–134. DOI:10.1016/j.trre.2015.05.001 |
| [6] | Warmoes M O, Locasale J W. Heterogeneity of glycolysis in cancers and therapeutic opportunities[J]. Biochem Pharmacol, 2014, 92(1): 12–21. DOI:10.1016/j.bcp.2014.07.019 |
| [7] | Semenza G L. Hypoxia-inducible factor 1 and cardiovascular disease[J]. Annu Rev Physiol, 2014, 76: 39–56. DOI:10.1146/annurev-physiol-021113-170322 |
| [8] | Bloch K, Smith H, van Hamel Parsons V, et al. Metabolic Alterations During the Growth of Tumour Spheroids[J]. Cell Biochem Biophys, 2014, 68(3): 615–628. DOI:10.1007/s12013-013-9757-7 |
| [9] | Chesney J, Mitchell R, Benigni F, et al. An inducible gene product for 6-phosphofructo-2-kinase with an AU-rich instability element:role in tumor cell glycolysis and the Warburg effect[J]. Proc Natl Acad Sci U S A, 1999, 96(6): 3047–3052. DOI:10.1073/pnas.96.6.3047 |
| [10] |
许良中, 杨文涛. 免疫组织化学反应结果的判断标准[J].
中国癌症杂志, 1996, 6(4): 229–231.
Xu L Z, Yang W T. Criteria for judging the results of immunohistochemistry[J]. Chin Oncol, 1996, 6(4): 229–231. |
| [11] | Yalcin A, Clem B F, Simmons A, et al. Nuclear targeting of 6-phosphofructo-2-kinase (PFKFB3) increases proliferation via cyclin-dependent kinases[J]. J Biol Chem, 2009, 284(36): 24223–24232. DOI:10.1074/jbc.M109.016816 |
| [12] | De Bock K, Georgiadou M, Schoors S, et al. Role of PFKFB3-driven glycolysis in vessel sprouting[J]. Cell, 2013, 154(3): 651–663. DOI:10.1016/j.cell.2013.06.037 |
| [13] | Ji D, Lu Z T, Li Y Q, et al. MACC1 expression correlates with PFKFB2 and survival in hepatocellular carcinoma[J]. Asian Pac J Cancer Prev, 2014, 15(2): 999–1003. DOI:10.7314/APJCP.2014.15.2.999 |
| [14] | Goidts V, Bageritz J, Puccio L, et al. RNAi screening in glioma stem-like cells identifies PFKFB4 as a key molecule important for cancer cell survival[J]. Oncogene, 2012, 31(27): 3235–3243. DOI:10.1038/onc.2011.490 |
| [15] | Ros S, Santos C R, Moco S, et al. Functional metabolic screen identifies 6-phosphofructo-2-kinase/fructose-2, 6-biphosphatase 4 as an important regulator of prostate cancer cell survival[J]. Cancer Discov, 2012, 2(4): 328–343. DOI:10.1158/2159-8290.CD-11-0234 |
| [16] | Unwith S, Zhao H, Hennah L, et al. The potential role of HIF on tumour progression and dissemination[J]. Int J Cancer, 2015, 136(11): 2491–2503. DOI:10.1002/ijc.28889 |
| [17] | Yalcin A, Clem B F, Imbert F Y, et al. 6-Phosphofructo-2-kinase (PFKFB3) promotes cell cycle progression and suppresses apoptosis via Cdk1-mediated phosphorylation of p27[J]. Cell Death Dis, 2014, 5: e1337. DOI:10.1038/cddis.2014.292 |
| [18] | Warburg O, Wind F, Negelein E, et al. The metabolism of tumors in the body[J]. J Gen Physiol, 1927, 8(6): 519–530. DOI:10.1085/jgp.8.6.519 |
| [19] | Dornbos D 3rd, Zwagerman N, Guo M, et al. Preischemic exercise reduces brain damage by ameliorating metabolic disorder in ischemia/reperfusion injury[J]. J Neurosci Res, 2013, 91(6): 818–827. DOI:10.1002/jnr.23203 |
| [20] | Obach M, Navarro S A, Caro J, et al. 6-Phosphofructo-2-kinase (PFKFB3) gene promoter contains hypoxia-inducible factor-1 binding sites necessary for transactivation in response to hypoxia[J]. J Biol Chem, 2004, 279(51): 53562–53570. DOI:10.1074/jbc.M406096200 |
| [21] | Novellasdemunt L, Bultot L, Manzano A, et al. PFKFB3 activation in cancer cells by the p38/MK2 pathway in response to stress stimuli[J]. Biochem J, 2013, 452(3): 531–543. DOI:10.1042/BJ20121886 |
| [22] | Bando H, Atsumi T, Nishio T, et al. Phosphorylation of the 6-phosphofructo-2-kinase/fructose 2, 6-bisphosphatase/PFKFB3 family of glycolytic regulators in human cancer[J]. Clin Cancer Res, 2005, 11(16): 5784–5792. DOI:10.1158/1078-0432 |
| [23] | Minchenko O, Opentanova I, Caro J. Hypoxic regulation of the 6-phosphofructo-2-kinase/fructose-2, 6-bisphosphatase gene family (PFKFB-1-4) expression in vivo[J]. FEBS Lett, 2003, 554(3): 264–270. DOI:10.1016/S0014-5793(03)01179-7 |
| [24] | Doherty J R, Cleveland J L. Targeting lactate metabolism for cancer therapeutics[J]. J Clin Invest, 2013, 123(9): 3685–3692. DOI:10.1172/JCI69741 |
| [25] | Granchi C, Minutolo F. Anticancer agents that counteract tumor glycolysis[J]. Chem Med Chem, 2012, 7(8): 1318–1350. DOI:10.1002/cmdc.201200176 |
| [26] | Michael C C, Song G K, David N, et al. Molecular basis of the fructose-2, 6-bisphosphatase reaction of PFKFB3:Transition state and the C-terminal function[J]. Proteins, 2012, 80(4): 1143–1153. DOI:10.1002/prot.24015 |
| [27] | Bobarykina A Y, Minchenko D O, Opentanova I L, et al. Hypoxic regulation of PFKFB-3 and PFKFB-4 gene expression in gastric and pancreatic cancer cell lines and expression of PFKFB genes in gastric cancers[J]. Acta Biochim Pol, 2006, 53(4): 789–799. |



