2. 400038 重庆,第三军医大学:军事预防医学院全军复合伤研究所,创伤、烧伤与复合伤国家重点实验
2. State Key Laboratory of Trauma, Burns and Combined Injury, Institute of Combined Injury, College of Military Preventive Medicine, Third Military Medical University, Chongqing, 400038, China
肠道是机体更新速度最快的组织之一,对电离辐射高度敏感。放射治疗是盆腹腔肿瘤治疗的一个重要手段,然而其副反应如放射性肠炎严重影响患者的生存质量,且尚无有效的治疗手段[1-2]。在核事故造成的急性放射病中,肠道损伤导致的感染和水电解质紊乱也是影响患者病情转归的重要因素。目前肠上皮细胞辐射损伤修复的体外模型多以永生化前体细胞系、结肠肿瘤细胞株为基础,而这些细胞系在干性和辐射敏感性等方面与在体肠干细胞存在差异。最近Hans Clevers实验室通过添加相关因子模拟在体的相关信号通路,利用基质胶提供细胞基质支持,实现了肠干细胞和隐窝克隆体外培养[3]。虽然已经有研究者开始利用隐窝克隆培养研究肠道细胞的辐射损伤机制[4],但是还缺少P53相关信号通路的基础性研究数据。
P53信号通路是隐窝细胞辐射后诱导的主要信号网络[5]。在一定照射剂量范围内,P53可转录激活促凋亡分子,诱导肠干细胞和前体细胞快速死亡;同时也会激活周期阻滞分子如P21,通过促进细胞G1/S期阻滞来帮助修复DNA。P53-/-肠干细胞受照后可维持正常的细胞周期,当超过一定照射剂量时,如10 Gy,细胞会发生有丝分裂灾难,从而加重干细胞损伤[6]。本研究基于接种24 h后的小肠隐窝建立体外辐照模型,观察野生型和P53-/-小鼠隐窝克隆的死亡和再生。为相关机制研究和辐射防护药物筛选提供依据。
1 材料与方法 1.1 实验动物和主要材料SPF级C57BL/6雄性小鼠,6~8周龄,体质量20~ 24 g,购自第三军医大学实验动物中心;P53-/-雄性小鼠,8周龄,体质量18~22 g,由本课题组繁殖。
EGF (PeproTech,美国);NAC (Sigma,美国);R-spondin (R & D,美国);Noggin (PeproTech,美国);TRIzol (Thermo,美国);低温离心机 (Eppendorf,德国);RS2000辐照仪 (Rad source Technologies,美国);倒置显微镜 (奥林巴斯X70,日本)。
1.2 小鼠基因型鉴定参照BiotoolTM Mouse Direct PCR Kit (B4001) 试剂盒操作说明。小鼠脚趾剪回后,加入50 μL消化液,55 ℃金属浴消化30 min,95 ℃金属浴5 min灭活蛋白酶活性;PCR扩增;琼脂糖凝胶电泳。PCR反应条件:20 μL反应体系,预变性95 ℃ 5 min,PCR反应阶段95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,34个循环。
| 引物名称 | 引物序列 |
| P036-RG-WT | 5′-GCCCTCTCCCACAGCAGATTCT-3′ |
| P037-RG-Com | 5′-CCACGAGCGCCACTTCCACTAT-3′ |
| P038-RG-Mut | 5′-AGTCTGCACTCTCCGAGTCGCT-3′ |
1.3 培养基的配制
DMEM/F12培养基,含1×B27,1×N2、1×双抗、1×GlutaMAX,HEPES 10 mmol/L、NAC 500 μmol/L。
1.4 小肠隐窝的分离和培养颈椎脱臼法处死小鼠,取整段小肠用含双抗D-Hanks洗净,剪成小段,置含有30 mmol/L EDTA的D-Hanks中,冰上静置20 min;更换为不含EDTA的D-Hanks后置冰上静置10 min;手持离心管上下振荡,悬液通过70 μm的滤网过滤,过滤后的细胞悬液经4 ℃,450 r/min离心5 min,可得小肠隐窝;小肠隐窝用D-Hanks反复洗涤;取适量隐窝转移至新的经5%BSA预处理的EP管中,离心;采用3D培养体系进行培养:将基质胶 (含R-spondin 1 μg/mL、Noggin 100 ng/mL、EGF 50 ng/mL) 和隐窝混匀后接种到96孔板内,10 μL/孔,然后迅速将培养板置37 ℃培养箱中放置20 min,使凝胶凝固;培养基内加入Y27632(浓度为10 μmol/L),混匀后按100 μL/孔加入96孔板,置细胞培养箱培养。
1.5 隐窝辐照于96孔板接种隐窝,每组7孔。接种24 h后,予RS2000辐照仪X线照射,总剂量为4~10 Gy。辐照参数为:电流15 mA,电压160 kV,剂量率0.77 Gy/min,6 Gy耗时467 s。辐照完成后置37 ℃,5%CO2的培养箱继续培养。
1.6 RNA提取及检测隐窝接种24 h后,给予6 Gy辐照,分别于辐照前 (R0h),辐照后4(R4h)、8(R8h)、12(R12h)、24 h (R24h) 提取隐窝RNA。RNA提取、逆转录、实时荧光定量PCR操作参考试剂盒说明。引物序列均由上海英骏生物技术有限公司合成、纯化。PCR反应条件:20 μL反应体系,预变性阶段95 ℃ 5 min,PCR反应阶段95 ℃变性10 s,59 ℃退火10 s,72 ℃延伸30 s,39个循环后增加融解曲线反应至终止。实验均以Tbp及Hprt为内参。
| 扩增基因 | 引物序列 | 产物长度 (bp) |
| Ascl2 | 正义链:5′-CCTGGTGGACCTACCTGCTTCT-3′ | 24 |
| 反义链:5′-GCAGAGGTCAGTCAGCACTTGG-3′ | 23 | |
| Bax | 正义链:5′-CAGGATGCGTCCACCAAGAAGC-3′ | 22 |
| 反义链:5-GTCCGTGTCCACGTCAGCAATC-3′ | 24 | |
| Bbc3 | 正义链:5′-ACGAGCGGCGGAGACAAGAA-3′ | 20 |
| 反义链:5′-GTAGGCACCTAGTTGGGCTCCA-3′ | 22 | |
| Bcl2l1 | 正义链:5-GCACTGTGCGTGGAAAGCGTA-3′ | 21 |
| 反义链:5-CTCTCGGCTGCTGCATTGTTCC-3′ | 22 | |
| Hprt | 正义链:5′-TGGATACAGGCCAGACTTTGTT-3′ | 22 |
| 反义链:5′-CAGATTCAACTTGCGCTCATC-3′ | 21 | |
| Lgr5 | 正义链:5′-CGTTGTCAGCCGTGGTCATAGC-3′ | 24 |
| 反义链:5′-GCCCTGCGTTTGAGCACTGAA-3′ | 23 | |
| Mdm2 | 正义链:5′-TAGCAGCAGCAGCAGCGAGT-3′ | 20 |
| 反义链:5′-GCCCTTCGTCACTCAGGCTGTA-3′ | 22 | |
| Olfm4 | 正义链:5′-AAGTGACCTTGTGCCTGCCAC-3′ | 23 |
| 反义链:5′-CACCACGCCACCATGACTACAG-3′ | 24 | |
| P21 | 正义链:5′-GAGGCAGACCAGCCTGACAGAT-3′ | 22 |
| 反义链:5′-CCTCCTGACCCACAGCAGAAGA-3′ | 22 | |
| Tbp | 正义链:5′-CAAACCCAGAATTGTTCTCCTT-3′ | 22 |
| 反义链:5′-ATGTGGTCTTCCTGAATCCCT-3′ | 21 |
1.7 隐窝HE染色
含隐窝的基质胶整体取出,4%中性甲醛固定15 min,PBS轻柔洗涤2次,后续脱水、石蜡包埋,切片及HE染色方法同常规组织标本处理。
1.8 小鼠辐照SPF级C57BL/6小鼠,分为实验组和对照组,每组3只,独立实验重复3次。实验组予RS2000辐照仪X线照射,电流25 mA,电压160 kV,耗时467 s,总剂量为10 Gy,剂量率1.284 Gy/min;对照组不经辐照处理。照后84 h取小肠,石蜡包埋,切片,HE染色,显微镜下计数小肠隐窝。
1.9 统计学分析采用GraphPad Prism 6软件进行分析,计量资料以x±s表示,两组间比较采用独立样本t检验,P < 0.05为差异有统计学意义。
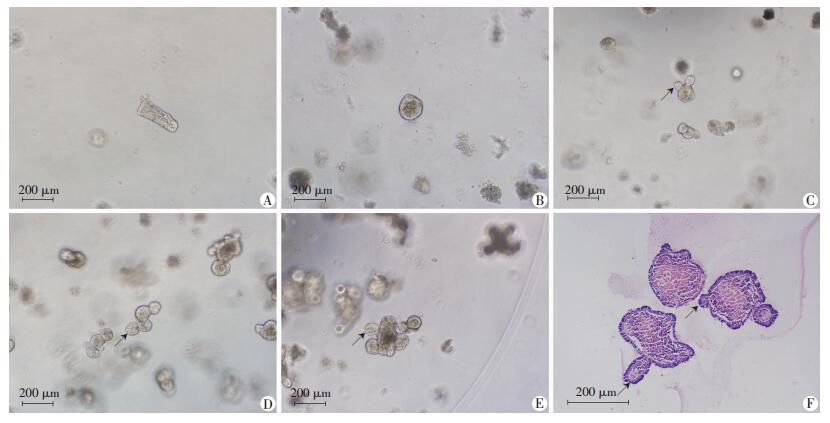
2 结果 2.1 C57BL/6小鼠隐窝的正常生长正常培养过程中,在显微镜下可见:刚接种的C57BL/6小鼠隐窝呈片段状 (图 1A);接种1 d后形成球形,克隆折光性好,其中心为腔体,内含少量细胞碎片 (图 1B);2~3 d开始“出芽”,表现为一个或多个隐窝样结构 (图 1C、D);后期经过大量出芽 (图 1E),最终形成小肠类器官:即“出芽”的隐窝结构包绕中心“囊状”的绒毛结构。图 1F箭头示突出部位为隐窝结构,“囊状”中心为绒毛结构。
|
|
↑:示出芽 A:接种0 h;B:接种1 d;C:接种2 d;D:接种3 d;E:接种4 d;F:HE染色 图 1 C57BL/6小肠隐窝正常培养的形态学改变 |
2.2 辐照对C57BL/6小鼠隐窝的影响
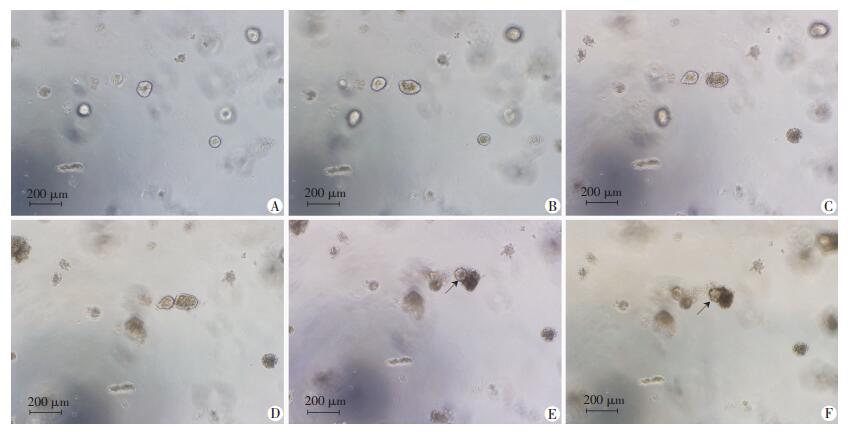
接种1 d,予6 Gy辐照后小鼠隐窝形态变化:辐照前隐窝呈圆球形,折光性好,克隆内含少量细胞碎片 (图 2A);辐照后1~3 d,未见出芽,克隆内死亡细胞增多,细胞折光性变差 (图 2B~D);辐照后4 d,克隆内可见死亡细胞增多,存活细胞仍可持续生长,形成少量出芽 (图 2E);辐照后5 d,存活细胞继续生长,折光性好 (图 2F)。
|
|
↑:示出芽 A:接种1 d;B:辐照后1 d;C:辐照后2 d;D:辐照后3 d;E:辐照后4 d;F:辐照后5 d 图 2 C57BL/6小鼠隐窝接种1 d及辐照后不同时间点形态学改变 |
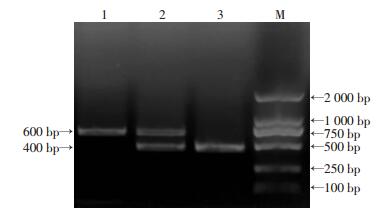
2.3 P53-/-小鼠基因型鉴定结果
结果见图 3。仅400 bp条带为野生型,仅600 bp条带为纯合子,400、600 bp条带同时出现为杂合子。
|
| M:标准 (DL2000);1:纯合子;2:杂合子;3:野生型 图 3 P53-/-基因型鉴定琼脂糖电泳图结果 |
2.4 P53-/-小鼠隐窝的正常生长
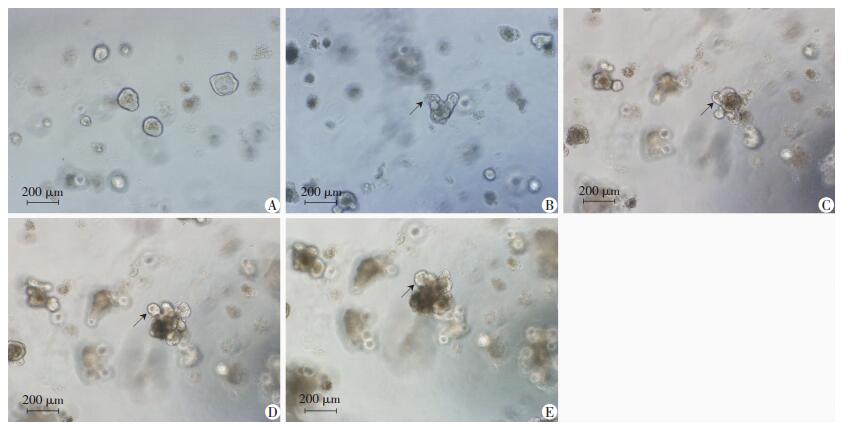
P53-/-小鼠隐窝正常生长状态与C57BL/6小鼠隐窝类似。接种1 d,隐窝呈圆球形,折光性好,克隆内部可见少量细胞碎片 (图 4A);接种2 d出芽明显,克隆内部细胞碎片增多,折光性好 (图 4B);接种3~5 d克隆体积逐步增大,出芽部位折光性好,克隆中央部位折光性欠佳 (图 4C~E)。
|
|
↑:示出芽 A:接种1 d;B:接种2 d;C:接种3 d;D:接种4 d;E:接种5 d 图 4 P53-/-小鼠隐窝正常培养的形态学改变 |
2.5 辐照对P53-/-小鼠隐窝的作用
接种1 d,予6 Gy辐照后小鼠隐窝形态变化:辐照前隐窝呈圆球形,克隆折光性好,克隆内部死亡细胞少 (图 5A);辐照后1~3 d,细胞克隆内部死亡细胞逐步增多,折光性逐步变差,仍见明显出芽,克隆体积逐步增大 (图 5B~D);辐照后4~5 d,克隆内出现大量死亡细胞,克隆中央区域折光性差,克隆周边可见较多出芽,且折光性良好 (图 5E~F)。
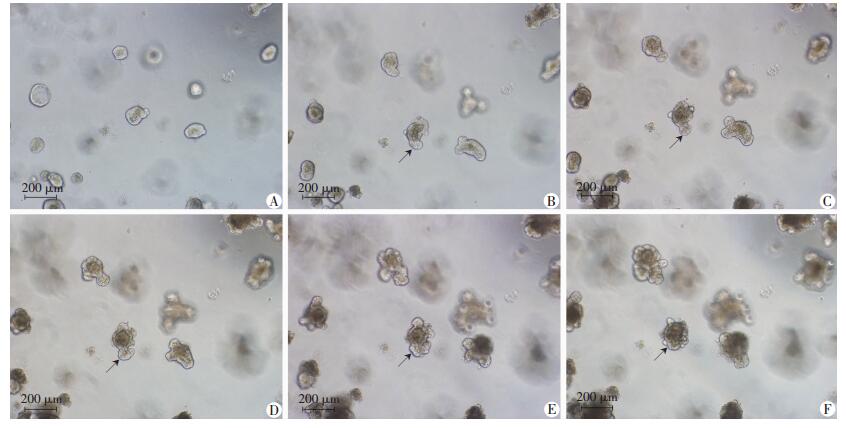
|
|
↑:示出芽 A:接种1 d;B:辐照后1 d;C:辐照后2 d;D:辐照后3 d;E:辐照后4 d;F:辐照后5 d 图 5 P53-/-小鼠隐窝接种1 d及辐照后不同时间点隐窝形态学改变 |
同等条件照后6 d,P53-/-小鼠隐窝存活率为 (83.69±5.89)%,显著高于C57BL/6小鼠隐窝[(43.84± 5.73)%,P < 0.01,n=7]。
2.6 辐照后不同时间的C57BL/6小鼠隐窝相关基因表达水平不同时间点各基因相对表达量见图 6、7。辐照后24 h组 (R24h) 促凋亡基因Bax和Bbc3分别为未辐照组的2.7倍、4.7倍;P53负调控基因Mdm2为未辐照组的3.3倍;细胞周期调控基因P21为未辐照组的4.7倍;抗凋亡基因Bcl2l1为未辐照组的2.2倍;小肠干细胞特征性表达基因Lgr5、Olfm4、Ascl2分别为未辐照组的0.11、0.46、0.22倍。
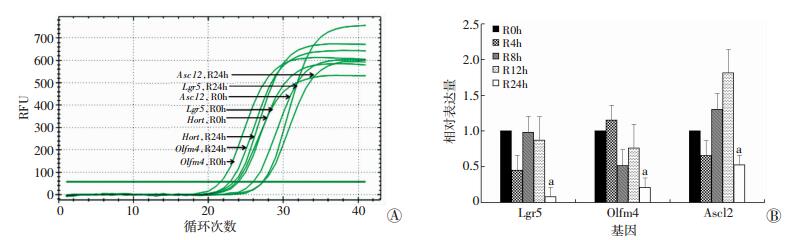
|
| A:扩增曲线;B:相对表达量a:P < 0.05,与R0h比较 图 6 C57BL/6小鼠隐窝辐照后不同时间点干细胞标志基因的相对表达量 |
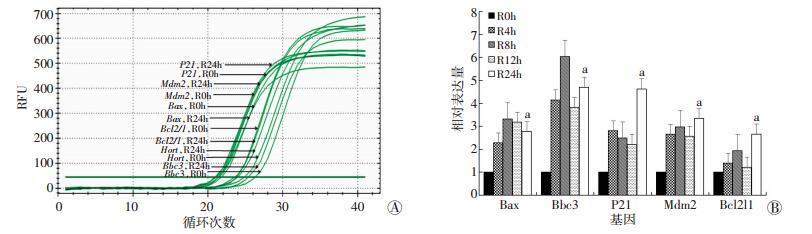
|
| A:扩增曲线;B:相对表达量a:P < 0.05,与R0h比较 图 7 C57BL/6小鼠隐窝辐照后不同时间点P53通路相关基因的相对表达量 |
2.7 辐照对C57BL/6小鼠在体小肠隐窝的影响
HE染色可见,正常小肠隐窝绒毛排列整齐,辐照84 h后隐窝缺失明显,绒毛完整性受损 (图 8)。显微镜下计数全部小肠的隐窝,隐窝内细胞数≥5个计为1个再生克隆。结果显示,辐照后84 h的C57BL/6小鼠隐窝数量为未辐照组的 (19.17±1.24)%,两者差异有统计学意义 (P < 0.01,n=3)。
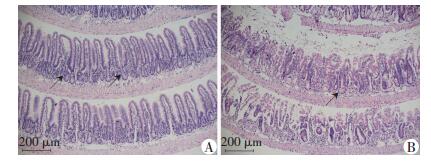
|
| A:辐照前;B:辐照后84 h ↑:示小肠隐窝 图 8 HE染色观察C57BL/6小鼠辐照前后84 h小肠形态变化 |
3 讨论
肠道隐窝干细胞对辐射非常敏感,而其损伤机制研究和辐射防护药物靶点的筛选多依赖2D培养的永生化细胞株。新近发展的隐窝干细胞3D培养技术对在体肠干细胞的基本特性,甚至解剖结构等都进行了良好的模拟[7]。小肠干细胞生活的微环境向其提供包括Wnt、EGF、BMP等在内的多种信号,使其维持自我更新、增殖和分化的能力[8]。体外3D培养系统模拟了上述几条信号通路的作用,并且用Matrigel胶代替细胞基质,就目前来看是对体内微环境最大程度的模拟[9]。本研究利用此系统,初步建立了较大剂量辐照隐窝干细胞损伤再生修复模型。
我们早期通过基因芯片分析了辐射后在体小鼠隐窝细胞不同时间的转录组变化。发现在辐射后24 h内激活的信号网络中,P53调控网络是变化最显著、最主要的信号通路[10]。因此,本研究主要围绕这一通路在体外3D培养模型中进行了相关探索。前期预实验结果提示,辐照剂量4 Gy以下对隐窝干细胞克隆影响不显著,5~6 Gy存活率急剧下降,8~9 Gy很难存活 (数据未显示),因而本研究选择了6 Gy来建立辐照模型。隐窝出芽是体外肠干细胞扩增的标志事件,本研究发现6 Gy辐射可以完全抑制野生型小鼠隐窝克隆的出芽;而P53-/-小鼠隐窝则可以继续出芽,提示大部分干细胞和前体细胞没有被射线诱导凋亡和周期阻滞。但是P53-/-小鼠隐窝难以耐受10 Gy以上剂量的辐射,与在体实验一致[11]。本实验结果表明,在没有内皮细胞、成肌纤维母细胞等多种基质微环境细胞的影响下,离体培养的3D隐窝干细胞克隆可良好模拟野生型和P53-/-小鼠隐窝辐射后表现,证实P53的确是肠干细胞辐射敏感性的关键信号通路,6 Gy照射小肠隐窝3D培养克隆模拟的是P53促凋亡因素依赖的隐窝干细胞损伤模型。
现有的辐射防护药物一般针对辐射前或者辐射后早期用药[12],考虑到辐射事故现场的侦检、急救、伤员运输等过程,照射后12~24 h可能是更实际的救治时间。如果运用离体培养的3D隐窝干细胞作为药物筛选平台,需要理解在体外模型辐射后早期关键信号通路的激活时空特点。本实验结果显示,和体内相似,体外培养的隐窝克隆可在2 h内迅速激活P53通路下游靶基因的转录,包括促凋亡基因和细胞周期调控基因。虽然P53负反馈调控分子Mdm2也在早期被诱导,但P53下游靶基因的激活可以维持24 h以上。这些结果提示,在24 h或者更长时间,对P53信号的调控应该对肠道干细胞的存活有一定的影响。最近有研究者利用细胞周期抑制剂发现其可在辐射后早期一过性干预P53的激活,达到保护肠干细胞的目的[13]。
Lgr5、Olfm4、Ascl2[14-16]是小肠干细胞的标记基因。值得注意的是,体外培养的隐窝干细胞克隆包含了干细胞和各种前体细胞。虽然Lgr5、Olfm4、Ascl2都在隐窝最底端的干细胞高表达,但是后两者不像Lgr5一样当干细胞分化为前体细胞后迅速降低。另外,相对于前体细胞,干细胞具有较强的DNA损伤修复能力和辐射抗性[17]。所以6 Gy辐射后早期存活干细胞和某些前体细胞的比例在整个隐窝克隆中可能会有所升高;但绝大部分干细胞还是在24 h内迅速死亡。这提示在干细胞死亡和克隆存活层面,6 Gy体外照射可以模拟小鼠10~11 Gy全身照射的水平。
总之,本研究通过不同品系小鼠来源的肠隐窝建立体外培养模型,系统研究了克隆存活和大剂量辐射后早期的基因调控网络,为下一步选择相应的药物进行辐射保护和肿瘤辐射增敏的研究提供了依据。
| [1] | Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [2] | Hauer-Jensen M, Denham J W, Andreyev H J, et al. Radiation enteropathy—pathogenesis, treatment and prevention[J]. Nat Rev Gastroenterol Hepatol, 2014, 11(8): 470–479. DOI:10.1038/nrgastro.2014.46 |
| [3] | Sato T, Vries R G, Snippert H J, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche[J]. Nature, 2009, 459(7244): 262–265. DOI:10.1038/nature07935 |
| [4] | Wang X, Wei L, Cramer J M, et al. Pharmacologically blocking p53-dependent apoptosis protects intestinal stem cells and mice from radiation[J]. Sci Rep, 2015, 5: 8566. DOI:10.1038/srep08566 |
| [5] | Wilson J W, Pritchard D M, Hickman J A, et al. Radiation-induced p53 and p21 WAF-1/CIP1 expression in the murine intestinal epithelium:apoptosis and cell cycle arrest[J]. Am J Pathol, 1998, 153(3): 899–909. DOI:10.1016/S0002-9440(10)65631-3 |
| [6] | Komarova E A, Kondratov R V, Wang K, et al. Dual effect of p53 on radiation sensitivity in vivo: p53 promotes hematopoietic injury, but protects from gastro-intestinal syndrome in mice[J]. Oncogene, 2004, 23(19): 3265–3271. DOI:10.1038/sj.onc.1207494 |
| [7] | Barker N. Adult intestinal stem cells: critical drivers of epithelial homeostasis and regeneration[J]. Nat Rev Mol Cell Biol, 2014, 15(1): 19–33. DOI:10.1038/nrm3721 |
| [8] | Sato T, van Es J H, Snippert H J, et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts[J]. Nature, 2011, 469(7330): 415–418. DOI:10.1038/nature09637 |
| [9] | Date S, Sato T. Mini-gut organoids: reconstitution of the stem cell niche[J]. Annu Rev Cell Dev Biol, 2015, 31: 269–289. DOI:10.1146/annurev-cellbio-100814-125218 |
| [10] | Wang F, Cheng J, Liu D, et al. P53-participated cellular and molecular responses to irradiation are cell differentiation-determined in murine intestinal epithelium[J]. Arch Biochem Biophys, 2014, 542(10): 21–27. DOI:10.1016/j.abb.2013.11.012 |
| [11] | Komarova E A, Kondratov R V, Wang K, et al. Dual effect of p53 on radiation sensitivity in vivo: p53 promotes hematopoietic injury, but protects from gastro-intestinal syndrome in mice[J]. Oncogene, 2004, 23(19): 3265–3271. DOI:10.1038/sj.onc.1207494 |
| [12] | Johnke R M, Sattler J A, Allison R R. Radioprotective agents for radiation therapy: future trends[J]. Future Oncol, 2014, 10(15): 2345–2357. DOI:10.2217/fon.14.175 |
| [13] | Wei L, Leibowitz B J, Wang X, et al. Inhibition of CDK4/6 protects against radiation-induced intestinal injury in mice[J]. J Clin Invest, 2016, 126(11): 4076–4087. DOI:10.1172/JCI88410 |
| [14] | Barker N, van Es J H, Kuipers J, et al. Identification of stem cells in small intestine and colon by marker gene Lgr5[J]. Nature, 2007, 449(7165): 1003–1007. DOI:10.1038/nature06196 |
| [15] | van der Flier L G, van Gijn M E, Hatzis P, et al. Trans-cription factor achaete scute-like 2 controls intestinal stem cell fate[J]. Cell, 2009, 136(5): 903–912. DOI:10.1016/j.cell.2009.01.031 |
| [16] | van der Flier L G, Haegebarth A, Stange D E, et al. OLFM4 is a robust marker for stem cells in human intestine and marks a subset of colorectal cancer cells[J]. Gastro-enterology, 2009, 137(1): 15–17. DOI:10.1053/j.gastro.2009.05.035 |
| [17] | Hua G, Thin T H, Feldman R, et al. Crypt base columnar stem cells in small intestines of mice are radioresistant[J]. Gastroenterology, 2012, 143(5): 1266–1276. DOI:10.1053/j.gastro.2012.07.106 |



