2.402160 重庆,重庆医科大学附属永川医院:中心实验室
2. Central Laboratory, Yongchuan Hospital of Chongqing Medical University, Chongqing, 402160, China
滴眼液是最为便捷的眼局部给药方式,但瞬目、泪液循环及角膜上皮屏障等因素限制了药物经角膜进入眼内,导致药物的生物利用度非常低(1%~5%)[1]。纳米载体给药系统由于其对药物代谢动力学的独特影响能够显著地提高药物的生物利用度。壳聚糖纳米粒(chitosan nanoparticles, CS NPs)由于其良好的生物相容性、可降解性及无毒性,广泛用于药物的缓释控释及生物医用材料等方面的研究[2-4]。然而,壳聚糖(chitosan, CS)在pH值大于6.5的环境中是不溶的,这制约了其在医药领域的应用。聚乙二醇(polyethylene glycol, PEG)具有亲水性、无毒性和免疫学惰性,是由环氧乙烷开环聚合得到的线性聚醚,已被FDA批准成为可注射用的医用高分子[5-7]。为增加壳聚糖在生理环境下(pH=7.4) 的水溶性,本研究制备了一种聚乙二醇修饰的壳聚糖纳米粒。通过负载抗真菌药物伏立康唑,我们进一步考察了聚乙二醇化壳聚糖纳米粒(PEG-CS nanoparticles,PEG-CS NPs)的眼部给药性能,包括药物的缓释能力、药物眼部代谢动力学及其角膜渗透性,为眼科创新药物基础和应用研究提供新的研究思路和理论依据。
1 材料与方法 1.1 实验材料壳聚糖(上海生工生物工程技术服务有限公司),三聚磷酸钠(上海国药集团化学试剂有限公司),伏立康唑(深圳海滨制药有限公司提供),聚乙二醇(M=2 000,Aldrieh公司),79-1磁力加热搅拌器(江苏中大仪器厂),3K-15高速低温离心机(美国Sigma公司),Zetasizer Nano ZS90纳米粒度分析仪(英国马尔文公司),S-3000N扫描电镜(日本Hitachi公司),傅立叶变换红外光谱仪(FTS3000,美国),LC-2010AHT高效液相色谱仪(日本岛津),新西兰大白兔由重庆医科大学实验动物中心提供。
1.2 PEG-CS纳米粒的制备及表征采用离子交联法制备PEG-CS纳米粒[8]。室温下取30 mL制备好的浓度为2.0 mg/mL的CS醋酸溶液,加入适量伏立康唑,使其浓度为1.5 mg/mL,充分搅拌至溶解;将三聚磷酸钠和PEG加入至12 mL双蒸水中,使其浓度分别为1.0 mg/mL和2.0 mg/mL,将上述溶液在磁力搅拌下缓慢滴加到CS醋酸溶液中,反应约30 min,即得PEG-CS纳米混悬液。
室温下取PEG-CS纳米混悬液,加去离子水稀释10倍,使用激光粒度分析仪测定纳米粒的粒径及Zeta电位。1%乙酸双氧铀染色后置于透射电镜下观察纳米粒形态。取体积V(mL)的PEG-CS纳米混悬液,根据投入量计算其中伏立康唑浓度CT;4 ℃下15 000 r/min离心45 min后收集上清液,用紫外分光光度计测定其中伏立康唑的浓度CF;余下沉淀冻干成粉,并称定其重量WNP。按以下公式计算PEG-CS纳米粒的包封率和载药量:包封率(%)=(1-CF/CT)×100%;载药量(%)=[(CT-CF)×V/WNP]×100%。
1.3 PEG-CS纳米粒的体外释药将10 mg冻干载药PEG-CS纳米粒溶于10 mL磷酸盐缓冲液(PBS)中,然后将其引入到15 mL透析管(截留相对分子量5 000)。再将透析管置于一含95 mL PBS液的200 mL玻璃瓶中,将瓶置于摇床上在37 ℃下振荡。在不同时间间隔,将瓶中样品取出0.5 mL稀释,使用紫外分光光度计测定伏立康唑的释放浓度。将浓度为1.5 mg/mL的伏立康唑溶液10 mL也置入透析管中作为对照。
1.4 眼表药物代谢动力学用微量移液管取1.2.1中制备的负载伏立康唑的PEG-CS纳米粒混悬液(伏立康唑浓度为1.5 mg/mL)和1.5mg/mL的伏立康唑溶液(对照)各20 μL,分别滴入新西兰大白兔右眼下结膜囊内(不触碰到结膜和角膜),分别在5、15、30、45、60、90、120、150、180、210、240 min后,用微毛细管取泪液样本10 μL。高效液相色谱检测泪液中伏立康唑浓度:将微毛细管排空,样品稀释,10 000×g下离心10 min后,将上清液在氮气流下蒸发。将残余物用100 μL微升流动相复溶,色谱柱:Diamonsil C18柱(200 mm×4.6 mm,5 μm);流动相:0.01 mol/L醋酸铵(加冰醋酸、三乙胺各10 μL)-乙腈=50 :50;流速:1 mL/min;柱温:40 ℃;检测波长:255 nm。伏立康唑的线性范围为0.1~200 μg/mL,定量下线为0.1 μg/mL。取PBS液,配制伏立康唑低、中、高3个浓度(0.15、55和100 μg/mL)的质量控制样品,高、中、低质量浓度的日内精密度(1 d不同时间段连续测定3次)RSD分别为3.19%、3.25%、3.49%。日间精密度(每天测定1次,连续测定3 d)RSD分别为4.37%、4.29%、4.51%。高、中、低质量浓度质控样品的准确度分别为(99.30±0.54)%、(100.64±1.01)%、(98.50±0.84)%。
1.5 角膜渗透实验用荧光素钠(FITC)标记PEG-CS纳米粒,标记过程同2.1中载药PEG-CS纳米粒制备过程,将伏立康唑替换为荧光素钠。将荧光素钠直接溶解于磷酸缓冲液中,配成0.03%的浓度(W/W)作为对照。将荧光素钠标记PEG-CS纳米混悬液和0.03%荧光素钠溶液15 μL分别滴入新西兰大白兔右眼和左眼结膜囊内,5 min/次,连续4次,分别在0.5、1和3 h后,用磷酸盐缓冲盐水冲洗结膜囊,将角膜取下后包埋、切片,倒置荧光显微镜下观察。
1.6 统计学分析利用WinNonlin 5.1软件对眼表药物浓度-时间曲线进行分析,得出代谢动力学参数。所有数据采用Origin 8.0软件进行统计学处理,所得的数据以x±s表示,多组均数间比较采用单因素方差分析,两两比较采用Student’s-t检验。检验水准α=0.05。
2 结果 2.1 PEG-CS纳米粒的表征制备的PEG-CS纳米粒粒径为(235±23) nm,Zeta电位为(+23.1±0.6) mV,载药量为11.16%,包封率为61.35%。透射电镜下,PEG-CS纳米粒呈圆形,表面较光滑,分散均匀,颗粒间无明显粘连,图中标记的纳米粒粒径约243 nm,比激光粒度分析仪Zetasizer检测略大(图 1)。

|
| 图 1 聚乙二醇化壳聚糖纳米粒(PEG-CS NPs)的透射电镜观察 |
2.2 体外释药
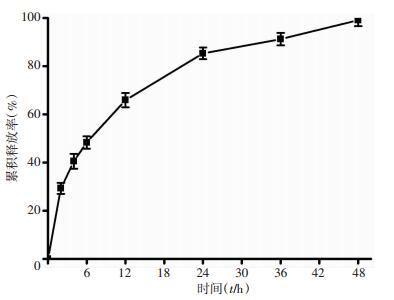
在体外条件下,PEG-CS纳米粒释放药物比较缓慢,总释药时长达48 h,早期存在明显的突释现象,6 h累计释放率为(48.3±2.6)%,以后释药逐渐缓慢,36 h累计释放率为(91.2±2.6)%,此后释药趋于平衡,48 h接近释完(图 2)。
|
| 图 2 聚乙二醇化壳聚糖纳米粒(PEG-CS NPs)释放伏立康唑累积曲线(n=5) |
2.3 眼表代谢动力学
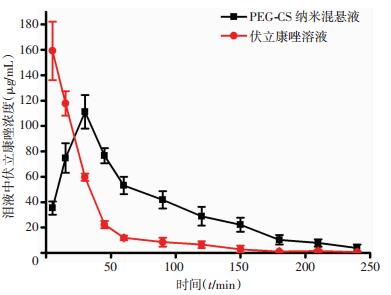
表 1显示的是伏立康唑PEG-CS纳米混悬液和伏立康唑水溶液两种制剂在兔眼中的眼表药物代谢动力学参数。两种制剂在滴眼后,相比于水溶液制剂,PEG-CS纳米混悬液制剂的药物浓度-时间曲线下面积(AUC)明显增加(图 3),约是水溶液AUC的1.9倍;药物的半衰期(t1/2)也明显延长,约是水溶液的1.4倍;药物峰浓度(Cmax)有所减小,表明PEG-CS纳米混悬液释放药物更为平稳;药物的清除率(Cl)减少,而平均滞留时间(MRT)显著延长,约延长了3倍。
| 药物剂型 | AUC(min·μg/mL) | t1/2 (min) | Cmax (μg/mL) | Cl(mL/min) | MRT(min) |
| 载伏立康唑PEG-CS NPs | 8 513.1±1 011.6a | 42.7±5.6a | 111.1±13.2a | 0.004±0.001a | 87.3±5.3a |
| 伏立康唑溶液 | 4 396.1±571.6 | 31.0±3.5 | 159.2±23.0 | 0.007 4±0.002 0 | 27.0±2.2 |
| a:P<0.05,与伏立康唑溶液比较 | |||||
|
| 图 3 伏立康唑PEG-CS纳米混悬液和水溶液(1.5 mg/mL)在兔眼泪液中的药物浓度-时间曲线(n=3) |
2.4 角膜渗透实验
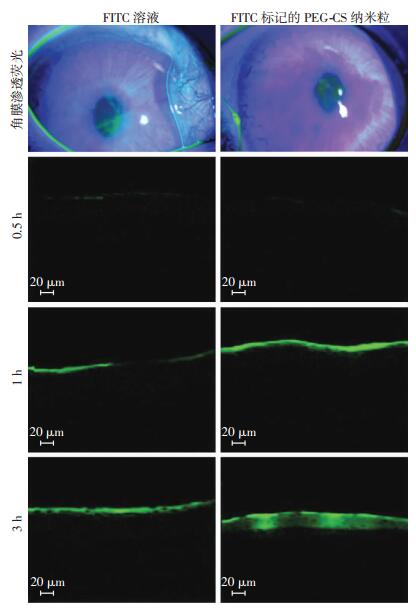
FITC溶液和FITC标记的PEG-CS纳米粒分别滴入兔眼结膜囊内,滴眼0.5 h后,在兔眼角膜切片上都可观察到两者显色,主要聚集在角膜上皮组织中。随着时间的推移,PEG-CS纳米粒则逐渐向角膜深层组织渗透,3 h后可到达接近内皮细胞的深度。而FITC溶液只能渗透至角膜浅层(图 4)。
|
| 图 4 FITC溶液和FITC标记的纳米混悬液兔眼角膜渗透荧光观察 |
3 讨论
眼部特殊的解剖生理结构和药物代谢动力学使眼部给药成为一个挑战。眼局部给药常用的剂型是滴眼剂。滴眼剂使用方便,感觉舒适,易于被患者接受,但药物在角膜前停留时间短(1~3 min),药物利用率低,需频繁给药,一些药物被泪道黏膜吸收后可引起全身副作用[9-10]。此外,结构致密的角膜上皮细胞构成的天然生理屏障限制了眼部药物的吸收,使药物难以到达眼组织特定部位发挥治疗作用[11]。因此,研发眼用药物新剂型,克服上述障碍对眼病的治疗具有重要意义。
本研究用聚乙二醇修饰壳聚糖,成功制备成纳米粒负载模型药物伏立康唑,改善了壳聚糖的水溶性。聚乙二醇具有高度的亲水性,在水溶液中,其分子表面的醚键带有微弱的负电荷,并无免疫原性,因此常被用来对医用高分子物质表面改性。当偶联到其他高分子材料表面时,可以将其优良性质赋予修饰后的大分子,改变它们在体内的生物相容性和溶解性[12]。进一步评价PEG-CS纳米粒眼部给药性能发现:① PEG-CS纳米粒能够缓慢释放药物。对于眼部疾病的治疗,缓释制剂可以降低滴眼的频率,减少药物被泪道黏膜吸收后可引起全身副作用,提高患者的依从性。而在纳米系统中药物缓释包括从载体松解和向介质扩散两个过程,这使药物的释放时间较水溶液显著延长[13]。② PEG-CS纳米粒能够提高药物在眼表的滞留时间。由于泪液循环,传统滴眼液的眼表滞留时间短,导致药物生物利用度低。研究表明,聚乙二醇和壳聚糖均具有生物粘附性[14-15],对人体黏膜组织有天然的亲和力。此外,泪液的黏蛋白层中糖基侧链中含有大量COO-和SO3-,使角膜上皮细胞表面附带负电荷[14],而PEG-CS纳米粒的表面电位为+23.1 mV。因此,静电作用在提高PEG-CS纳米粒眼表滞留时间中也起着重要作用。研究中PEG-CS纳米粒使伏立康唑的AUC、t1/2及MRT都显著增加,而Cmax和Cl显著减少,表明药物能够在眼表持续平稳的释放,减少泪液循环带来的药物流失。③ PEG-CS纳米粒能够渗透入角膜组织。角膜上皮富含脂质,细胞间形成有紧密连接,是抵御外来物质侵入角膜的重要屏障,但同时也限制了大分子药物进入角膜基质中,到达前房内药物则更少。实验中观察到PEG-CS纳米粒可穿透角膜上皮进入基质,但PEG-CS纳米粒是如何穿透角膜上皮的具体机制本研究未探讨。但据以往的报道,纳米粒子与上皮细胞相互作用穿透上皮屏障的机制主要涉及细胞内吞介导的跨上皮途径和紧密连接介导的细胞旁通路两种方式[16]。而在对阳离子纳米粒的研究中发现,其表面的正电可破坏上皮间的紧密连接,导致紧密连接相关蛋白ZO、Claudin和Occludin的破坏[17]。PEG-CS纳米粒表面也带正电,因此我们猜测其可能是破坏了上皮间的紧密连接,通过细胞旁通路进入角膜基质。鉴于药物载体的组成成分、理化性质、表面功能基团及上皮类型等不同可导致两者相互作用方式不同,我们将在后续的研究探讨PEG-CS纳米粒穿透角膜上皮的具体机制。
| [1] | URTTI A. Challenges and obstacles of ocular pharmacokinetics and drug delivery[J]. Adv Drug Deliv Rev, 2006, 58(11): 1131–1135. DOI:10.1016/j.addr.2006.07.027 |
| [2] | SHARMA K, SOMAVARAPU S, COLOMBANI A, et al. Crosslinked chitosan nanoparticle formulations for delivery from pressurized metered dose inhalers[J]. EurJPharm Biopharm, 2012, 81(1): 74–81. DOI:10.1016/j.ejpb.2011.12.014 |
| [3] | CHEN M C, MI F L, LIAO Z X, et al. Recent advances in chitosan-based nanoparticles for oral delivery of macromolecules[J]. Adv Drug Deliv Rev, 2013, 65(6): 865–879. DOI:10.1016/j.addr.2012.10.010 |
| [4] | RAGELLE H, RIVA R, VANDERMEULEN G, et al. Chitosan nanoparticles for siRNA delivery: optimizing formulation to increase stability and efficiency[J]. JControl Release, 2014, 176: 54–63. DOI:10.1016/j.jconrel.2013.12.026 |
| [5] | SCHELLEKENS H, HENNINK W E, BRINKS V. The immunogenicity of polyethylene glycol: facts and fiction[J]. Pharm Res, 2013, 30(7): 1729–1734. DOI:10.1007/s11095-013-1067-7 |
| [6] | D'SOUZA A A, SHEGOKAR R. Polyethylene glycol (PEG): a versatile polymer for pharmaceutical applications[J]. Expert Opin Drug Deliv, 2016, 13(9): 1257–1275. DOI:10.1080/17425247.2016.1182485 |
| [7] |
乔从德. 聚乙二醇基智能水凝胶的研究进展[J].
高分子通报, 2010(3): 23–30.
QIAO C D. Progress of PEG-based hydrogel[J]. Chin Polymer Bull, 2010(3): 23–30. DOI:10.14028/j.cnki.1003-3726.2010.03.001 |
| [8] |
赵媛. 加替沙星壳聚糖纳米粒子的制备、体外性质研究及眼表毒性实验[D]. 重庆: 重庆医科大学, 2010.
ZHAO Y. Chitosan nanoparticles asapotential vehicle for gatifloxacein in ocular delivery: preparation, characterIzateon and toxicity concerns in vivo[D]. Chongqing:Chongqing Medical University, 2010. |
| [9] | SAHOO S K, DILNAWAZ F, KRISHNAKUMAR S. Nanotechnology in ocular drug delivery[J]. Drug Discov Today, 2008, 13(3/4): 144–151. DOI:10.1016/j.drudis.2007.10.021 |
| [10] | ELJARRAT-BINSTOCK E, PE'ER J, DOMB A J. New techniques for drug delivery to the posterior eye segment[J]. Pharm Res, 2010, 27(4): 530–543. DOI:10.1007/s11095-009-0042-9. |
| [11] | GAUDANA R, JWALA J, BODDUSH S, et al. Recent perspectives in ocular drug delivery[J]. Pharm Res, 2009, 26(5): 1197–1216. DOI:10.1007/s11095-008-9694-0 |
| [12] | MATHIYALAGAN R, SUBRAMANIYAM S, KIM Y J, et al. Synthesis and pharmacokinetic characterization ofapH-sensitive polyethylene glycol ginsenoside CK (PEG-CK) conjugate[J]. Biochemistry & Molecular Biology(Notes), 2014, 78(3): 466–468. DOI:10.1080/09168451.2014.885827 |
| [13] | ZHOU S, DENG X, LI X. Investigation onanovel core-coated microspheres protein delivery system[J]. JControl Release, 2001, 75(1/2): 27–36. DOI:10.1016/S0168-3659(01)00379-0 |
| [14] | WADHWA S, PALIWAL R, PALIWAL S R, et al. Hyaluronic acid modified chitosan nanoparticles for effective management of glaucoma: development, characterization, and evaluation[J]. JDrug Target, 2010, 18(4): 292–302. DOI:10.3109/10611860903450023 |
| [15] | SARGEANT T D, DESAI A P, BANERJEE S, et al. An in situ forming collagen-PEG hydrogel for tissue regeneration[J]. Acta Biomater, 2012, 8(1): 124–132. DOI:10.1016/j.actbio.2011.07.028 |
| [16] | AGARWAL R, IEZHITSA I, AGARWAL P, et al. Liposomes in topical ophthalmic drug delivery: an update[J]. Drug Deliv, 2016, 23(4): 1075–1091. DOI:10.3109/10717544.2014.943336 |
| [17] | SOUZA J G, DIAS K, SILVA S A, et al. Transcorneal iontophoresis of dendrimers: PAMAM corneal penetration and dexamethasone delivery[J]. JControl Release, 2015, 200: 115–124. DOI:10.1016/j.jconrel.2014.12.037 |



