2. 400016 重庆,重庆医科大学附属第一医院重庆分子肿瘤及表观遗传学重庆市重点实验室;
3. 400016 重庆,重庆医科大学附属第一医院放射医学与肿瘤研究室
2. Chongqing Key Laboratory of Molecular Oncology and Epigenetics, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China;
3. Department of Radiation Medicine and Oncology, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
喉癌(laryngeal carcinoma)是头颈部常见的恶性肿瘤,占全身所有肿瘤的3%~5%,其治疗方式主要有手术治疗、放疗和化疗[1]。近年来,提高喉癌患者生活质量越来越受到关注,保留喉的结构和功能是一个必要条件。因为放疗不会破坏正常的组织结构,所以在喉癌治疗中占有重要地位[2]。然而,放疗在治疗剂量内仍然会产生正常组织的放射损伤和肿瘤放射抵抗的情况,因此提高放疗敏感性是其关键环节[3]。目前研究表明,缺氧诱导因子1α(hypoxia-inducible factor 1 alpha, HIF1α)在多种肿瘤组织中高表达,调控不同信号通路,抑制肿瘤细胞凋亡,与肿瘤的生长转移及放疗不敏感密切相关[4-5]。本研究利用噬菌体肽库技术,构建天然单链抗体库,并利用喉癌HEP2细胞和HIF1α纯化抗原对其进行联合筛选,成功获得具有喉癌靶向的抗HIF1α特异性单链抗体(single-chain variable fragment, scFv),初步证实其增加HEP2细胞对放疗的敏感性,旨在为实现喉癌靶向治疗和放疗增敏作用奠定基础。
1 材料与方法 1.1 材料 1.1.1 组织标本8例喉癌患者癌旁淋巴结组织来源于重庆医科大学附属第一医院耳鼻喉科科2015年3-7月的手术患者,患者均知情同意,病理报告证实为癌转移阳性淋巴结。
1.1.2 主要材料与试剂TRIzol试剂购自Invitrogen公司;反转录试剂盒购自Promega公司;PCR相关试剂、限制性内切酶NotⅠ和SfiⅠ购自TaKaRa公司;噬菌体展示系统(辅助噬菌体M13KO7、载体pCANTAB 5E、E.coli TG1、E.coli HB2151) 为本实验室保存;质粒小提试剂盒、DNA琼脂糖凝胶回收试剂盒购自天根公司;HRP标记的鼠抗M13单抗、兔抗E-tag多抗和鼠抗HIF1α单抗购自Abcam公司;HRP标记的羊抗兔二抗购自CST公司;HRP标记的羊抗鼠二抗购自Abgent公司;HIF1α纯化抗原购自Abnova公司;胰蛋白酶、胎牛血清、DMEM培养基购自Gibco公司;人喉癌细胞HEP2、鼻咽癌细胞系CNE1和人结肠癌细胞SW480均由本实验室保存。引物包括6条重链(VH)、5条Vκ和6条Vλ上下游序列,1条可重叠的互补Linker序列和相应的合成scFv的上下游序列,所有PCR和重叠延伸PCR(splicing over-lapping extend PCR,SOE-PCR)引物为本实验室保存。
1.2 方法 1.2.1 VH和轻链(VL)基因的扩增及scFv基因的合成TRIzol提取淋巴结总RNA,2%琼脂糖凝胶电泳鉴定其完整性。RNA反转录合成cDNA,PCR扩增VH和VL基因片段,以VH和VL基因片段扩增,分别在其上下游连接Linker序列。PCR条件:95 ℃ 5 min;94 ℃ 35 s,55 ℃ 35 s,72 ℃ 50 s,32个循环;72 ℃ 5 min。产物经2%琼脂糖凝胶电泳鉴定和胶回收试剂盒回收基因片段。VH-Linker和VL-Linker片段经SOE-PCR拼接成scFv片段。反应条件:95 ℃ 5 min;94 ℃ 50 s,57 ℃ 50 s,72 ℃ 65 s,5个循环;补加合成scFv的上下游引物各1 μL继续PCR反应,反应条件:95 ℃ 5 min;94 ℃ 40 s,55 ℃ 40 s,72 ℃ 60 s,28个循环;72 ℃ 10 min。2%琼脂糖凝胶电泳检测并回收scFv片段。
1.2.2 scFv噬菌体初级抗体库的制备scFv片段经SfiⅠ和NotⅠ双酶切后与pCANTAB 5E载体连接,电转化至感受态E.coli TG1,铺SOBAG平板后孵育过夜,次日随机挑单克隆摇菌过夜。取5 mL菌液提取质粒,进行质粒PCR鉴定,鉴定阳性的克隆送测序检测。阳性克隆的菌液涂SOBAG平板孵育过夜,次日用2YT培养基洗下菌苔后加入M13KO7振摇2 h,离心,2YTAK(含100 μg/mL氨苄青霉素和50 μg/mL卡那霉素)培养基重悬,振摇12 h,离心,加入上清体积1/5的PEG/NaCl溶液,冰置50 min,离心,沉淀重悬于2YT液,再次离心后取上清,即为scFv噬菌体初级抗体库,0.25 μm滤器过滤,4 ℃保存。
1.2.3 噬菌体scFv的生物淘选以喉癌HEP2细胞进行3轮细胞淘选,然后用HIF1α抗原进行3轮抗原淘选[6-7]。用1%BSA溶液重悬HEP2细胞,冰置40 min,离心,加入初级抗体库液孵育1.5 h,离心,PBS洗涤细胞沉淀,加入1 mL洗脱液(0.1 mol/L Tris-HCl,pH=2.2),冰浴5 min,加入60 μL中和液(2 mol/L Tris-HCl,pH=7.4),离心后取上清,加入新鲜培养的TG1菌液振摇2 h,加入M13KO7、氨苄青霉素、葡萄糖溶液,振摇2 h,离心,加入2YTAK液继续振摇16 h,加入PEG/NaCl溶液,冰置50 min,离心,重悬于2YT液,再次离心后取上清,用于下一轮富集,共进行3轮细胞淘选,估算每轮筛选后的抗体滴度。HIF1α抗原(3 μg/mL)包被免疫管,4 ℃过夜,加入2% BSA溶液封闭1.5 h,加入淘选后的抗体库液,后续步骤同细胞淘选一致。
1.2.4 噬菌体ELISA及噬菌体单链抗体的可溶性表达将上述最后1轮筛选涂的SOBAG平板随机挑取单菌落,加入2YTAK液振摇过夜,次日加入M13KO7振摇2 h,离心,加入2YTAK液振摇过夜,离心,上清为单克隆的噬菌体抗体scFv。96孔板加入HIF1α抗原(2 μg/mL,100 μL/孔)包被,经过洗涤和封闭,加入制备的scFv噬菌体抗体100 μL/孔,以PBS液为对照组,行噬菌体ELISA检测,加入HRP标记的抗M13单抗,TMB避光反应30 min,酶标仪测定波长450 nm处光密度值[D(450)],以scFv组/PBS组>4为阳性。将强阳性噬菌体抗体感染新鲜培养的E.coli HB2151菌液,稀释后涂SOBAG平板,次日挑单克隆于2YT液过夜培养,加入IPTG(1 mmol/L)诱导可溶性表达,离心,沉淀重悬于Hepes缓冲液,超声碎菌后离心取上清,即制备得到可溶性scFv,0.25 μm滤器过滤,保存于-80 ℃备用。
1.2.5 可溶性scFv的鉴定细胞免疫化学法(ICC)检测抗体的特异性,将喉癌HEP2细胞、鼻咽癌CNE1细胞和人结肠癌细胞SW480分别接种于96孔板,经过固定封闭后,加入scFv(150 μg/mL,100 μL/孔) 4 ℃孵育过夜,次日分别加入兔抗E-tag一抗和HRP标记的兔二抗,DAB和苏木精染色后,显微镜观察拍照。可溶性scFv经SDS-PAGE电泳后,将凝胶用考马斯亮蓝染色2 h,脱色后拍照,同时用兔抗E-tag为一抗鉴定相对分子质量。将HEP2细胞接种于培养皿中,待细胞贴壁后,实验组加入scFv(50 μg/mL和150 μg/mL)处理24 h后,给予4 Gy的X线照射,24 h后提取细胞总蛋白,Western blot检测其HIF1α蛋白的表达情况。
1.2.6 scFv对HEP2细胞放疗增敏作用CCK-8实验检测细胞的存活率,将HEP2细胞均匀接种于96孔板(10 000/孔),贴壁后scFv处理组加入scFv(150 μg/mL,100 μL/孔)孵育24 h,未加scFv为单纯照射组,经过0、4、8、12 Gy的X线照射后,继续培养12 h后加入CCK-8试剂,酶标仪测定D(450)。克隆形成实验分析细胞的存活分数,将HEP2细胞均匀接种于孔板(1 000/孔),贴壁后实验组加入scFv(150 μg/mL),未加scFv为单纯照射组,然后给予0、2、4、8 Gy的X线照射,细胞培养2周后,用4%多聚甲醛固定和结晶紫染色并计数克隆数,细胞克隆形成率(plating efficiency, PE)=(细胞克隆数/接种细胞数)×100%,细胞存活分数(surviving fraction, SF)=PE(受照射细胞)/PE(对照细胞),利用Graph Pad 5软件,以单击多靶模型SF=1-(1-e-kD)N拟合放疗存活曲线,k=1/D0;lnN=Dq /D0,增敏比=D0(单纯照射组)/D0(scFv处理组)。
1.3 统计学方法数据以x±s表示,采用SPSS 19.0统计软件进行两独立样本t检验,计数资料用χ2检验。检验水准:α=0.05。
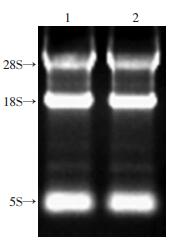
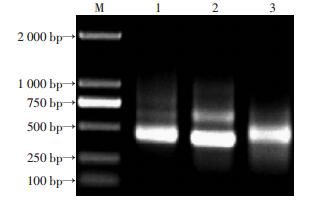
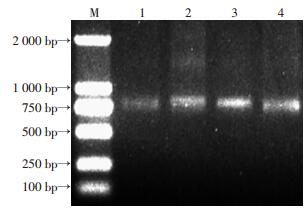
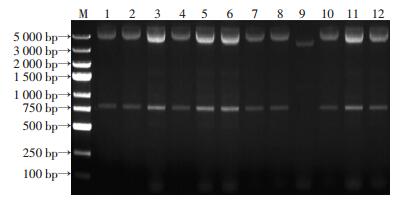
2 结果 2.1 scFv基因组装合成和重组质粒的鉴定TRIzol提取组织总RNA,凝胶电泳可见完整28S、18S、5S 3根条带,D(260)/D(280) 比值为1.8,说明RNA无降解且纯度较高(图 1)。VH、VL扩增产物经凝胶电泳分析在360、340 bp处有特异性条带(图 2),SOE-PCR组装拼接产物scFv经电泳鉴定其大小为750 bp(图 3)。随机挑选12个克隆质粒行PCR鉴定,其中11个质粒扩增出大小750 bp的片段,插入率达91.7%(图 4)。质粒的测序报告显示,阳性质粒比对结果与整码的scFv编码序列的一致率达99%。
|
| 1、2:分别为2例喉癌患者 图 1 喉癌患者癌旁淋巴结组织RNA电泳 |
|
| M:标准;1:VH(360 bp);2:Vκ (340 bp);3:Vλ(340 bp) 图 2 PCR扩增VH和Vκ、Vλ基因的凝胶电泳分析 |
|
| M:标准;1~4:scFv基因片段(750 bp) 图 3 PCR扩增scFv基因的凝胶电泳分析 |
|
| M:DNA标准;1~12:随机挑选初级抗体库12个克隆 图 4 随机挑选质粒PCR鉴定 |
2.2 噬菌体scFv的淘选和噬菌体ELISA
经过3轮细胞淘选和3轮HIF1α抗原筛选,抗体的收获率逐轮提高,第6轮是第1轮的115倍,说明人源喉癌相关抗HIF1α抗体库得到了有效富集。噬菌体ELISA检测随机挑选的14个噬菌体抗体,有11个与HIF1α抗原呈阳性反应,阳性展示率达79%。
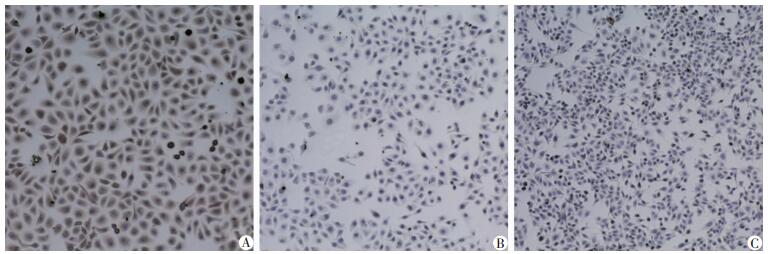
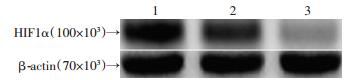
2.3 可溶性scFv的表达及鉴定scFv结合HEP2细胞、CNE1细胞和SW480细胞的免疫细胞化学检测结果显示,制备的scFv与HEP2细胞特异性结合(图 5)。可溶性scFv经SDS-PAGE电泳和Western blot结果显示蛋白相对分子质量约为34×103(图 6)。scFv处理HEP2细胞24 h后,经X线照射,HIF1α蛋白表达降低(图 7)。
|
| A:HEP2细胞;B:CNE1细胞;C:SW480细胞 图 5 细胞免疫化学检测单链抗体scFv的特异性(ICC ×100) |

|
| A: SDS-PAGE电泳M:蛋白标准,1:可溶性scFv;B: Western blot检测scFv的表达 图 6 scFv可溶性表达和Western blot检测其相对分子质量 |
|
| 1:空白对照组;2:50 μg/mL scFv处理组;3:150 μg/mL scFv处理组 图 7 不同浓度scFv处理HEP2细胞对HIF1α蛋白表达的影响 |
2.4 scFv对HEP2细胞的放疗增敏作用
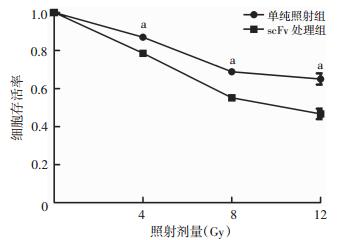
CCK-8结果显示,scFv处理组的细胞相对存活率明显低于单纯照射组(P < 0.05,图 8)。克隆形成实验结果显示,经过0、2、4 Gy和8 Gy的X线照射后,scFv处理组细胞克隆形成率分别为(28.07±0.91)%、(23.37±0.31)%、(17.27±0.61)%、(6.33±0.21)%,单纯照射组细胞克隆形成率分别为(34.77±1.44)%、(30.87±1.20)%、(24.67±0.55)%、(16.13±0.40)%。同时,通过计算得出2组的细胞存活分数,scFv处理组细胞存活分数较单纯照射组相比明显降低(P < 0.05)。利用单击多靶模型拟合细胞生存率曲线,scFv处理组的效应曲线参数N、D0、Dq分别为2.15、3.75、2.87,单纯照射组的效应曲线参数N、D0、Dq分别为1.72、7.08、3.83,增敏比为1.89。
|
| a: P < 0.05,与scFv处理组比较 图 8 CCK-8检测单纯照射组和scFv处理组的细胞存活率 |
3 讨论
喉癌是头颈部常见的恶性肿瘤,其治疗方式已从单一的手术治疗,发展为手术治疗与放化疗相结合的多种治疗模式。其治疗原则应在保证患者疗效的前提下,尽可能保留喉功能从而提高患者的生活质量。放疗的优势在于不破坏正常的组织结构而对肿瘤细胞产生杀伤效应,然而放疗在治疗剂量内仍然会导致正常组织放射损伤和发生肿瘤放射抵抗。目前研究表明HIF1α在多种肿瘤组织中表达升高,调控肿瘤的侵袭转移[1, 8]。HIF1α可诱导p21和p27表达增高,从而抑制细胞周期的G1/S期转换,使细胞停滞在对放疗不敏感的G1期,产生放疗抵抗[9-10]。同时,有研究证实放疗可以提高肿瘤细胞HIF1α的表达水平,加重放疗抵抗[11]。由此可见,HIF1α可能为影响肿瘤放疗敏感性的潜力靶点[12-13]。目前针对HIF1α的一些基因治疗技术在导入基因的安全性方面存在风险,以及如何保持基因稳定高效表达存在一定不足,制约了其发展和推广[14]。而scFv具有相对分子质量小、特异性强、人源性的特点和良好的药代动力学特征,是极佳的肿瘤治疗手段[15]。本研究利用噬菌体肽库技术,制备人源喉癌相关抗HIF1α单链抗体,为肿瘤的靶向治疗和提高放疗敏感性提供新的思路。
本研究基于前期课题组的研究成果[6-7],从喉癌癌旁淋巴结组织提取总RNA作为抗体库来源,制备得到人源化的抗体,克服了异源抗体的弊端,减少异源抗体对人类机体造成的免疫副反应。通过RT-PCR扩增VH和VL可变区基因,经SOE-PCR拼接扩增目的scFv片段与载体pCANTAB 5E重组后,电转化至大肠杆菌表达,构建初级抗体库。克隆质粒PCR鉴定结果显示基因插入率为91.7%,阳性质粒测序报告比对结果与整码的scFv编码序列的一致率达99%,说明成功构建了抗体库以及保证了抗体库库容较大。随后本研究利用HEP2细胞和HIF1α对初级抗体库一共进行6轮筛选,抗体的收获率逐轮提高,第6轮是第1轮的115倍,说明本方法极大地提高了富集效率。这是获得高亲和力的抗体关键环节之一。我们将强阳性的噬菌体抗体感染大肠杆菌并诱导可溶性scFv的表达,SDS-PAGE证实其相对分子质量约为34×103。通过ELISA和细胞免疫化学检测表明,筛选得到的抗体与HIF1α抗原和HEP2细胞特异性结合,具有免疫活性。
基于scFv人源化和相对分子质量小的特点,本研究将制备得到的scFv直接作用于HEP2人喉癌细胞,经X线照射后,发现制备的scFv可以降低HEP2细胞中HIF1α的表达。这一现象与本课题组前期实验研究中发现scFv-ABCG2能明显抑制ABCG2的表达相似[15],同时许多研究只是发现scFv能明显抑制靶蛋白的功能[16-18],但未对scFv如何影响靶蛋白功能或表达进行阐述。HAN等[19]研究发现,scFv与靶蛋白结合后,会导致结合后的蛋白向溶酶体转移,可能促进了靶蛋白的降解,从而在蛋白层面抑制了蛋白的表达。至于在本研究中是否存在此途径或者其他的途径抑制蛋白表达,还需进一步探讨。在克隆形成实验中,scFv处理组克隆形成率比单纯照射组细胞克隆形成率明显降低,scFv处理组的细胞存活分数较单纯照射组相比均降低,通过单机多靶模型拟合存活曲线发现,scFv处理组的剂量效应曲线的参数D0及Dq值均低于单纯照射组,增敏比为1.89>1,说明制备得到的scFv有放疗增敏作用。然而,我们在前期的体外实验中发现抗体浓度不够,在后续实验中我们将研究优化筛选策略,提高蛋白表达浓度,进一步通过动物实验论证其放疗增敏的作用,探讨其放疗增敏的具体机制,为临床研究scFv靶向治疗提供支持。
| [1] | SUZUKI G, YAMAZAKI H, OGO E, et al. Predisposing Factors for Larynx Preservation Strategies with Non-surgical Multimodality Treatment for Locally Advanced (T3-4) Larynx, Hypopharynx and Cervical Esophageal Disease[J]. Anticancer Res, 2014, 34(9): 5205–5210. |
| [2] | SPIELMANN P M, MAJUMDAR S, MORTON R P. Quality of life and functional outcomes in the management of early glottic carcinoma: a systematic review of studies comparing radiotherapy and transoral laser microsurgery[J]. Clin Otolaryngol, 2010, 35(5): 373–382. DOI:10.1111/j.1749-4486.2010.02191.x |
| [3] | LAI S Z, LI W F, CHEN L, et al. How does intensity-modulated radiotherapy versus conventional two-dimensional radiotherapy influence the treatment results in nasopharyngeal carcinoma patients?[J]. Int J Radiat Oncol Biol Phys, 2011, 80(3): 661–668. DOI:10.1016/j.ijrobp.2010.03.024 |
| [4] | KIM D H, GONG E J, JUNG H Y, et al. Clinical significance of intensive endoscopic screening for synchronous esophageal neoplasm in patients with head and neck squamous cell carcinoma[J]. Scand J Gastroenterol, 2014, 49(12): 1486–1492. DOI:10.3109/00365521.2013.832369 |
| [5] | SEMENZA G L. Hypoxia-inducible factors: mediators of cancer progression and targets for cancer therapy[J]. Trends Pharmacol Sci, 2012, 33(4): 207–214. DOI:10.1016/j.tips.2012.01.005 |
| [6] |
罗弋, 庞华, 李淑杰, 等. 人源抗PeroxiredoxinⅠ肺腺癌噬菌体抗体的制备及鉴定[J].
南方医科大学学报, 2010, 36(5): 841–846.
LUO Y, PANG H, LI S J, et al. Preparation and characterization of human phage display antibody against peroxiredoxin Ⅰ of lung adenocarcinoma[J]. J Southern Med Univ, 2010, 36(5): 841–846. DOI:10.13481/j.1671-587x.2010.05.050 |
| [7] | ZHAO W S, LUO Y, LI B Y, et al. Anti-ABCG2 scFv antibody of lung adenocarcinoma increases chemosensitivity and induces apoptosis through the activation of mitochondrial pathway[J]. Am J Cancer Res, 2016, 6(5): 1026–1039. |
| [8] | OVERGAARD J. Hypoxic modification of radiotherapy in squamous cell carcinoma of the head and neck--a systematic review and meta-analysis[J]. Radiother Oncol, 2011, 100(1): 22–32. DOI:10.1016/j.radonc.2011.03.004 |
| [9] | GODA N, RYAN H E, KHADIVI B, et al. Hypoxia-inducible factor 1α is essential for cell cycle arrest during hypoxia[J]. Mol Cell Biol, 2003, 23(1): 359–369. DOI:10.1128/MCB.23.1.359-369.2003 |
| [10] | HAN S X, ZHU Q, MA J L, et al. Apoptin sensitizes radiation-induced cell death via classic mitochondrial, caspase and p53-dependent signaling in HepG2 cells[J]. Mol Med Rep, 2011, 4(1): 59–63. DOI:10.3892/mmr.2010.391 |
| [11] | OU G, ITASAKA S, ZENG L, et al. Usefulness of HIF-1 imaging for determining optimal timing of combining bevacizumab and radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2009, 75(2): 463–467. DOI:10.1016/j.ijrobp.2009.02.083 |
| [12] | CHEN G, LI X, YANG J, et al. Prognostic significance of cyclooxygenase-2 expression in patients with hepatocellular carcinoma: a meta-analysis[J]. Arch Med Sci, 2016, 12(5): 1110–1117. DOI:10.5114/aoms.2016.61916 |
| [13] | DE CECCO L, BOSSI P, LOCATI L, et al. Comprehensive gene expression meta-analysis of head and neck squamous cell carcinoma microarray data defines a robust survival predictor[J]. Ann Oncol, 2014, 25(8): 1628–1635. DOI:10.1093/annonc/mdu173 |
| [14] | NELSON A L, DHIMOLEA E, REICHERT J M. Development trends for human monoclonal antibody therapeutics[J]. Nat Rev Drug Discov, 2010, 9(10): 767–774. DOI:10.1038/nrd3229 |
| [15] | FARAJNIA S, AHMADZADEH V, TANOMAND A, et al. Development trends for generation of single-chain antibody fragments[J]. Immunopharmacol Immunotoxicol, 2014, 36(5): 297–308. DOI:10.3109/08923973.2014.945126 |
| [16] | QIU Q, WANG Q, DENG C, et al. Small molecular peptide-ScFv αvβ3 conjugates specifically inhibit lung cancer cell growth in vitro and in vivo[J]. Am J Cancer Res, 2016, 6(12): 2846. |
| [17] | PAN X Y, LIU X J, LI J, et al. The ANTITUMOR efficacy of anti-p21Ras scFv mediated by the dual-promoter-regulated recombinant adenovirus KGHV300[J]. Gene Ther, 2017, 24(1): 40–48. DOI:10.1038/gt.2016.74 |
| [18] | MOHAMMADI M, NEJATOLLAHI F, GHASEMI Y, et al. Anti-Metastatic and Anti-Invasion Effects of a Specific Anti-MUC18 scFv Antibody on Breast Cancer Cells[J]. Appl Biochem Biotechnol, 2017, 181(1): 379–390. DOI:10.1007/s12010-016-2218-1 |
| [19] | HAN D, WU J, HAN Y, et al. A novel anti-PSMA human scFv has the potential to be used as a diagnostic tool in prostate cancer[J]. Oncotarget, 2016, 7(37): 59471–59481. DOI:10.18632/oncotarget.10697 |



