免疫逃逸是肿瘤转移和复发的重要机制,是医学研究的重点,也是胆管癌预后不佳的重要原因[1-2]。我们前期研究表明胆管癌细胞可诱导T细胞凋亡,从而逃逸获得性免疫杀伤,然而胆管癌天然免疫逃逸的机制尚不清楚[3]。NK细胞是天然免疫的主要反应细胞,表达自然杀伤细胞2族成员D(natural killer group 2 member D, NKG2D)与靶细胞表达的MICA/B结合而活化,从而能激活NK细胞杀伤靶细胞[4-5]。正常胃肠道上皮低表达MICA/B,在包括胰腺导管腺癌、结肠癌、乳腺癌等多种肿瘤癌变过程中,MICA/B表达增高,进而诱导NK细胞清除癌细胞,被认为是机体自我保护的措施之一[6-7]。然而,部分肿瘤细胞能通过下调MICA/B表达,从而逃逸NK细胞杀伤。本研究拟探讨胆管癌MICA/B表达量的改变对NK细胞杀伤率以及患者预后的影响。
1 材料与方法 1.1 临床样本89例于2010年1月至2014年12月经外科手术切除的胆管癌标本来源于本研究所病理标本库,病理诊断由西南医院病理科两位病理学专家独立完成。本研究方案通过第三军医大学西南医院伦理委员会审核。
1.2 免疫组织化学利用兔多克隆抗人MICA抗体(1:100, Abcam),兔多克隆抗人MICB抗体(1:100, Proteintech),EnVision Detection Systems Peroxidase/DAB试剂盒中的鼠兔通用二抗对临床胆管癌组织标本切片进行免疫组织化学染色;染色结果采用Imagepro-Plus 6.0进行评分:每张切片随机选取5个视野计算每个视野癌细胞的平均光密度,最终采用5个平均光密度的均值作为该标本的光密度值。利用X-tile3.6.1分别将MICA、MICB分为高表达组和低表达组[8]。
1.3 细胞系和细胞转染人胆管癌细胞系QBC939由本研究所王曙光教授建立[9],人胆管癌细胞系RBE购买于日本生物样本保存库(Japanese collection of research bioresources cell bank)[10]。两株细胞系均使用10%胎牛血清的1640培养基进行培养。MICA、MICB的shRNA干扰序列(shMICA:5′-GACUUGACAGGGAACGGAATT-3′, shMICB:5′-GCUCCCGGAUUUCUACUATT-3′)和过表达慢病毒(exMICA, exMICB)均由上海吉玛制药技术有限公司构建。shRNA和过表达慢病毒的细胞转染均按照操作说明进行实验。
1.4 提取细胞总RNA和实时定量PCR细胞总RNA的提取使用SV total RNA isolation system (Promega)并按照试剂盒操作说明完成。样本的逆转录按照PrimeScriptTM RT reagent Kit with gDNA Eraser (TaKaRa, China)的使用说明完成。实时定量PCR检测采用SYBR Premix Ex Taq Ⅱ Kit (TaKaRa, China)完成。各分子的引物序列:MICA正义GGGTAT-CTTTGAGCCACGACA, 反义CATGGAATGTCTGCCAA-TGACT。MICB正义GATGTGGGCAAACTCACGAC, 反义CATTCCTCAAACAATAGGCTCTAG。GAPDH正义AGAAGGCTGGGGCTCATTTG, 反义AGGGGCCATCCA-CAGTCTTC。
1.5 Western blot检测利用细胞裂解液(碧云天公司)提取细胞的总蛋白,使用BCA蛋白浓度测定试剂盒(碧云天公司)测定蛋白浓度,利用8%SDS-PAGE电泳分离总蛋白量相同的样本,并使用半干转将之转移至硝酸纤维素膜(Millipore);使用含5%脱脂奶粉的封闭液封闭抗原2 h,一抗孵育条件为兔多克隆MICA抗体(1:1 000, abcam),兔多克隆MICB抗体(1:2 500, Proteintech),兔多克隆GAPDH抗体(1:10 000, Proteintech)4 ℃过夜;二抗使用EnVision Detection Systems Peroxidase/DAB试剂盒中的鼠兔通用抗体,孵育条件为37 ℃ 1 h;采用immobilonTM western试剂(Millipore)进行底物的荧光显影;并利用可增强的化学发光系统进行信号采集。
1.6 人外周血NK细胞培养及NK细胞毒性实验利用梯度离心液(Percoll, Gibco)分离出健康自愿者外周血单核细胞(PBMCs)。利用HBSS basic(Gibco)重悬单核细胞;通过阴选的方法用NK细胞分离试剂盒(Miltenyi Biotec, Germany)纯化人外周血NK细胞;并使用NK细胞激活扩增试剂盒(Miltenyi Biotec, Germany)激活纯化的NK细胞, 以10%胎牛血清和500 U/mL rIL-2(Peprotech)的1640培养基对激活后的NK细胞进行培养,并使得细胞浓度保持1×106 /mL。经2~3周的培养,NK细胞可扩增50~70倍,利用流式细胞仪鉴定CD56+CD3-细胞达90%。
NK细胞的杀伤作用采用CytoTox 96®非放射性细胞毒性检测试剂盒(Promega)检测。将1.5×104 /孔靶细胞在37 ℃、5%CO2条件下与1.5×105/孔NK细胞共培养4 h(E:T=10:1),每组做3个复孔;取培养上清根据NK细胞毒性检测试剂盒操作说明,按公式计算NK细胞毒性。
细胞毒性= [ D(490)实验组 - D(490)效应细胞自发组 - D(490)靶细胞自发组 ] / [D(490)靶细胞最大组 - D(490)靶细胞自发组)× 100%
1.7 随访患者采用门诊和电话进行随访,随访时间截至2016年9月20日。
1.8 统计分析.应用SPSS 19.0统计软件进行分析,分类变量采用χ2检验和fisher确切概率法;利用Kaplan-Meier法分析MICA/B高表达组和低表达组的无瘤生存时间和总生存时间并绘制生存曲线,利用Cox回归模型进行影响患者生存时间的多因素分析。
2 结果 2.1 胆管癌MICA/B低表达与肿瘤侵袭转移特性显著相关我们采用免疫组化检测了89例胆管癌组织中MICA/B的表达水平,发现MICA在61.8%(55/89) 胆管癌组织中呈低表达,而57.3%(51/89) 胆管癌中MICB呈低表达(图 1)。将染色结果用Imagepro-Plus 6.0评分,利用X-tile3.6.1分析,平均光密度值IODMICA>0.15, IODMICB>0.08为高表达组。临床病理特征相关性分析表明:MICA低表达与肿瘤的分化程度(P=0.019)、胆管癌T分级(P=0.000)、淋巴结转移(P=0.028) 以及TNM分期(P=0.007) 显著相关,MICB的表达也与肿瘤的分化程度(P=0.024)、胆管癌T分级(P=0.026)、淋巴结转移(P=0.017) 以及TNM分期(P=0.008) 显著相关,而与患者的年龄(P=0.823,P=0.660)、性别(P=0.473, P=0.480)、肿瘤位置(P=1.000, P=0.633) 不相关,提示MICA/B低表达与肿瘤侵袭转移特性明显相关(表 1、2)。
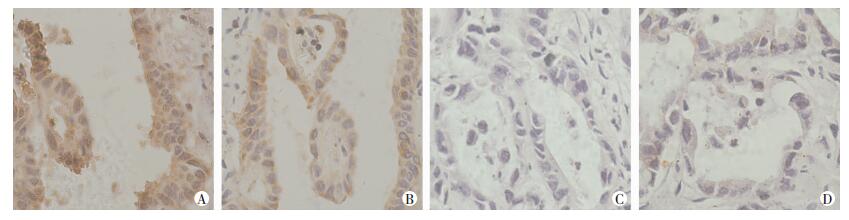
|
| A:高表达MICA;B:高表达MICB;C:低表达MICA;D低表达MICB 图 1 免疫组织化学检测胆管癌中MICA/B的表达量 (二步法×400) |
| 组别 | n | 年龄 | 男性 | 女性 | 位置 | 分化程度 | T分级a | 淋巴结转移 | TNM分期a | |||||||||||
| >60岁 | ≤60岁 | 肝内 | 肝外 | 高分化(G1) | 中分化(G2) | 低分化(G3) | T1 | T2 | T3 | T4 | Ⅰ | Ⅱ | Ⅲ | |||||||
| MICA高表达组 | 34 | 12(35.3) | 22(64.7) | 26(76.5) | 8(23.5) | 9(26.5) | 25(73.5) | 6(17.6) | 23(67.6) | 5(14.7) | 0 | 3(8.8) | 30(88.2) | 1(2.9) | 8(23.5) | 0 | 25(73.5) | 5(14.7) | ||
| MICA低表达组 | 55 | 22(40.0) | 33(60.0) | 37(67.3) | 18(32.7) | 15(27.3) | 40(72.7) | 2(3.6) | 34(61.8) | 19(34.5) | 0 | 5(9.1) | 30(54.5) | 20(36.4) | 26(47.3) | 0 | 24(43.6) | 25(45.5) | ||
| P | 0.830 | 0.473 | 1.000 | 0.019 | 0.000 | 0.028 | 0.007 | |||||||||||||
| a:按照第6版UICC-TNM进行分期 | ||||||||||||||||||||
| 组别 | n | 年龄 | 男性 | 女性 | 位置 | 分化程度 | T分级a | 淋巴结转移 | TNM分期a | |||||||||||
| >60岁 | ≤60岁 | 肝内 | 肝外 | 高分化(G1) | 中分化(G2) | 低分化(G3) | T1 | T2 | T3 | T4 | Ⅰ | Ⅱ | Ⅲ | |||||||
| MICB高表达组 | 38 | 16(42.1) | 22(57.9) | 25(65.8) | 13(34.2) | 9(23.7) | 29(76.3) | 3(7.9) | 30(78.9) | 5(13.2) | 0 | 5(13.2) | 29(76.3) | 4(10.5) | 9(23.7) | 0 | 28(73.7) | 8(21.1) | ||
| MICB低表达组 | 51 | 18(35.3) | 33(64.7) | 38(74.5) | 13(25.5) | 15(29.4) | 36(70.6) | 5(9.8) | 27(52.9) | 19(37.3) | 0 | 3(5.9) | 31(60.8) | 17(33.3) | 25(49.0) | 0 | 21(41.2) | 22(43.1) | ||
| P | 0.660 | 0.480 | 0.633 | 0.024 | 0.26 | 0.017 | 0.008 | |||||||||||||
| a:按照第6版UICC-TNM进行分期 | ||||||||||||||||||||
2.2 胆管癌MICA/B低表达与患者预后不良显著相关
利用Kaplan-Meier模型分析了MICA、MICB表达水平与预后的关系,结果表明:MICA低表达组患者的总生存时间和无瘤生存时间显著低于MICA高表达组(P=0.000 7, 0.002 6)(图 2A、B)。同时,MICB低表达组总生存时间和无瘤生存时间也显著低于MICB高表达组(P=0.000 3,0.005)(图 2C、D)。上述结果表明:MICA/B表达降低与患者预后不良显著相关。多因素分析结果表明:胆管癌的TNM分期、肿瘤的分化程度、MICA、MICB是胆管癌患者独立的生存预测因子,且MICA/B是胆管癌的保护因素(表 3)。
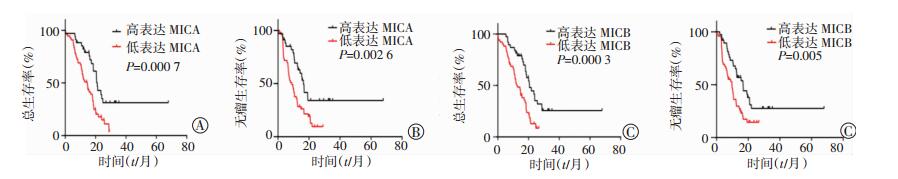
|
| A:MICA高表达组总生存率优于低表达组;B:MICA高表达组无瘤生存率优于低表达组;C:MICB高表达组总生存率优于低表达组;D:MICB高表达组无瘤生存率优于低表达组 图 2 胆管癌MICA/B低表达与患者预后不良的相关性分析结果 |
| 变量 | 总生存时间 | 无瘤生存时间 | |||||
| RR | 95%CI | P | RR | 95%CI | P | ||
| 年龄 | 1.354 | 0.771~2.377 | 0.330 | 1.354 | 0.777~2.361 | 0.353 | |
| 性别 | 0.745 | 0.437~1.270 | 0.347 | 0.526 | 0.489~1.442 | 0.558 | |
| 位置 | 0.928 | 0.460~1.872 | 0.863 | 1.135 | 0.558~2.309 | 0.736 | |
| 组织学分级 | 2.002 | 1.269~3.158 | 0.003 | 1.808 | 1.148~2.847 | 0.011 | |
| TNM分期 | 1.455 | 1.009~2.097 | 0.045 | 1.453 | 1.008~2.096 | 0.045 | |
| MICA | 0.522 | 0.300~0.907 | 0.021 | 0.556 | 0.324~0.953 | 0.033 | |
| MICB | 0.561 | 0.315~0.999 | 0.049 | 0.561 | 0.323~0.975 | 0.040 | |
2.3 胆管癌细胞下调MICA/B显著抑制NK细胞的杀伤作用
临床数据表明MICA/B表达降低与胆管癌的侵袭转移特性及预后不良显著相关。我们进一步体外胆管癌细胞与NK细胞共培养,研究MICA/B表达改变对癌细胞逃逸NK细胞杀伤的影响。体外培养的胆管癌细胞中,MICA、MICB在QBC939中的表达量显著低于RBE(图 3A);与NK细胞共培养,发现NK细胞对RBE的杀伤率(27.76±1.50)%高于QBC939(12.44±0.89)%。因此我们在RBE细胞中干扰MICA、MICB(图 3B),而在QBC939中过表达MICA、MICB(图 3C)。然后将癌细胞与NK细胞共培养,对比NK细胞对癌细胞的杀伤作用,结果表明:NK细胞对干扰MICA(11.24±2.22)%、MICB(20.69±2.50)%的杀伤率显著低于对照组RBE细胞(27.76±2.60)%,而对过表达MICA(36.49±2.90)%、MICB(22.89±2.52)%的杀伤率显著高于对照组QBC939细胞(12.98±3.50)%。表明:胆管癌细胞通过下调MICA/B的表达逃逸NK细胞的杀伤。

|
| A: RBE与QBC939中MICA/B的表达 1: RBE;2: QBC939; B: RBE细胞 1: sh-CONTROL;2: sh-MICA/B; C: QBC939细胞 1: ex-MICA/B; 2: ex-CONTROL 图 3 Western blot检测胆管癌细胞下调MICA/B显著抑制NK细胞的杀伤作用 |
3 讨论
胆管癌逃逸免疫系统的监控,是导致远处转移的重要机制,包括特异性免疫逃逸和天然免疫逃逸。我们前期的研究表明胆管癌细胞可诱导T细胞凋亡,获得特异性免疫逃逸。本研究结果表明胆管癌细胞通过下调MICA/B进行天然免疫逃逸。
NK细胞作为天然免疫的主要效应细胞,已有文献报道浸润癌组织中NK细胞数量的多少与患者的临床预后显著相关[11]。然而NK细胞的活化受其表达的活化性和抑制性受体综合调控。异二聚体NKGA/CD94、白细胞免疫球蛋白样受体(leukocyte Ig-like receptor, LIR)和杀伤细胞免疫球蛋白样受体(kill-cell immunoglobulin-like receptor,KIR)是NK细胞主要的抑制性受体,与自身MHC-Ⅰ类分子结合可抑制NK细胞的杀伤作用,使正常细胞不受攻击[12]。NKG2D是NK细胞杀伤靶细胞重要的激活受体,与MICA/B结合后可发挥细胞毒性作用[13]。MICA、MICB是功能相似的跨膜糖蛋白,均可作为NKG2D的配体而发挥功能,结构上与经典的MHC-Ⅰ类分子类似,它们低表达于正常组织,在胆管癌癌旁胆管中也呈低表达。而在癌变过程中,MICA/B逐渐被表达,本研究中MICA在38.2%(34/89) 胆管癌患者中高表达, MICB在42.7%(38/89) 胆管癌患者中高表达,为NK细胞清除癌细胞提供靶点,这是机体自我保护的一种机制。
然而在本实验中我们可观察到大部分胆管癌病例中是低表达MICA/B的,在体外实验中我们发现低表达MICA/B可以显著抑制NK细胞的杀伤作用,这与肿瘤细胞主动地抑制免疫反应和选择性的非免疫原性变而实现免疫逃逸有关[2]。在肿瘤的发生发展过程中,会对存活的癌细胞抗原性进行重塑,即“免疫编辑”,最终可逃逸免疫系统的监视,造成肿瘤细胞浸润生长和远处转移[14]。本研究认为胆管癌细胞可通过“免疫编辑”实现对MICA/B的下调表达或丢失表达,使NK细胞缺乏活化信号,抑制NK细胞的杀伤作用;在临床病例中MICA在61.8%(55/89) 胆管癌组织中呈低表达,而57.3%(51/89) 胆管癌中MICB呈低表达,其临床预后显著差于MICA/B高表达组,且与胆管癌侵袭转移特性显著相关。
MICA/B在机体的免疫应答中发挥重要作用,但其表达调控机制还不完全清楚。有文献报道氧化应激、病毒感染可激活胞内MARK通路上调MICA/B的表达[15];也有报道乳腺癌可通过上调miR20a以下调MICA/B的表达[11],但MICA/B在肿瘤中特别是胆管癌中是如何被选择成为免疫逃逸的靶标尚不清楚,这也是我们今后工作的重要方向。
综上所述,胆管癌细胞下调MICA/B,可抑制NK细胞的杀伤作用,最终逃逸机体天然免疫的监视,这可为胆管癌的免疫治疗提供新的靶点。
| [1] | Mittal D, Gubin M M, Schreiber R D, et al. New insights into cancer immunoediting and its three component phases-elimination, equilibrium and escape[J]. Curr Opin Immunol, 2014, 27: 16–25. DOI:10.1016/j.coi.2014.01.004 |
| [2] | Schreiber R D, Old L J, Smyth M J. Cancer immunoediting: integrating immunity's roles in cancer suppression and promotion[J]. Science, 2011, 331(6024): 1565–1570. DOI:10.1126/science.1203486 |
| [3] | Duan S G, Cheng L, Li D J, et al. The role of MAPK-ERK pathway in 67-kDa laminin receptor-induced FasL expression in human cholangiocarcinoma cells[J]. Dig Dis Sci, 2010, 55(10): 2844–2852. DOI:10.1007/s10620-009-1121-9 |
| [4] | Long E O, Kim H S, Liu D, et al. Controlling natural killer cell responses: integration of signals for activation and inhibition[J]. Annu Rev Immunol, 2013, 31: 227–258. DOI:10.1146/annurev-immunol-020711-075005 |
| [5] | Raulet D H, Gasser S, Gowen B G, et al. Regulation of ligands for the NKG2D activating receptor[J]. Annu Rev Immunol, 2013, 31: 413–441. DOI:10.1146/annurev-immunol-032712-095951 |
| [6] | Dambrauskas Z, Svensson H, Joshi M, et al. Expression of major histocompatibility complex class I-related chain A/B (MICA/B) in pancreatic carcinoma[J]. Int J Oncol, 2014, 44(1): 99–104. DOI:10.3892/ijo.2013.2156 |
| [7] | Pende D, Cantoni C, Rivera P, et al. Role of NKG2D in tumor cell lysis mediated by human NK cells: cooperation with natural cytotoxicity receptors and capability of recognizing tumors of nonepithelial origin[J]. Eur J Immunol, 2001, 31(4): 1076–1086. DOI:10.1002/1521-4141(200104)31 |
| [8] | Camp R L, Dolled-Filhart M, Rimm D L. X-tile: a new bio-informatics tool for biomarker assessment and outcome-based cut-point optimization[J]. Clin Cancer Res, 2004, 10(21): 7252–7259. DOI:10.1158/1078-0432.CCR-04-0713 |
| [9] |
李大江, 陈健, 熊燕, 等. 体外共培养体系中胆管癌细胞对内皮细胞的作用[J].
中华消化外科杂志, 2009, 8(2): 127–129.
Li D J, Chen J, Xiong Y, et al. Influence of cholangiocarcinoma cells on endothelial cells in a co-culture system[J]. Chinese Journal of Digestive Surgery, 2009, 8(2): 127–129. DOI:10.3760/cma.j.issn.1673-9752.2009.02.018 |
| [10] | Gui A, Kobayashi A, Motoyama H, et al. Impaired degradation followed by enhanced recycling of epidermal growth factor receptor caused by hypo-phosphorylation of tyrosine 1045 in RBE cells[J]. BMC Cancer, 2012, 12: 179. DOI:10.1186/1471-2407-12-179 |
| [11] | Wang B, Wang Q, Wang Z, et al. Metastatic consequences of immune escape from NK cell cytotoxicity by human breast cancer stem cells[J]. Cancer Res, 2014, 74(20): 5746–5757. DOI:10.1158/0008-5472.CAN-13-2563 |
| [12] | Peruzzi G, Masilamani M, Borrego F, et al. Endocytosis as a mechanism of regulating natural killer cell function: unique endocytic and trafficking pathway for CD94/NKG2A[J]. Immunol Res, 2009, 43(1-3): 210–222. DOI:10.1007/s12026-008-8072-7 |
| [13] | Gavlovsky P J, Tonnerre P, Gerard N, et al. Alternative Splice Transcripts for MHC Class I-like MICA Encode Novel NKG2D Ligands with Agonist or Antagonist Functions[J]. J Immunol, 2016, 197(3): 736–746. DOI:10.4049/jimmunol.1501416 |
| [14] | Pages F, Kroemer G. Prognostic impact of anticancer immune responses: an introduction[J]. Semin Immunopathol, 2011, 33(4): 317–319. DOI:10.1007/s00281-011-0278-4 |
| [15] | Groh V, Rhinehart R, Randolph-Habecker J, et al. Costimulation of CD8alphabeta T cells by NKG2D via engagement by MIC induced on virus-infected cells[J]. Nat Immunol, 2001, 2(3): 255–260. DOI:10.1038/85321 |



