2. 400038 重庆,第三军医大学西南医院全军临床病理学研究所
2. Institute of Clinical Pathology, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
皮肤鳞状细胞癌 (cutaneous squamous cell carcinoma,cSCC) 是起源于皮肤表皮或附属器角质形成细胞的恶性肿瘤,在非黑色素瘤性皮肤恶性肿瘤中的发病率仅次于基底细胞癌[1]。近年来,cSCC发病率日益升高,不仅影响患者美观导致毁容,还可因发生转移而威胁患者生命。
恶性肿瘤的发生、发展与代谢密切相关。在多种肿瘤细胞中存在脂质代谢相关基因的表达异常。作为调节脂质合成及代谢的关键因子,肝X受体 (liver X receptors,LXRs) 及其下游代谢通路广泛参与了肿瘤的脂代谢,影响肿瘤的微环境,并调控肿瘤细胞的增殖和凋亡[2-3]。我们前期实验发现,人角质形成细胞和皮肤鳞癌细胞中存在LXRs的差异表达,LXRβ为优势表达亚型。然而,LXRβ的表达是否与皮肤鳞癌的发生、发展有关,目前尚不清楚。因此,本研究通过分析皮肤正常角质形成细胞 (keratinocyte,KC) 与皮肤鳞状细胞癌A431细胞系中LXRβ mRNA、蛋白的表达情况和在cSCC疾病进展过程中的变化规律以及LXRβ与cSCC临床病理参数之间的相关性,探讨其临床应用价值。
1 资料与方法 1.1 资料 1.1.1 研究对象选取2015年1月至2016年6月在第三军医大学新桥医院皮肤科确诊为日光性角化病 (actinic keratosis,AK)、皮肤原位鳞状细胞癌 (即鲍温病,Bowen’s disease,BD)、cSCC的手术切除组织标本。AK标本52例,男性20例,女性32例,年龄40~ 90(64.35±12.98) 岁;BD标本40例,男性24例,女性16例,年龄39~93(65.15±13.73) 岁;cSCC标本60例,男性30例,女性30例,年龄42~99(69.08±13.79) 岁;对照组为手术切除组织边缘的正常皮肤,共40例,男性20例,女性20例,年龄25~71(45.3±12.12) 岁。病例均为初诊,且由皮肤病理确诊。患者术前均未接受放化疗、药物及其他治疗。
1.1.2 细胞系人正常皮肤角质形成细胞KC以及皮肤鳞状细胞癌A431细胞系均购自美国组织培养库 (American tissue culture collection,ATCC),在37 ℃、5%CO2的细胞培养箱中培养。
1.1.3 试剂角质形成细胞培养基、胰蛋白酶终止缓冲液 (ATCC),DMEM培养基、DPBS缓冲液 (美国HyClone公司),青霉素-链霉素溶液 (美国Cellgro公司),胰蛋白酶 (美国Roche公司),TBS干粉 (北京中杉公司)。RNeasy Mini试剂盒、RT2 First Strand试剂盒、RT2 SYBR Green qPCR Mastermix、RT2 Profiler PCR Array Plate (美国Qiagen公司)。兔抗人LXRα抗体 (HPA036443,美国Sigma公司)、兔抗人LXRβ抗体 (AV38906,美国Sigma公司)、ECL化学发光试剂盒 (Millipore公司)。免疫组化一抗:兔抗人LXRβ抗体 (HPA056838,美国Sigma公司),免疫组化Envision试剂盒 (DAKO公司)、DAB显色试剂盒 (DAKO公司)。
1.2 方法 1.2.1 PCR array测定LXRs在KC细胞以及A431细胞中mRNA的表达将培养好的KC和A431细胞按照RNeasy Mini Kit说明书中的操作步骤进行总RNA提取并检验RNA样本纯度和浓度。按照RT试剂盒 (RT2 First Strand Kit) 说明进行逆转录 (reverse transcription,RT) 反应。各步使用实验器材均为RNase-free配置。按RT2 Profiler PCR Array Plate试剂盒的操作说明配置反应体系。扩增调节: 95 ℃预变性10 min,95 ℃ 15 s,60 ℃ 1 min,共40个循环。
1.2.2 Western blot测定LXRs在KC、A431细胞中蛋白的表达取KC、A431对数生长期细胞,分别用RIPA裂解液提取细胞总蛋白,BCA法测定蛋白浓度,定量后煮沸变性。10% SDS-PAGE电泳分离蛋白,每孔上样量40 μg,湿转法转移到PVDF上,含5% BSA的TBST室温下封闭1~2 h,一抗 (LXRα 1 :250 LXRβ 1 :250稀释)4 ℃过夜,TBST洗膜10 min×3次,二抗 (1 : 5 000稀释) 室温1 h,加入TBST洗涤NC膜,5 min× 3次, 置于ECL化学发光试剂中反应显色,曝光,成像,保存图片。采用Imag J进行灰度分析。
1.2.3 免疫组织化学染色采用Envision法检测LXRβ的表达,兔抗人LXRβ抗体使用浓度为1 :50,免疫组化染色严格按照Envision试剂盒说明书进行。采用PBS替代一抗进行染色为阴性对照。选用预实验中已知阳性的cSCC组织切片为阳性对照。
1.3 免疫组化结果判定LXRβ蛋白阳性染色为细胞核或细胞质深染呈棕黄色或棕褐色。由两名高年资皮肤病理医生对其结果进行判断。每张切片随机选取5个不连续高倍视野,采用半定量计分方式对染色结果进行计分。按细胞染色强度分为4级:无着色记0分,淡黄色记1分,黄色记2分,棕黄色或棕色记3分。按照阳性细胞百分比分为4级:阴性为0分,≤25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。综合评价由染色强度与阳性细胞百分比两者评分之积表示,若评分≤3分 (-),4~6分 (+),7~9分 (+ +),10~12分 (+++)。
1.4 统计学分析采用SPSS 20.0统计软件。LXRβ表达频数相关性分析采用χ2检验,两样本间非参数检验采用Mann-Whitney I检验,多样本间非参数检验采用Kruskal Wallis检验。计量数据以x±s表示,组间比较采用独立样本t检验或单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 LXRs的mRNA在人KC细胞和A431细胞中的差异性表达与KC细胞比较,A431细胞中LXRα、LXRβ的mRNA水平升高,以LXRβ升高显著 (图 1A)。Western blot也从蛋白水平证实了上述趋势 (图 1B)。
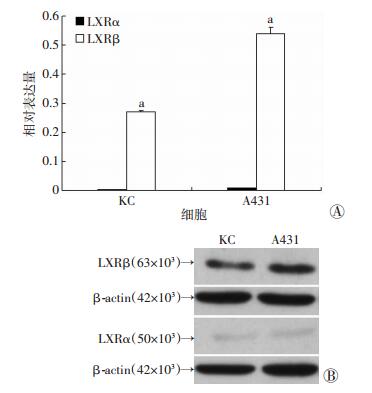
|
| A: KC和A431细胞中LXRs mRNA的表达a:P < 0.05,与KC细胞比较; B: KC和A431细胞中LXRs蛋白的表达 图 1 LXRs在正常皮肤及皮肤鳞癌细胞中的表达 |
2.2 LXRβ在皮肤鳞癌进程中的差异性表达
LXRβ在AK、BD、cSCC中表达逐渐升高,以cSCC升高最明显。LXRβ在正常皮肤中主要定位于细胞核,阳性细胞位于表皮中上部,散在分布 (图 2A);在AK皮损中阳性细胞集中于表皮基底层及棘层中下1/3细胞的细胞核中 (图 2B);在BD皮损中阳性细胞主要表达于表皮全层非典型增生角质形成细胞的胞核内,细胞质中有少量表达 (图 2C);在cSCC皮损中LXRβ弥漫性表达在鳞状细胞癌巢中及周围的基底样细胞核内,部分胞质深染为棕褐色散在颗粒 (图 2D)。
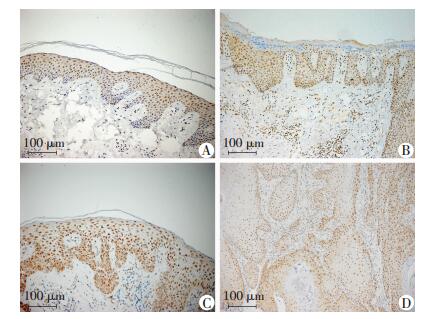
|
| A:正常皮肤;B:AK组织;C:BD组织;D:cSCC组织 图 2 LXRβ在正常皮肤及皮肤鳞癌组织中的表达 (S-P) |
2.3 LXRβ的表达及与cSCC临床病理参数的关系
LXRβ的表达与cSCC浸润深度、肿瘤大小、分化程度相关 (P < 0.05,表 1),与年龄、性别、曝光部位无明显相关性 (P>0.05,表 1)。
| 临床参数 | n | 阳性例数 | 评分 (x±s) | 阳性率 (%) |
| 年龄 | ||||
| ≤60岁 | 14 | 12 | 7.57±3.50 | 85.7 |
| >60岁 | 46 | 41 | 6.72±2.81 | 89.1 |
| 性别 | ||||
| 男 | 30 | 27 | 7.13±3.10 | 90.0 |
| 女 | 30 | 26 | 6.70±2.89 | 86.7 |
| 曝光部位 | ||||
| 是 | 40 | 35 | 7.03±3.15 | 88.0 |
| 否 | 20 | 18 | 6.70±2.66 | 90.0 |
| 浸润深度 | ||||
| >4 mm | 33 | 32 | 8.52±2.68 | 97.0 |
| ≤4 mm | 27 | 21a | 4.96±2.01a | 77.8a |
| 肿瘤长径 | ||||
| >2 cm | 40 | 37 | 7.75±2.97 | 92.5 |
| ≤2 cm | 20 | 16b | 5.10±2.07 b | 80.0b |
| 分化程度c | ||||
| 高分化 | 22 | 22 | 8.32±2.61 | 100.0 |
| 中分化 | 21 | 20 | 7.67±2.54 | 95.2 |
| 低分化 | 17 | 11 | 4.18±2.07 | 64.7 |
| a: P < 0.05, 与浸润深度>4 mm组比较;b:P < 0.01,与肿瘤长径>2 cm组比较;c:P < 0.01,不同分化程度之间总体差异 | ||||
2.4 LXRβ在cSCC及其癌前病变中的表达规律
LXRβ在AK、BD、cSCC中的表达均较NS明显升高 (P < 0.05,表 2)。LXRβ在cSCC中其细胞染色强度和阳性细胞百分比评分均较BD、AK和正常皮肤组织升高,且差异有统计学意义 (P < 0.05,表 3)。进一步分析显示,无论是阳性细胞百分比评分,还是染色强度评分,LXRβ在高、中分化组的表达显著高于低分化组 (P < 0.05,表 4)。
| 组别 | n | - | + | ++ | +++ | 阳性率 (%) |
| NS | 40 | 21 | 19 | 0 | 0 | 47.5 |
| AK | 52 | 15 | 34 | 3 | 0 | 71.1ab |
| BD | 40 | 6 | 29 | 5 | 0 | 85.0ab |
| cSCC | 60 | 7 | 31 | 13 | 9 | 88.3b |
| a: P < 0.05, 与cSCC组比较; b: P < 0.05, 与NS组比较 | ||||||
| 组别 | n | 阳性细胞百分比评分 | 染色强度评分 | 总分 | ||
| NS | 40 | 1.70±0.61 | 1.75±0.49 | 3.00±1.41 | ||
| AK | 52 | 2.00±0.68ab | 2.12±0.58ab | 4.35±2.06ab | ||
| BD | 40 | 2.50±0.64ab | 2.15±0.66ab | 5.45±2.04ab | ||
| cSCC | 60 | 2.78±0.76b | 2.42±0.62b | 6.92±2.98b | ||
| a: P < 0.05,与cSCC组比较; b: P < 0.05, 与NS组比较 | ||||||
| 组别 | n | 阳性细胞百分比评分 | 染色强度评分 | 总分 |
| 高分化 | 22 | 3.09±0.68a | 2.68±0.48a | 8.32±2.60a |
| 中分化 | 21 | 3.00±0.55a | 2.52±0.60a | 7.67±2.54a |
| 低分化 | 17 | 2.12±0.70 | 1.94±0.56 | 4.18±2.07 |
| a: P < 0.05, 与低分化组比较 | ||||
3 讨论
LXRs是配体激活的核转录因子,主要有LXRα和LXRβ两种亚型。LXRα主要分布于代谢活跃的组织,如肝脏、小肠、肾脏、巨噬细胞中,而LXRβ则广泛分布于身体各组织中[4]。LXRs不但参与胆固醇、脂肪酸与葡萄糖稳态的调节[5],还可抑制包括结肠癌、前列腺癌、乳腺癌、胰腺癌在内的多种肿瘤细胞的增殖[3]。LXRs及其调控的代谢通路参与了恶性肿瘤的发生、发展。
本研究发现,与正常角质形成细胞相比,皮肤鳞癌A431细胞中LXRα、LXRβ的表达水平均升高,以LXRβ升高尤为显著。LXRβ在cSCC组织中的表达也升高明显。有研究报道,LXRβ在胰腺导管腺癌[6]、结肠癌[7]、恶性黑素瘤[8]等多种肿瘤组织或细胞系中表达增高,LXRβ是优势表达亚型。但在口腔鳞状细胞癌[9]、胃癌组织[10]中LXRβ的表达下降,以LXRα表达为主。这表明LXRs的表达在不同肿瘤中有一定的组织特异性。本研究还发现,在cSCC组织中LXRβ蛋白除在细胞核表达外,在细胞质中也有阳性表达。这与在胰腺导管癌[6]和结肠癌[11]的组织和细胞系中观察到的染色情况相似。在无配体激活的情况下,LXRβ主要定位于细胞核,在配体激活的状态下,细胞质染色增多[12]。本研究结果提示,LXRβ在组织中的不同定位可能与LXRβ的激活相关,这种表达丰富区域的迁移模式可视为LXRβ激活的标志。由此推测,LXRβ在皮肤鳞癌中表达上调和定位差异可能是机体抗肿瘤的一种潜在保护机制。
本实验还发现,LXRβ的表达在正常组织向癌前病变AK、原位癌BD、皮肤鳞癌cSCC的演变过程中随着疾病的进展逐渐增多。与Gabbi等[13]研究胆囊黏膜上皮恶性转化 (化生/不典型增生、原位癌、浸润性癌) 过程中LXRβ的表达变化相似,随着疾病的进展LXRβ的表达逐渐升高。涂光辉等[14]发现LXRα在乳腺浸润性导管癌中的表达也明显高于导管原位癌、乳腺增生症和正常乳腺。由此可见,LXRs的表达上调参与了肿瘤的演进过程,是肿瘤发生、发展的重要调节因子。我们还发现了一个有意思的现象,在不同组织学分型的鳞状细胞癌中,由于LXRβ表达情况不同而展现出不同肿瘤生物学特点。LXRβ在恶性程度高的低分化鳞状细胞癌中的表达低于分化较好的高、中分化组,这一现象目前尚未见相关文献报道。在乳腺癌、前列腺癌、卵巢癌、肺癌、皮肤恶性黑素瘤和结肠癌等肿瘤中,LXRs可通过调节下游信号通路来抑制肿瘤细胞的生长。这可能由于LXRs的低表达导致下游抑癌基因的表达减少,抑制肿瘤生长的信号通路受到影响,其抗增殖的作用减弱所致。Zhang等[15]在小鼠黑色素瘤B16F10细胞中发现活化的LXRβ主要通过抑制细胞增殖来诱导凋亡。在人结肠癌细胞中,LXRs主要通过调节细胞周期各调控点信号来抑制细胞增殖,如下调Cyclin B1、Cyclin E等表达使细胞周期阻滞于G1/G0,S期减少从而引起结肠癌细胞周期阻滞[16]。Tsui等[17]研究发现,LXRs及其激动剂在前列腺癌3种常见细胞系LNCaP、PC-3及DU-145中均可影响细胞周期,使细胞停止在G1期,从而达到抑制肿瘤细胞增殖的目的。由于在皮肤鳞癌中LXRβ为优势表达亚型,LXRs激动剂可能通过LXRβ的受体依赖途径,调节多个下游信号因子的表达,从而使细胞周期停滞,达到抑制肿瘤细胞增殖的作用。但LXRs抑制增殖、促进凋亡的具体作用机制仍需进一步研究。
| [1] | Mateus C. Cutaneous squamous cell carcinoma[J]. Rev Prat, 2014, 64(1): 45–52. |
| [2] | Raccosta L, Fontana R, Corna G, et al. Cholesterol metabolites and tumor microenvironment: the road towards clinical translation[J]. Cancer Immunol Immunother, 2016, 65(1): 111–117. DOI:10.1007/s00262-015-1779-0 |
| [3] | Bovenga F, Sabbà C, Moschetta A. Uncoupling nuclear receptor LXR and cholesterol metabolism in cancer[J]. Cell Metab, 2015, 21(4): 517–526. DOI:10.1016/j.cmet.2015.03.002 |
| [4] | Gabbi C, Warner M, Gustafsson J Å. Action mechanisms of Liver X Receptors[J]. Biochem Biophys Res Commun, 2014, 446(3): 647–650. DOI:10.1016/j.bbrc.2013.11.077 |
| [5] | Lin C Y, Gustafsson J Å. Targeting liver X receptors in cancer therapeutics[J]. Nat Rev Cancer, 2015, 15(4): 216–224. DOI:10.1038/nrc3912 |
| [6] | Candelaria N R, Addanki S, Zheng J, et al. Antiproliferative effects and mechanisms of liver X receptor ligands in pancreatic ductal adenocarcinoma cells[J]. PLoS One, 2014, 9(9): e106289. DOI:10.1371/journal.pone.0106289 |
| [7] | Derangère V, Chevriaux A, Courtaut F, et al. Liver X receptor β activation induces pyroptosis of human and murine colon cancer cells[J]. Cell Death Differ, 2014, 21(12): 1914–1924. DOI:10.1038/cdd.2014.117 |
| [8] | Pencheva N, Buss C G, Posada J, et al. Broad-spectrum therapeutic suppression of metastatic melanoma through nuclear hormone receptor activation[J]. Cell, 2014, 156(5): 986–1001. DOI:10.1016/j.cell.2014.01.038 |
| [9] | Kaneko T, Kanno C, Ichikawa-Tomikawa N, et al. Liver X receptor reduces proliferation of human oral cancer cells by promoting cholesterol efflux via up-regulation of ABCA1 expression[J]. Oncotarget, 2015, 6(32): 33345–33357. DOI:10.18632/oncotarget.5428 |
| [10] |
王然, 李瑞欣, 文俏程, 等. 肝X受体-β在胃癌组织中的表达及其激动剂GW3965对胃癌细胞SGC-7901增殖的影响[J].
中南大学学报 (医学版), 2016, 41(2): 127–133.
Wang R, Li R X, Wen Q C, et al. Expression of LXR-β in human gastric cancer tissue and the effect of GW3965 on the proliferation of gastric cancer cell line SGC-7901[J]. J Cent South Univ (Med Sci), 2016, 41(2): 127–133. DOI:10.11817/j.issn.1672-7347.2016.02.003 |
| [11] | Courtaut F, Derangère V, Chevriaux A, et al. Liver X receptor ligand cytotoxicity in colon cancer cells and not in normal colon epithelial cells depends on LXRβ subcellular localization[J]. Oncotarget, 2015, 6(29): 26651–26662. DOI:10.18632/oncotarget.5791 |
| [12] | Prüfer K, Boudreaux J. Nuclear localization of liver X receptor alpha and beta is differentially regulated[J]. J Cell Biochem, 2007, 100(1): 69–85. DOI:10.1002/jcb.21006 |
| [13] | Gabbi C, Kim H J, Barros R, et al. Estrogen-dependent gallbladder carcinogenesis in LXRbeta-/-female mice[J]. Proc Natl Acad Sci U S A, 2010, 107(33): 14763–14768. DOI:10.1073/pnas.1009483107 |
| [14] |
涂光辉, 汤石林, 谢黎明, 等. 肝x受体在乳腺癌组织中的表达及其对mcf-7细胞增殖的影响[J].
中国现代医学杂志, 2012, 22(28): 5–9.
TU G H, Tang S L, Xie L M, et al. Expression of liver X receptors in human breast cancer and its effect on prolife-ration of breast cancer cell line MCF-7[J]. China Journal of Modern Medicine, 2012, 22(28): 5–9. DOI:10.3969/j.issn.1005-8982.2012.28.002 |
| [15] | Zhang W, Jiang H, Zhang J, et al. Liver X receptor acti-vation induces apoptosis of melanoma cell through caspase pathway[J]. Cancer Cell Int, 2014, 14(1): 16–21. DOI:10.1186/1475-2867-14-16 |
| [16] | Chuu C P. Modulation of liver X receptor signaling as a prevention and therapy for colon cancer[J]. Med Hypotheses, 2011, 76(5): 697–699. DOI:10.1016/j.mehy.2011.01.037 |
| [17] | Tsui K H, Chung LC, Feng T H, et al. Divergent effect of liver X receptor agonists on prostate-specific antigen expression is dependent on androgen receptor in prostate carcinoma cells[J]. Prostate, 2015, 75(6): 603–615. DOI:10.1002/pros.22944 |



