2. 400038 重庆,第三军医大学:基础医学部神经生物学教研室;
3. 400715 重庆, 西南大学生命科学学院
2. Department of Neurobiology, College of Basic Medical Sciences, Third Military Medical University, Chongqing, 400038;
3. School of Life Sciences, Southwest University, Chongqing, 400715, China
雌激素 (estrogens,E2) 是一种非常重要的性腺激素,具有调控海马树突棘形态和密度的作用[1]。Woolley等[2-3]首次报道了雌性大鼠海马树突棘密度受动情周期波动的影响且可通过E2替代所调控。神经元自身通过芳香化酶催化合成的雌激素也参与海马树突棘密度的调控,且给予芳香化酶抑制剂来曲唑 (letrozole,LET) 处理后可抑制海马树突棘密度[4-5]。但迄今为止E2调控细胞骨架的具体机制仍不清楚。
E2有3种受体,即雌激素α受体 (estrogen receptor α,ERα)、雌激素β受体 (estrogen receptor beta,ERβ) 和雌激素膜性受体 (G protein-coupled receptor 30,GPR30)[6]。1996年,Mosselman等[7]在啮齿动物和其他物种的海马中首次检测到ERβ,其表达水平受发育、E2、LET等调控[8],但ERβ在出生后至成年海马的表达变化情况却不清楚。有研究发现ERβ可调控海马突触可塑性、长时程增强 (long-term potentiation,LTP) 和海马依赖性空间学习记忆,且活化ERβ可增加突触蛋白的表达[9], 但ERβ调节海马突触可塑性的具体机制目前仍不清楚。
Actin是树突棘最重要的结构组成之一,游离状态的G-actin在Profilin-1的作用下聚合成纤维状的F-actin,而F-actin则在cofilin的作用下解聚为G-actin,Profilin-1和cofilin对actin的多聚化起到了关键的作用并受到Rictor及其下游效应分子磷酸化蛋白激酶B (phospho-protein kinase B,p-Akt,ser473) 的调节,而actin聚合-解聚的动态变化则构成了突触形态可塑性的基础即学习记忆的基础[10-12]。虽然有研究报道E2可以调控细胞骨架多聚化状态的变化,改变树突棘密度和突触密度进而影响学习记忆和认知行为[13],但其中是否涉及对actin聚合状态的调节以及ERβ是否参与该调节尚不清楚。因此,本研究首先检测出生后小鼠海马ERβ表达的变化,然后检测调节ERβ的活性改变对上述actin聚合调节蛋白表达的影响,并初步探讨其可能的机制,从而为阐明E2调节学习记忆的机制提供新的实验证据。
1 材料与方法 1.1 动物和分组出生后0(P0)、7(P7)、14(P14)、28(P28)、56 d (P56) C57BL/6小鼠 (雌雄各半) 和成年雌性C57BL/6小鼠,均购自第三军医大学实验动物中心,严格遵守批准机构的动物保健和使用协议。将P0、P7、P14、P28、P56 C57BL/6小鼠按性别 (雌性、雄性) 和出生后不同时间采用随机数字表法分为10个组,每组6只,将各组小鼠处死,采集大脑组织标本,然后采用免疫组化和Western blot检测ERβ的蛋白表达水平。另取60只动情间期成年雌性C57BL/6小鼠,体质量 (20±2) g,建立2种动物模型。① PHTPP (ERβ活性抑制剂) 模型分为5组:对照组,PHTPP注射1、3、5、7 d组,每组6只,给药方法:PHTPP (100 μg/kg) 用DMSO溶解,对照组注射等量的DMSO,腹腔注射,1次/d。② OVX 1周后注射ERβ活性激动剂 (diarylpropionitrile,DPN) 模型分为5个组:假手术对照组,OVX组,OVX 1周后分别注射DPN 1.25、2.5、5.0 mg/kg组,每组6只,给药方法:DPN用DMSO溶解,对照组和OVX组注射等量的DMSO,皮下注射1周,1次/d。药物处理结束后处死小鼠,采集脑组织标本,检测SRC-1、Rictor、p-Akt、Profilin-1和p-cofilin的表达变化。
1.2 抗体与试剂兔抗SRC-1、兔抗ERβ购自Santa Cruz公司,兔抗Rictor、兔抗p-Akt、兔抗Akt、兔抗p-cofilin、兔抗cofilin均购自Cell Signaling Technology公司,兔抗Profilin-1由GeneTex提供,BCA试剂盒、鼠抗β-actin购自碧云天公司,DAB试剂盒、HRP标记链霉卵白素复合物、生物素化山羊抗兔IgG购自北京中杉金桥公司,其余实验材料均由第三军医大学神经生物学教研室提供。
1.3 冰冻切片与免疫组化按常规方法用4%多聚甲醛灌注固定、30%蔗糖组织脱水后行冰冻切片。取10 mmol/L PBS (pH 7.4) 漂洗3次,5 min/次,3%H2O2封闭15 min,PBS漂洗3次,加入ERβ抗体 (1:100)、SRC-1抗体 (1:200) 于4 ℃冰箱中孵育过夜。PBS漂洗一抗,加入生物素化山羊抗兔IgG工作液放置室温中孵育1 h,用PBS漂洗3次,加入链霉卵白素标记的辣根酶复合物在室温中孵育1 h,PBS再漂洗3次后,用DAB试剂盒显色,常规脱水,二甲苯透明后用中性树胶封片。免疫阳性产物光密度的测量采用Image Pro Plus软件,计算出平均光密度值后进行相应的统计分析。
1.4 Western blot检测剥离大脑海马组织,用RIPA裂解液提取总蛋白并用BCA试剂盒测定蛋白浓度,蛋白变性后,进行SDS-PAGE电泳,转至PVDF膜上,5%封闭蛋白粉-TBST封闭2 h,按分子量切割条带,加入相应的一抗分别是ERβ (1:100)、SRC-1 (1:600)、Rictor (1:500)、p-Akt (1:2 000)、Akt (1:2 000)、p-cofilin (1:300)、cofilin (1:300)、Profilin-1 (1:4 000)、β-actin (1:1 000),4 ℃孵育一夜。TBST摇晃洗4次,10 min/次,加入山羊抗兔标记的二抗 (1:2 000)、山羊抗小鼠二抗 (1:2 000),二抗除β-actin为山羊抗小鼠外其余均为山羊抗兔,放置37 ℃生化培养箱中孵育90 min。TBST再次摇晃洗4次,配制化学发光液,采用ECL曝光显影。对于磷酸化抗体的检测,则是在p-Akt和p-cofilin曝光显影后将条带放入抗体去除液中于摇床上摇晃7 min,5%封闭蛋白粉-TBST封闭2 h后,更换一抗为Akt和cofilin,然后重复以上步骤。曝光结果采用Quantity One软件进行分析。
1.5 统计学分析采用SPSS 20.0统计软件进行数据分析,计量资料以x±s表示,对ERβ、Rictor、p-Akt、Profilin-1、p-cofilin、SRC-1各指标进行多组间比较采用单因素方差分析,组间比较进行LSD-t检验。检验水准:α=0.05。
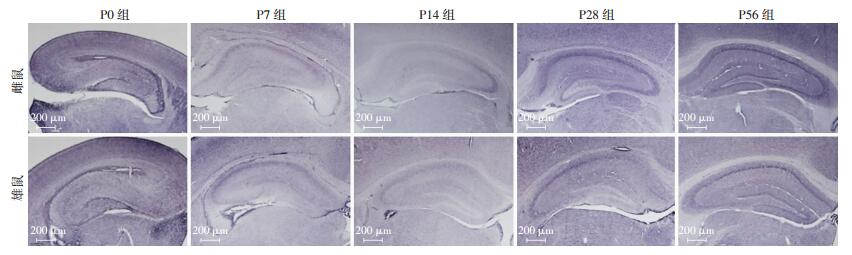
2 结果 2.1 ERβ在生后雌雄小鼠海马中的表达Western blot和免疫组化检测结果发现,ERβ表达在雌鼠P0组较高,与雌鼠P0组比较,雌鼠P7组和雌鼠P14组表达降低 (P < 0.05),且两组之间比较无明显变化 (P>0.05)。雌鼠P28组较雌鼠P7组和雌鼠P14组ERβ表达显著上升 (P < 0.01),并高于雌鼠P0组的水平 (P < 0.05);与雌鼠P0组比较,雌鼠P56组ERβ表达进一步上升 (P < 0.01)。雄性小鼠海马ERβ呈现出类似的表达变化趋势,在雄鼠P28组其表达上升并达到出生时水平 (图 1、2)。
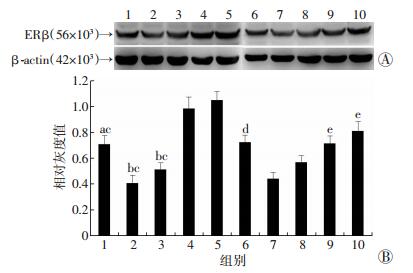
|
| 1:雌鼠P0组;2:雌鼠P7组;3:雌鼠P14组;4:雌鼠P28组;5:雌鼠P56组;6:雄鼠P0组;7:雄鼠P7组;8:雄鼠P14组;9:雄鼠P28组;10:雄鼠P56组A:Western blot检测结果;B:半定量分析结果a:P < 0.05,b:P < 0.01,与雌鼠P28组比较;c:P < 0.01,与雌鼠P56组比较;d:P < 0.05,e:P < 0.01,与雄鼠P7组比较 图 1 Western blot检测各组海马ERβ的表达 |
|
| 图 2 免疫组化检测各组海马ERβ的表达 (S-P) |
2.2 海马actin聚合调节蛋白的表达受PHTPP、OVX和DPN调节
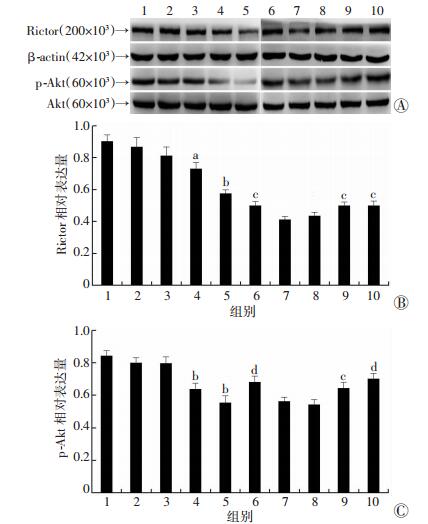
Western blot检测结果显示:与对照组比较,Rictor的表达在PHTPP注射5 d组开始下降 (P < 0.05),PHTPP注射7 d组进一步下降 (P < 0.01)。与假手术对照组相比,OVX组Rictor表达下降 (P < 0.05);和OVX组相比,OVX+1.25 mg/kg DPN组无显著变化 (P>0.05),而OVX+2.5 mg/kg DPN组和OVX+5.0 mg/kg DPN组表达增加 (P < 0.05)。Rictor下游效应分子p-Akt在PHTPP注射5 d组和7 d组表达较对照组显著减少 (P < 0.01)。p-Akt在OVX组的表达较假手术对照组显著降低 (P < 0.01),与OVX组比较,OVX+ 1.25 mg/kg DPN组表达差异无统计学意义 (P>0.05),OVX+2.5 mg/kg DPN组表达上升 (P < 0.05),OVX+5.0 mg/kg DPN组表达进一步上升 (P < 0.01,图 3)。
|
|
1:对照组;2:PHTPP注射1 d组;3:PHTPP注射3 d组;4:PHTPP注射5 d组;5:PHTPP注射7 d组;6:假手术对照组;7:OVX组;8:OVX+1.25 mg/kg DPN组;9:OVX+2.5 mg/kg DPN组;10:OVX+5.0 mg/kg DPN组 A:Western blot检测结果;B、C:Rictor和p-Akt的半定量分析结果a:P < 0.05,b:P < 0.01,与对照组比较;c:P < 0.05,d:P < 0.01,与OVX组比较 图 3 ERβ对海马Rictor及其下游靶分子p-Akt的调控 |
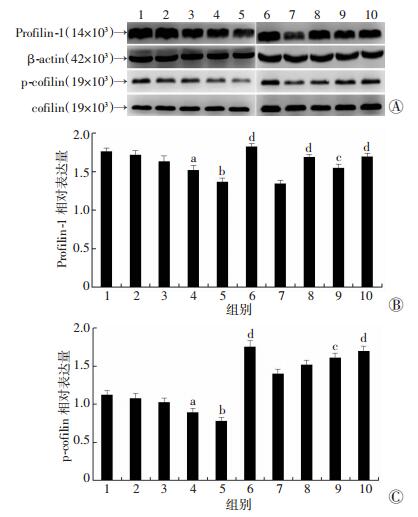
Western blot检测结果显示,与对照组比较,actin聚合调节蛋白Profilin-1和p-cofilin在PHTPP注射5 d组的表达下降 (P < 0.05),PHTPP注射7 d组进一步下降 (P < 0.01)。OVX后上述两个蛋白分子的表达明显下降 (P < 0.01);与OVX组比较,Profilin-1在OVX+2.5 mg/kg DPN组的表达稍增加 (P < 0.05),在OVX+1.25 mg/kg DPN组和OVX+5.0 mg/kg DPN组表达显著增加 (P < 0.01),而p-cofilin在OVX+1.25 mg/kg DPN组表达变化差异无统计学意义 (P>0.05),在OVX+2.5 mg/kg DPN组表达开始增加 (P < 0.05),在OVX+5.0 mg/kg DPN组表达显著增加 (P < 0.01,图 4)。
|
|
1:对照组;2:PHTPP注射1 d组;3:PHTPP注射3 d组;4:PHTPP注射5 d组;5:PHTPP注射7 d组;6:假手术对照组;7:OVX组;8:OVX+1.25 mg/kg DPN组;9:OVX+2.5 mg/kg DPN组;10:OVX+5.0 mg/kg DPN组 A:Western blot检测结果;B、C:Profilin-1和p-cofilin的半定量分析结果a:P < 0.05,b:P < 0.01,与对照组比较;c:P < 0.05,d:P < 0.01,与OVX组比较 图 4 ERβ对海马actin细胞骨架聚合调节因子的调控 |
2.3 海马SRC-1的表达受PHTPP、OVX和DPN调节
Western blot检测结果显示,与对照组相比,PHTPP注射5 d组SRC-1的表达开始减少 (P < 0.05),PHTPP注射7 d组其表达显著减少 (P < 0.01)。与假手术对照组相比,OVX组SRC-1表达明显下降 (P < 0.01);与OVX组比较,在OVX+1.25 mg/kg DPN组SRC-1表达无明显变化 (P>0.05),在OVX+2.5 mg/kg DPN组SRC-1表达开始增加 (P < 0.05),在OVX+5.0 mg/kg DPN组SRC-1表达显著增加 (P < 0.01)。免疫组化的结果与Western blot检测结果一致,再次验证了上述结果 (图 5、6)。
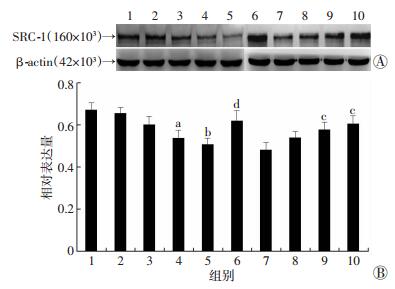
|
|
1:对照组;2:PHTPP注射1 d组;3:PHTPP注射3 d组;4:PHTPP注射5 d组;5:PHTPP注射7 d组;6:假手术对照组;7:OVX组;8:OVX+1.25 mg/kg DPN组;9:OVX+2.5 mg/kg DPN组;10:OVX+5.0 mg/kg DPN组 A:Western blot检测结果;B:半定量分析结果a:P < 0.05,b:P < 0.01,与对照组比较;c:P < 0.05,d:P < 0.01,与OVX组比较 图 5 Western blot检测ERβ对海马SRC-1表达的调控 |
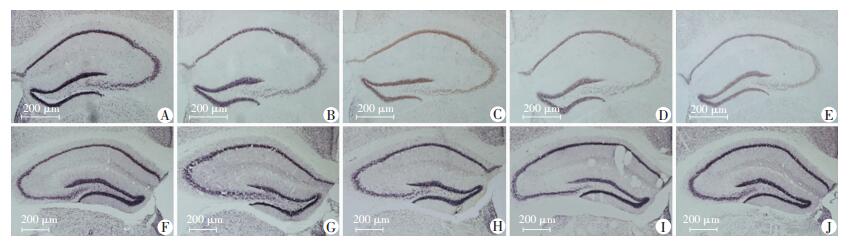
|
| A:对照组;B:PHTPP注射1 d组;C:PHTPP注射3 d组;D:PHTPP注射5 d组;E:PHTPP注射7 d组;F:假手术对照组;G:OVX组;H:OVX+1.25 mg/kg DPN组;I:OVX+2.5 mg/kg DPN组;J:OVX+5.0 mg/kg DPN组 图 6 免疫组化检测ERβ对海马SRC-1表达的调控 (S-P) |
3 讨论
大脑海马组织是负责学习与记忆功能的关键脑区。研究证实,E2对海马的结构和功能以及学习记忆有重要的调节作用,而E2发挥作用主要是通过与其核受体ERα和ERβ相结合的基因转录途径以及与膜受体GPR30相结合的第二信使通路途径[14],而作为E2经典核受体之一的ERβ在调控树突棘结构、突触蛋白的表达以及学习记忆等方面具有不可替代的作用[9],但是其具体的作用机制仍不清楚。研究表明,在小鼠海马中可检测到ERβ mRNA和蛋白的表达,小鼠胚胎发育中期的海马神经元内发现中等强度的表达[15];出生前和出生后的表达波动不明显且雄性小鼠处于较高的表达水平[16]。另有研究报道,ERβ在海马CA1区呈现由高水平转向低水平再恢复到高水平的变化,而在P0~P28时CA3表达下降[17]。本研究采用免疫组化和Western blot检测发现,从出生到成年雌、雄小鼠的海马组织中ERβ均呈现出“高-低-高”的U型变化趋势,免疫组化实验发现ERβ免疫阳性产物广泛分布于锥体细胞层与颗粒细胞层。本研究结果表明,ERβ在出生到成年期间的表达变化趋势,在出生时和成年海马中广泛表达,且雌性小鼠P28时海马ERβ表达就已高于P0时表达,为下一步的研究工作提供了理论依据。
Actin是最重要的细胞内骨架蛋白,在树突棘形成过程中通过调节树突棘大小和突触联系进而影响突触可塑性[18]。Profilin-1是actin细胞骨架聚合调节蛋白之一,而cofilin是actin解聚因子 (ADF)/cofilin家族成员之一,且直接参与神经元细胞actin的解聚调控[19]。研究表明,Rictor及其下游靶分子p-Akt可调控Profilin-1和cofilin表达以及actin动力学变化进而影响记忆的形成,而actin细胞骨架调节蛋白的变化是海马依赖性长时程增强和记忆巩固的关键[10, 20]。E2可调控actin的聚合和cofilin的磷酸化,而cofilin通过Ser-3的磷酸化在调控actin细胞骨架聚合调节因子中起着重要作用[21]。有研究发现在分离培养的少突胶质细胞中,E2可通过ERβ激动剂引起cofilin的快速磷酸化作用[22],但在海马组织内是否具有同样的作用尚不清楚。基于ERβ特异性抑制剂PHTPP和激动剂DPN可以改变其活性[9, 23],卵巢切除降低雌激素水平后,本研究结果显示,海马Rictor、p-Akt/Akt、Profilin-1、p-cofilin/cofilin的表达显著下降,表明上述蛋白分子的表达受到E2的调节。本实验进一步发现ERβ活性激动剂可以逆转其表达,而ERβ活性抑制剂可以模拟OVX对Rictor、p-Akt/Akt、Profilin-1和p-cofilin/cofilin的效应,即导致上述蛋白分子的显著下降。本研究结果表明,ERβ介导了E2对海马Rictor、p-Akt/Akt和actin聚合调节蛋白Profilin-1、p-cofilin/cofilin的调节。这一发现为深入探讨E2对actin细胞骨架聚合多聚化的调控途径提供了新的思路。
文献[24]表明,E2的基因转录调节需要其核受体及类固醇受体辅助活化因子-1(SRC-1) 的参与。已有报道在大鼠和小鼠的海马区域有高水平的SRC-1表达,而通过性腺切除术、雄激素替代、LET等方式发现ERβ和SRC-1有着紧密的联系[25]。另有研究表明,SRC-1介导了LET对actin细胞骨架聚合调节蛋白Profilin-1和cofilin的调控[26],但SRC-1是否参与了ERβ对actin聚合调节蛋白的调控仍不清楚。本研究利用免疫组化和Western blot检测发现PHTPP以时间依赖性方式下调SRC-1的表达;还发现卵巢切除可降低海马SRC-1的表达,而给予DPN处理后可逆转上述现象。上述结果提示SRC-1可能参与了ERβ对actin细胞骨架聚合调节蛋白的调控。
综上所述,本研究探讨了ERβ在生后两性小鼠海马中的表达变化趋势及ERβ活性改变对actin细胞骨架聚合调节蛋白表达的影响,结果表明ERβ在成年小鼠海马中广泛表达以及ERβ可调控actin细胞骨架聚合调节蛋白的表达,且上述调控可能是通过SRC-1/Rictor/p-Aktser473/actin通路来实现的。这些结果为更好地理解E2调控海马学习记忆和认知的机制提供了理论依据。雌激素还有两种受体 (ERα和GPR30),它们是否也能介导E2对actin细胞骨架聚合的调控及其与ERβ调控作用之间的关系还需要进一步探讨。
| [1] | Pereira L M, Bastos C P, de Souza J M, et al. Estradiol enhances object recognition memory in Swiss female mice by activating hippocampal estrogen receptor α[J]. Neurobiol Learn Mem, 2014, 114: 1–9. DOI:10.1016/j.nlm.2014.04.001 |
| [2] | Woolley C S, McEwen B S. Roles of estradiol and progesterone in regulation of hippocampal dendritic spine density during the estrous cycle in the rat[J]. J Comp Neurol, 1993, 336(2): 293–306. DOI:10.1002/cne.903360210 |
| [3] | Woolley C S, Gould E, Frankfurt M, et al. Naturally occurring fluctuation in dendritic spine density on adult hippocampal pyramidal neurons[J]. J Neurosci, 1990, 10(12): 4035–4039. DOI:10.1016/0006-8993(90)90778-a |
| [4] | Vierk R, Glassmeier G, Zhou L, et al. Aromatase inhibition abolishes LTP generation in female but not in male mice[J]. J Neurosci, 2012, 32(24): 8116–8126. DOI:10.1523/JNEUROSCI.5319-11.2012 |
| [5] | Prange-Kiel J, Fester L, Zhou L, et al. Inhibition of hippocampal estrogen synthesis causes region-specific downregulation of synaptic protein expression in hippocampal neurons[J]. Hippocampus, 2006, 16(5): 464–471. DOI:10.1002/hipo.20173 |
| [6] | Bernardino R L, Alves M G, Silva J, et al. Expression of Estrogen Receptors Alpha (ER-α), Beta (ER-β), and G Protein-Coupled Receptor 30 (GPR30) in Testicular Tissue of Men with Klinefelter Syndrome[J]. Horm Metab Res, 2016, 48(6): 413–415. DOI:10.1055/s-0042-105151 |
| [7] | Mosselman S, Polman J, Dijkema R. ER beta: identification and characterization of a novel human estrogen receptor[J]. FEBS Lett, 1996, 392(1): 49–53. DOI:10.1016/0014-5793(96)00782-x |
| [8] | Zhang J Q, Cai W Q, Zhou D S, et al. Distribution and differences of estrogen receptor beta immunoreactivity in the brain of adult male and female rats[J]. Brain Res, 2002, 935(1/2): 73–80. DOI:10.1016/s0006-8993(02)02460-5 |
| [9] | Liu F, Day M, Muñiz LC, et al. Activation of estrogen receptor-beta regulates hippocampal synaptic plasticity and improves memory[J]. Nat Neurosci, 2008, 11(3): 334–343. DOI:10.1038/nn2057 |
| [10] | Fukazawa Y, Saitoh Y, Ozawa F, et al. Hippocampal LTP is accompanied by enhanced F-actin content within the dendritic spine that is essential for late LTP maintenance in vivo[J]. Neuron, 2003, 38(3): 447–460. DOI:10.1016/s0896-6273(03)00206-x |
| [11] | Pollard T D, Borisy G G. Cellular motility driven by assembly and disassembly of actin filaments[J]. Cell, 2003, 112(4): 453–465. DOI:10.1016/s0092-8674(03)00120-x |
| [12] | Kusch A, Schmidt M, Gürgen D, et al. 17-Estradiol regulates mTORC2 sensitivity to rapamycin in adaptive cardiac remodeling[J]. PLoS One, 2015, 10(4): e0123385. DOI:10.1371/journal.pone.0123385 |
| [13] | Kramár E A, Chen L Y, Brandon N J, et al. Cytoskeletal changes underlie estrogen's acute effects on synaptic transmission and plasticity[J]. J Neurosci, 2009, 29(41): 12982–12993. DOI:10.1523/JNEUROSCI.3059-09.2009 |
| [14] | Haas E, Meyer M, Schurr U, et al. Differential effects of 17beta-estradiol on function and expression of estrogen receptor alpha, estrogen receptor beta, and GPR30 in arteries and veins of patients with atherosclerosis[J]. Hypertension, 2007, 49(6): 1358–1363. DOI:10.1161/HYPERTENSIONAHA.107.089995 |
| [15] | Fan X, Warner M, Gustafsson J A. Estrogen receptor beta expression in the embryonic brain regulates development of calretinin-immunoreactive GABAergic interneurons[J]. Proc Natl Acad Sci U S A, 2006, 103(51): 19338–19343. DOI:10.1073/pnas.0609663103 |
| [16] | Ivanova T, Beyer C. Ontogenetic expression and sex diffe-rences of aromatase and estrogen receptor-alpha/beta mRNA in the mouse hippocampus[J]. Cell Tissue Res, 2000, 300(2): 231–237. DOI:10.1007/s004410000199 |
| [17] | Zuloaga D G, Zuloaga K L, Hinds L R, et al. Estrogen receptor β expression in the mouse forebrain: age and sex differences[J]. J Comp Neurol, 2014, 522(2): 358–371. DOI:10.1002/cne.23400 |
| [18] | Zhou Q, Xiao M, Nicoll R A. Contribution of cytoskeleton to the internalization of AMPA receptors[J]. Proc Natl Acad Sci U S A, 2001, 98(3): 1261–1266. DOI:10.1073/pnas.031573798 |
| [19] | Yun S P, Ryu J M, Kim M O, et al. Rapid actions of plasma membrane estrogen receptors regulate motility of mouse embryonic stem cells through a profilin-1/cofilin-1-directed kinase signaling pathway[J]. Mol Endocrinol, 2012, 26(8): 1291–1303. DOI:10.1210/me.2012-1002 |
| [20] | Huang W, Zhu P J, Zhang S, et al. mTORC2 controls actin polymerization required for consolidation of long-term memory[J]. Nat Neurosci, 2013, 16(4): 441–448. DOI:10.1038/nn.3351 |
| [21] | Briz V, Baudry M. Estrogen Regulates Protein Synthesis and Actin Polymerization in Hippocampal Neurons through Different Molecular Mechanisms[J]. Front Endocrinol (Lausanne), 2014, 5: 22. DOI:10.3389/fendo.2014.00022 |
| [22] | Hirahara Y, Matsuda K I, Liu Y F, et al. 17β-Estradiol and 17α-estradiol induce rapid changes in cytoskeletal organization in cultured oligodendrocytes[J]. Neuroscience, 2013, 235: 187–199. DOI:10.1016/j.neuroscience.2012.12.070 |
| [23] | Grassi D, Lagunas N, Amorim M, et al. Role of oestrogen receptors on the modulation of NADPH-diaphorase-positive cell number in supraoptic and paraventricular nuclei of ovariectomised female rats[J]. J Neuroendocrinol, 2013, 25(3): 244–250. DOI:10.1111/j.1365-2826.2012.02387.x |
| [24] | Kamei Y, Xu L, Heinzel T, et al. A CBP integrator complex mediates transcriptional activation and AP-1 inhibition by nuclear receptors[J]. Cell, 1996, 85(3): 403–414. DOI:10.1016/s0092-8674(00)81118-6 |
| [25] | Bian C, Zhang D, Guo Q, et al. Localization and sex-difference of steroid receptor coactivator-1 immunoreactivities in the brain of adult female and male mice[J]. Steroids, 2011, 76(3): 269–279. DOI:10.1016/j.steroids.2010.11.009 |
| [26] | Zhao Y, Yu Y, Zhang Y, et al. Letrozole regulates actin cytoskeleton polymerization dynamics in a SRC-1 dependent manner in the hippocampus of mice[J]. J Steroid Biochem Mol Biol, 2017, 167: 86–97. DOI:10.1016/j.jsbmb.2016.11.013 |



