去甲肾上腺素 (norepinephrine,NE) 作为交感神经系统的神经递质作用于骨髓中的造血细胞[1], 对造血系统的调节从胚胎发育时就已经出现,它通过作用于骨髓造血干细胞 (hematopoietic stem cells, HSCs) 表面的肾上腺素能β2受体对其生长发育产生直接影响[2]。肾上腺素能受体通路在生理状态[1]或者粒细胞集落刺激因子对骨髓中HSCs动员到外周血的过程中起着关键作用[3-4]。另外,交感神经系统兴奋也促进了巨核细胞的黏附、迁移和血小板前体的形成[5]。许多研究表明,在受到生理或者病理刺激后,血小板数量增加、活性增强且血栓形成增多,这与机体在应激之后NE水平的上升密切相关[6-8]。有研究表明自发性高血压大鼠 (spontaneous hypertension rat, SHR) 神经纤维的分布密度和组织中NE的含量均高于对照组大鼠;与对照组大鼠相比,SHR肠隐窝细胞在受到电离辐射 (ionizing radiation,IR) 后发生更加快速的凋亡[9-10]。SHR交感神经兴奋释放大量神经递质NE,可以显著促进肠隐窝细胞的增殖更新,从而使肠道系统对IR损伤的敏感性增加。
骨髓是IR损伤的主要靶器官。骨髓组织中的HSCs是一群具有自我更新和多向分化能力的细胞。绝大多数HSCs处于骨髓中特定的微环境中,为了维持骨髓的持续造血功能,在不断分化生成各系造血祖细胞的同时,HSCs还通过自我更新来维持其自身数量的恒定。小鼠的HSCs常用表面标记分子是LinnegSca1+c-Kit+ (LSK)[10],正常情况下,骨髓组织中的大部分HSCs都处于静止状态,尤其是长期HSCs基本上处于休眠状态,因此对IR并不敏感,但处于增殖旺盛、更新活跃的各种造血细胞则对射线非常敏感,超过一定剂量的IR即可引起骨髓多系造血功能障碍[11],其中,血小板减少是主要表现之一,而血小板减少会引起恶性出血、感染等致命性后果[11]。血小板的生成主要经历HSCs、巨核系祖细胞、成熟巨核细胞、血小板释放等连续阶段[12];各阶段细胞与肠道隐窝细胞相似,不断进行更新、增殖、分化和成熟,且该过程受到交感神经系统的紧密调控。但是,交感神经兴奋释放NE增加是否影响IR损伤所致血小板减少尚不清楚。因此,研究NE对IR损伤引起血小板减少的影响作用具有重要意义。本研究就NE对IR损伤所致血小板减少过程中所产生的效应及其机制进行初步探讨,为进一步研究交感神经兴奋在肿瘤放化疗所致血小板减少所起的作用提供实验依据。
1 材料与方法 1.1 实验材料 1.1.1 主要试剂IL-3购自美国PeProtech公司;Stempro-34无血清完全培养基、血清购自美国Gibco公司;RPMI1640培养基购自美国HyClone公司;重组人粒-巨噬细胞集落刺激因子 (recombinant human granulocyte/macrophage colony-stimulating factor,rhGM-CSF) 和重组人血小板生成素 (recombinant human thrombopoietin,rhTPO) 分别购自北京北医联合药业有限公司和沈阳三生制药有限公司;标记Lineage、Sca1、c-Kit、CD41、CD42b的FITC、Percp-Cy5.5、PE-Cy7、APC、FITC五种抗体购自美国eBioscience公司、CD34+、Sca1+造血干祖细胞直接分选试剂盒由加拿大STEMCELL公司提供;AnnexinV-FITC细胞凋亡检测试剂盒以及细胞周期检测试剂盒购自江苏碧云天生物技术有限公司;重酒石酸去甲肾上腺素 (NE) 注射液购自武汉远大医药 (中国) 有限公司。
1.1.2 实验动物及来源健康雄性C57BL/6小鼠80只,8周龄,体质量18~22 g,购自北京华阜康生物科技股份有限公司,在标准培养条件下培养2周后用于实验。
1.1.3 MO7e细胞株本室从中国协和医科大学细胞库引进。
1.2 方法 1.2.1 实验动物的分组与处理按照完全随机方法将小鼠分为4组,分别为未辐射对照组 (PBS)、辐射对照组 (PBS+IR)、未辐射给药组 (NE)、辐射给药组 (NE+IR)。NE采用腹腔注射方式, 给药剂量为1.5 mg/kg, 分6次注射、每次间隔10 min,实验对照组采用同样的注射方式注射等体积PBS,并在给药后24 h给予6 Gy Co60 γ射线全身一次性辐照 (在第三军医大学辐照中心进行)。
1.2.2 血常规检测采取各处理组小鼠第0、1、7、10、14、17、20、24天的尾血10 μL, 与130 μL血液稀释液混匀,于Sysmex XT-2000i全自动血液分析仪上进行检测。
1.2.3 骨髓病理切片观察每组小鼠使用简单随机方法选取3只,于辐照后第9天颈椎脱臼处死,分离股骨和胫骨,并立即置于4%多聚甲醛液中固定。随后进行常规苏木精-伊红染色 (HE染色),并于倒置显微镜下选取相同位置的3个视野计数各组骨髓中巨核细胞数量。
1.2.4 小鼠Sca1+细胞培养及HSCs比例分析培养方法参考文献[3];取原代培养细胞以及新鲜分离的骨髓单个核细胞悬液,在100 μL的体系中分别加入FITC、Percp-Cy5.5、PE-Cy7标记的Lineage、Sca1、c-Kit 3种抗体 (50:1),室温孵育30 min后用流式细胞仪检测。
1.2.5 MO7e细胞培养以及流式细胞术检测细胞凋亡常规方法复苏MO7e细胞,采用RPMI1640培养基+10%胎牛血清+10 ng/mL rhGM-CSF,在5% CO2、100%湿度、37 ℃条件下进行培养,每2天换液传代1次。取对数生长期的MO7e细胞,以5×105/孔接种于24孔板中,用100 nmol/mL去甲肾上腺素处理,对照采用等量PBS处理,24 h后于6 Gy Co60 γ射线照射 (在第三军医大学辐照中心进行)。24 h后收集细胞,使用凋亡检测试剂盒处理样本,随后使用BD Accuri C6进行检测。
1.2.6 原代巨核细胞培养及流式细胞术检测其细胞周期使用CD34+细胞分选试剂盒分选获得纯度>90%的CD34+细胞,按4×104/mL接种于StemSpanTMSFEM培养基。加入rhTPO培养,诱导CD34+细胞分化扩增为巨核细胞。取第7、14天的原代巨核细胞,分别加入APC、FITC标记的CD41、CD42b,采用流式细胞术检测,然后分别取第7天CD41+巨核祖细胞、第14天CD41+/CD42b+晚期成熟的巨核细胞,以6×105/孔接种于24孔板中,用100 nmol/mL去甲肾上腺素处理,对照采用等体积PBS处理,24 h后收集细胞,使用细胞周期检测试剂盒处理样本,随后使用BD Accuri C6进行检测。
1.3 统计学分析采用SPSS 21.0统计软件。对所有数据进行正态性检验,根据正态性检验结果,对正态性分布资料进行完全随机资料方差分析或两独立样本t检验;对不服从正态分布经过转换呈正态分布再进行分析,多组比较时采用LSD进行两两比较。检验水准:α=0.05。
2 结果 2.1 NE促使电离辐射损伤后小鼠外周血血小板水平下降血常规检测结果显示,未给予辐射处理时,NE具有促进血小板生成作用并在给药后第7天左右达到峰值,与PBS组比较差异具有统计学意义 (P < 0.05);辐射处理后小鼠血小板迅速减少,在第7天达到最低水平,而辐射前给予NE处理组的小鼠,血小板在第7天后继续降低并在第10天达到最低值 (P < 0.05),而且与PBS+IR组相比,NE+IR组的血小板水平在7~25 d 恢复也更加缓慢 (P < 0.05, 图 1)。
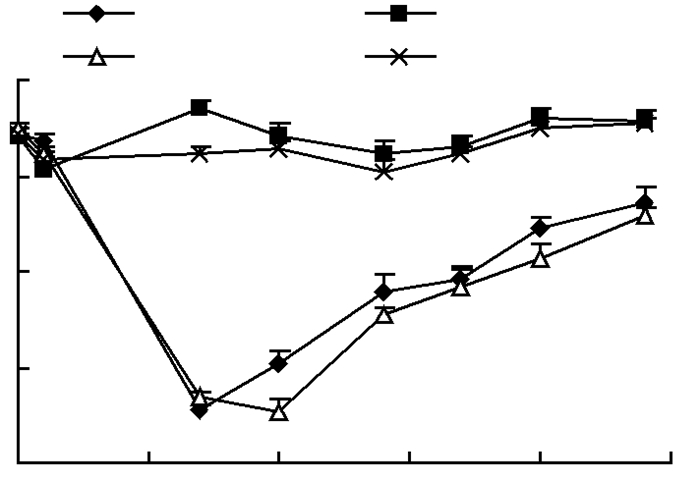
|
| a: P < 0.05, 与PBS组比较;b: P < 0.05, 与PBS+IR组比较 图 1 各组小鼠血小板变化情况 |
2.2 NE促使电离辐射损伤后小鼠骨髓巨核细胞减少
骨髓组织切片经HE染色后显示,与PBS组 (图 2A) 比较,NE组小鼠的骨髓中有核细胞和巨核细胞明显增加 (图 2B);与IR组 (图 2C) 相比较,辐照前给予NE处理,骨髓有核细胞明显减少,且出现大量空泡状结构、充血更加严重 (图 2D)。4组病理切片在倒置显微镜下巨核细胞计数 (×200):PBS组低于NE处理组 (35.43±6.32) vs (45.12±7.21),辐射给药组显著低于辐射对照组,差异具有统计学意义[(0.89±0.32) vs (2.46±0.84),P < 0.05], 提示NE能够使骨髓巨核细胞对电离辐射的敏感性增加。

|
| A: PBS组;B:NE组;C:PBS+IR组;D:NE+IR组 ↑:巨核细胞 图 2 各组小鼠骨髓组织病理学变化 (HE ×400) |
2.3 NE使电离辐射损伤后骨髓HSCs占骨髓Lin-细胞的比例下降
流式细胞术检测结果显示,NE具有促进小鼠原代培养的HSCs增殖作用,且在药物浓度100 nmol/mL以内具有剂量依赖关系,其中20、40、80、100 nmol/mL处理24 h后,与对照组相比,其增殖作用差异具有统计学意义 (P < 0.05,图 3A)。各组小鼠处理后的第9天,分离骨髓新鲜的有核细胞,流式细胞术检测结果显示:与PBS组相比较,NE具有促进小鼠HSCs的生成作用 (P < 0.05),与PBS+IR组比较,NE+IR组小鼠HSCs所占比例下降更为明显 (P < 0.05,图 3B)。提示NE通过促进HSCs的增殖使其对IR的敏感性增强。
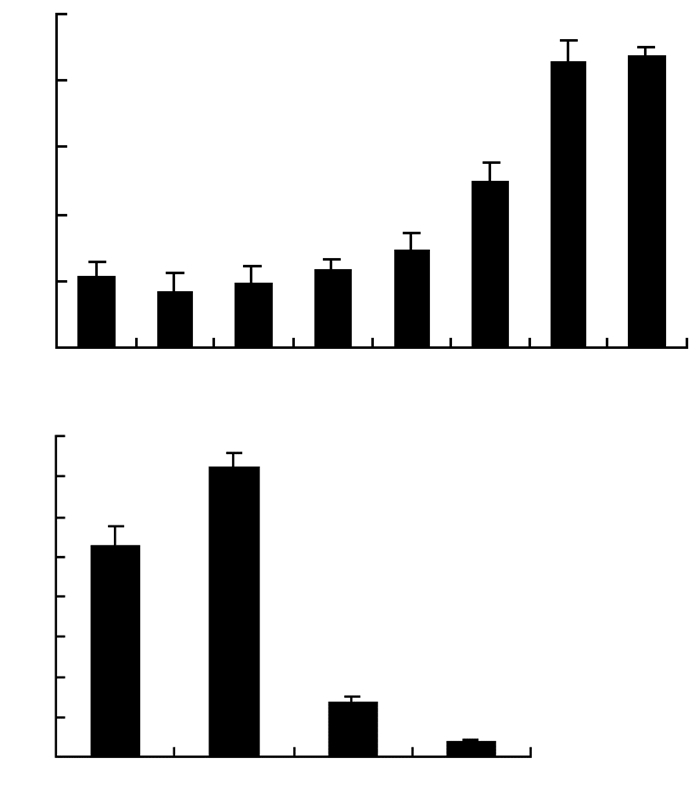
|
| a: P < 0.05, 与PBS比较;b: P < 0.05, 与PBS+IR组比较 A:不同药物浓度对原代培养HSCs的影响;B:各组小鼠分离的新鲜骨髓Lineage细胞中HSCs的比例 1:PBS组;2:NE组;3:PBS+IR组;4:NE+IR组 图 3 流式细胞术检测各组小鼠NE对HSCs的影响 |
2.4 NE促进MO7e细胞电离辐射损伤后凋亡
流式细胞术检测MO7e细胞凋亡结果显示,与PBS组比较 (图 4A),电离辐射能显著促使细胞凋亡 (图 4B),而且辐照前给予NE处理后凋亡率明显增加 (图 4C),差异具有统计学意义 (P < 0.01,图 4D)。提示NE能够增强MO7e对电离辐射的敏感性。

|
| A: PBS组;B:PBS+IR组;C:NE+IR组;D:统计学分析 1:PBS组;2:PBS+IR组;3:NE+IR组 a: P < 0.01, 与PBS组比较;b: P < 0.01, 与PBS+IR组比较 图 4 流式细胞术检测各组小鼠NE对MO7e细胞凋亡的影响 |
2.5 NE促进巨核祖细胞的增殖
100 nmol/mL NE处理巨核祖细胞后, G0/G1期细胞百分比为 (51.25±3.34)%,S期细胞百分比为 (37.77±4.32)%,而对照组G0/G1期细胞百分比为 (63.35±6.46)%,S期细胞百分比为 (28.99±4.37)%,两组比较差异分别具有统计学意义 (P < .05);而在晚期成熟巨核细胞中,NE对其DNA含量的影响与对照组比较差异没有统计学意义 (P > 0.05, 表 1)。提示了NE对巨核系祖细胞具有促增殖作用,但对晚期巨核细胞影响不大。
| 组别 | G0/G1期 | S期 | G2/M期 |
| 巨核组细胞 | |||
| 对照组 | 63.35±6.46 | 28.99±4.37 | 4.40±1.23 |
| NE组 | 51.25±3.34a | 37.77±4.32a | 5.94±1.46 |
| 成熟巨核细胞 | |||
| 对照组 | 78.45±8.54 | 13.94±2.62 | 6.69±1.21 |
| NE组 | 78.08±6.29 | 13.60±2.34 | 7.20±1.48 |
| a: P < 0.05,与对照组比较 | |||
3 讨论
本课题组前期研究发现NE能够促进巨核细胞的黏附、迁移以及血小板前体的形成,从而最终增加血小板的生成;该研究还发现辐照后给予小鼠NE能够促进血小板水平的恢复[5]。而在本研究中,辐照前给予NE处理后使小鼠对电离辐射的敏感性增强,导致血小板生成严重不足且恢复更加缓慢,且该过程与辐照前给予NE使HSCs以及巨核系祖细胞过度活跃密切相关。
本实验结果证实,NE对HSCs和巨核祖细胞有促增殖作用,尤其是HSCs的促增殖作用更加明显。正常时HSCs所占Lin-细胞的比例是很低的,分选培养4 d后的HSCs为10%左右,但在细胞因子IL-3和TPO培养4 d后,NE处理24 h增加到40%以上,显示了NE对处于增殖旺盛期HSCs有更强的增殖促进能力。在分析细胞周期来看,NE处理使巨核祖细胞S+G2/M的比例增加10%左右;而对晚期成熟巨核细胞没有促增殖作用,有研究表明,NE可以促进血小板前体的形成[5]最终生成血小板,而巨核细胞产生血小板是巨核细胞衰老、凋亡的表现。
通常长期HSCs与短期HSCs都处于静止状态,当它们在应激或者在组织更新时才进入细胞周期进行增殖分化[14],但短期HSCs的周期素依赖性激酶6(cyclin-dependent kinase 6, CDK6) 水平远远高于长期HSCs,它在应激条件下能快速进入细胞周期[15-16]。另外,有研究表明,Wnt通路的有效调节对维持HSCs的稳态至关重要,去乙酰化酶SIRT6通过作用于转录因子LEF1和使组蛋白H3上的赖氨酸去乙酰化从而抑制了Wnt靶向基因的转录,当SIRT6敲除后,Wnt通路被异常激活,导致HSCs增殖,但是该HSCs在一系列竞争性移植实验中,表现出自我更新能力严重受损。此外,基因表达谱和功能研究结果显示,HSCs的APC基因突变会导致Wnt水平增高,这也会导致HSCs细胞干性丢失[17-18]。在本研究中,我们推测,NE可能使HSCs和巨核系祖细胞的CDK6表达水平上升或者作用于Wnt信号通路改变了HSCs的稳态,从而刺激它们进行快速增殖分化,而处于增殖状态的细胞对外界刺激尤其是IR的敏感性增加,当受到IR时更容易发生DNA双链断裂而导致细胞凋亡或坏死[19-22],导致血小板的生成能力严重受损。
HSCs后代细胞,包括巨噬细胞和巨核细胞都能够调节HSCs稳态[23]。有研究表明,骨髓巨核细胞一方面通过分泌TGF-β1使HSCs保持休眠状态,另一方面通过分泌FGF1促进HSCs的扩增。在正常生理情况下,巨核细胞对HSCs的维持休眠作用占主导地位,因为条件性去除巨核细胞后骨髓组织中的HSCs数量会增多;而在骨髓受到病理性应激 (5-Fu或者IR) 情况下,巨核细胞的促HSCs扩增作用则占据主导地位,因为此时去除骨髓组织中的巨核细胞反而会使HSCs数量显著减少,造血功能损伤进一步加重[24]。因此,我们推测NE除了直接影响HSCs外,还可能使电离辐射后巨核细胞数量减低,反馈性地刺激HSCs进行不断增殖分化,导致枯竭,从而使电离辐射损伤更加严重。
许多研究表明,NE除了对HSCs的本身进行紧密调控外,对它的微环境也进行着非常重要的调控[25]。众所周知,交感神经系统通过释放神经递质NE作用于成骨细胞和破骨细胞表面肾上腺素能受体进行骨代谢调节,而骨内膜的成骨细胞对于HSCs的活化非常重要[26-28]。因此,在本研究中,NE也可能改变了骨代谢,进而影响了血小板的生成。
目前,大多数研究都是针对交感神经系统对HSCs移植方面产生的影响,如交感神经调节HSCs在血液循环中的生物节律性、促进HSCs增殖、对供体HSCs的动员以及对受体HSCs的归巢[2,4,25,29-35],没有相关研究针对交感神经系统对机体放化疗产生影响。本研究发现,NE作为交感神经纤维的递质在IR前给药使小鼠对IR更加敏感,为其他一些相关研究提供参考。本研究还有一些不足之处,如NE对HSCs稳态的调控及其动态变化、具体信号通路等有待阐明。
综上所述,本研究发现,NE可能使HSCs、巨核祖细胞的过度活跃,进而增加其对放射的敏感性,导致机体的血小板的生成受到严重影响,其具体机制可能与NE使CDK6水平、Wnt含量以及骨代谢变化等相关。认识NE对血小板生成的紧密调控对于提升放射损伤和与造血相关疾病的疗法是非常有意义的,值得进一步研究。
| [1] | Méndez-Ferrer S, Lucas D, Battista M, et al. Haematopoietic stem cell release is regulated by circadian oscillations[J]. Nature, 2008, 452(7186): 442–447. DOI:10.1038/nature06685 |
| [2] | Fitch S, Kimber G, Wilson N, et al. Signaling from the Sympathetic Nervous System Regulates Hematopoietic Stem Cell Emergence during Embryogenesis[J]. Cell Stem Cell, 2012, 11(4): 554–566. DOI:10.1016/j.stem.2012.07.002 |
| [3] | Katayama Y, Battista M, Kao W M, et al. Signals from the sympathetic nervous system regulate hematopoietic stem cell egress from bone marrow[J]. Cell, 2006, 124(2): 407–421. DOI:10.1016/j.cell.2005.10.041 |
| [4] | Lucas D, Bruns I, Battista M, et al. Norepinephrine reuptake inhibition promotes mobilization in mice:potential impact to rescue low stem cell yields[J]. Blood, 2012, 119(17): 3962–3965. DOI:10.1182/blood-2011-07-367102 |
| [5] | Chen S, Du C, Shen M, et al. Sympathetic stimulation facilitates thrombopoiesis by promoting megakaryocyte adhesion, migration, and proplatelet formation[J]. Blood, 2016, 127(8): 1024–1035. DOI:10.1182/blood-2015-07-660746 |
| [6] | Brydon L, Magid K, Steptoe A. Platelets, coronary heart disease, and stress[J]. Brain Behav Immun, 2006, 20(2): 113–119. DOI:10.1016/j.bbi.2005.08.002 |
| [7] | Tschuor C, Asmis L M, Lenzlinger P M, et al. In vitro norepinephrine significantly activates isolated platelets from healthy volunteers and critically ill patients following severe traumatic brain injury[J]. Crit Care, 2008, 12(3): R80. DOI:10.1186/cc6931 |
| [8] | Duchene J, von Hundelshausen P. Platelet-derived chemokines in atherosclerosis[J]. Hamostaseologie, 2015, 35(2): 137–141. DOI:10.5482/HAMO-14-11-0058 |
| [9] | Matsuu M, Shichijo K, Ikeda Y, et al. Sympathetic hyperfunction causes increased sensitivity of the autonomic nervous system to whole-body X irradiation[J]. Radiat Res, 2005, 163(2): 137–143. DOI:10.1667/rr3294 |
| [10] | Orkin S H, Zon L I. Hematopoiesis:an evolving paradigm for stem cell biology[J]. Cell, 2008, 132(4): 631–644. DOI:10.1016/j.cell.2008.01.025 |
| [11] | Dainiak N. Hematologic consequences of exposure to ionizing radiation[J]. Exp Hematol, 2002, 30(6): 513–528. DOI:10.1016/s0301-472x(02)00802-0 |
| [12] | Avanzi M P, Mitchell W B. Ex vivo production of platelets from stem cells[J]. Br J Haematol, 2014, 165(2): 237–247. DOI:10.1111/bjh.12764 |
| [13] |
陈石磊, 陈芳, 许杨, 等. 重组胰岛素样生长因子-Ⅰ促进辐射损伤小鼠血小板水平的恢复[J].
第三军医大学学报, 2011, 33(22): 2340–2344.
Chen S L, Chen F, Xu Y, et al. Recombinant human insulin-like growth factor-Ⅰpromotes recovery of platelet in mice after radiation injury[J]. J Third Mil Med Univ, 2011, 33(22): 2340–2344. |
| [14] | Szade K, Bukowska-Strakova K, Zukowska M, et al. Analysis of Cell Cycle Status of Murine Hematopoietic Stem Cells[J]. Methods Mol Biol, 2016, 1516: 91–99. DOI:10.1007/7651_2016_361 |
| [15] | Laurenti E, Frelin C, Xie S, et al. CDK6 levels regulate quiescence exit in human hematopoietic stem cells[J]. Cell Stem Cell, 2015, 16(3):302-313.DOI:10.1016/j.stem. 2015.01.017. |
| [16] | Scheicher R, Hoelbl-Kovacic A, Bellutti F, et al. CDK6 as a key regulator of hematopoietic and leukemic stem cell activation[J]. Blood, 2015, 125(1): 90–101. DOI:10.1182/blood-2014-06-584417 |
| [17] | Wang H, Diao D, Shi Z, et al. SIRT6 Controls Hematopoietic Stem Cell Homeostasis through Epigenetic Regulation of Wnt Signaling[J]. Cell Stem Cell, 2016, 18(4): 495–507. DOI:10.1016/j.stem.2016.03.005 |
| [18] | Famili F, Brugman M H, Taskesen E, et al. High Levels of Canonical Wnt Signaling Lead to Loss of Stemness and Increased Differentiation in Hematopoietic Stem Cells[J]. Stem Cell Reports, 2016, 6(5): 652–659. DOI:10.1016/j.stemcr.2016.04.009 |
| [19] | Muramoto G G, Chen B, Cui X, et al. Vascular endothelial cells produce soluble factors that mediate the recovery of human hematopoietic stem cells after radiation injury[J]. Biol Blood Marrow Transplant, 2006, 12(5): 530–540. DOI:10.1016/j.bbmt.2005.12.039 |
| [20] | Orford K W, Scadden D T. Deconstructing stem cell self-renewal:genetic insights into cell-cycle regulation[J]. Nat Rev Genet, 2008, 9(2): 115–128. DOI:10.1038/nrg2269 |
| [21] | Bonnet D. Cancer stem cells:lessons from leukaemia[J]. Cell Prolif, 2005, 38(6): 357–361. DOI:10.1111/j.1365-2184.2005.00353.x |
| [22] | Wilson A, Laurenti E, Oser G, et al. Hematopoietic stem cells reversibly switch from dormancy to self-renewal during homeostasis and repair[J]. Cell, 2008, 135(6): 1118–1129. DOI:10.1016/j.cell.2008.10.048 |
| [23] | Seshadri M, Qu C K. Microenvironmental regulation of hematopoietic stem cells and its implications in leukemogenesis[J]. Curr Opin Hematol, 2016, 23(4): 339–345. DOI:10.1097/MOH.0000000000000251 |
| [24] | Zhao M, Perry J M, Marshall H, et al. Megakaryocytes maintain homeostatic quiescence and promote post-injury regeneration of hematopoietic stem cells[J]. Nat Med, 2014, 20(11): 1321–1326. DOI:10.1038/nm.3706 |
| [25] | Hanoun M, Maryanovich M, Arnal-Estap A, et al. Neural regulation of hematopoiesis, inflammation, and cancer[J]. Neuron, 2015, 86(2): 360–373. DOI:10.1016/j.neuron.2015.01.026 |
| [26] | Togari A. Adrenergic regulation of bone metabolism:possible involvement of sympathetic innervation of osteoblastic and osteoclastic cells[J]. Microsc Res Tech, 2002, 58(2): 77–84. DOI:10.1002/jemt.10121 |
| [27] | Katayama Y. Bone and Stem Cells. Regulation of hematopoietic microenvironment by bone metabolism[J]. Clin Calcium, 2014, 24(4):547-554.DOI:CliCa1404547554. |
| [28] | Yujiri T, Tagami K, Tanimura A, et al. Alteration of adrenergic signals during peripheral blood stem cell mobilization induced by granulocyte colony-stimulating factor[J]. Leuk Res, 2008, 32(1): 195–197. DOI:10.1016/j.leukres.2007.03.020 |
| [29] | M ndez-Ferrer S, Chow A, Merad M, et al. Circadian rhythms influence hematopoietic stem cells[J]. Curr Opin Hematol, 2009, 16(4): 235–242. DOI:10.1097/MOH.0b013e32832bd0f5 |
| [30] | Giudice A, Caraglia M, Marra M, et al. Circadian rhythms, adrenergic hormones and trafficking of hematopoietic stem cells[J]. Expert Opin Ther Targets, 2010, 14(5): 567–575. DOI:10.1517/14728221003769887 |
| [31] | M ndez-Ferrer S, Battista M, Frenette PS. Cooperation of beta (2)-and beta (3)-adrenergic receptors in hematopoietic progenitor cell mobilization[J]. Ann N Y Acad Sci, 2010, 1192: 139–144. DOI:10.1111/j.1749-6632.2010.05390.x |
| [32] | Hopman R K, DiPersio J F. Advances in stem cell mobilization[J]. Blood Rev, 2014, 28(1): 31–40. DOI:10.1016/j.blre.2014.01.001 |
| [33] | Lucas D, Scheiermann C, Chow A, et al. Chemotherapy-induced bone marrow nerve injury impairs hematopoietic regeneration[J]. Nat Med, 2013, 19(6): 695–703. DOI:10.1038/nm.3155 |
| [34] | Sugiyama A, Yujiri T, Tanaka M, et al. Altered expression of circadian clock genes during peripheral blood stem cell mobilization induced by granulocyte colony-stimulating factor[J]. Chronobiol Int, 2015, 32(7): 934–941. DOI:10.3109/07420528.2015.1053910 |
| [35] | Madden K S. Sympathetic neural-immune interactions regulate hematopoiesis, thermoregulation and inflammation in mammals[J]. Dev Comp Immunol, 2017, 66: 92–97. DOI:10.1016/j.dci.2016.04.015 |



