2. 401120 重庆,重庆医科大学附属第三医院消化疾病中心
2. Digestive Disease Center, Third Affiliated Hospital of Chongqing Medical University, Chongqing, 401120, China
肝癌是全球常见的消化系统肿瘤,其发生的具体机制尚不清楚[1]。肝癌的治疗主要采用手术、化疗和分子靶向治疗等,但是其预后依旧较差[2]。肝癌的发病通常伴随着多种基因的突变,长非编码RNAs(lncRNAs)是一类具有超过200个核苷酸,不具有编码蛋白质的能力的RNA[3]。越来越多的证据已经表明:lncRNAs在多种癌症中扮演着重要的角色,涉及多基因调控网络,包括基因转录的RNA剪接和肿瘤转录修饰[4-5]。多种lncRNAs已经被证实在肝癌中扮演着重要的角色[6]。lncRNA CCAT2位于第8号染色体上,研究发现在乳腺癌、胃癌和结直肠癌等均存在异常表达,并参与肿瘤的发生、发展[7-10],但其具体机制还有待进一步明确。因此,本研究分析CCAT2在肝癌中的表达,通过干预CCAT2表达后研究其对肝癌细胞增殖、迁移、侵袭、细胞周期分布和凋亡的影响,以期探讨其作用机制,为肝癌的临床诊断和治疗提供新思路。
1 材料与方法 1.1 组织标本的采集选取我院2013年1-6月行根治性肝癌切除术的60例患者的肝癌组织(肝细胞癌18例,肝胆管癌42例)和癌旁组织(距离肿瘤组织边缘 > 5 cm),患者在术前均未接受手术、放疗、化疗和生物治疗等。手术切除30 min内液氮速冻标本,-80 ℃冰箱内保存。患者均有病理学确诊依据,其中男性41例,女性19例,年龄(52.8±8.5) 岁;其中伴有淋巴结转移的患者38例,不伴有淋巴结转移的患者22例。患者随访36个月,有完整的随访治疗资料。所有患者均签署知情同意书。
1.2 主要试剂DMEM细胞培养基(美国Hyclone公司),胎牛血清(以色列BI公司);Lipofectamine 2000(美国Invitrogen公司),总RNA提取试剂盒、RNA反转录试剂盒(日本TaKaRa公司);SybrGreen荧光试剂(美国ABI生物公司);引物的合成(中国全式金生物有限公司);CCK-8试剂盒(日本同仁化学研究所);Transwell小室(美国Chemicon公司),基质胶(美国BD公司)。
1.3 细胞培养与转染正常肝细胞L02和人源性肝癌细胞系HepG、H2P、SMMC和HLE细胞购买于美国菌种保藏中心(ATCC,美国)。用DMEM培养基加10%胎牛血清培养细胞,在37 ℃、5%CO2培养箱中培养,2~3 d传代1次,取对数生长期细胞进行实验。采用INTERFERin转染试剂并按试剂说明书进行lncRNA CCAT2干扰序列(siRNA-CCAT2) 及阴性对照序列(siRNA-NC)的转染。CCAT2干扰序列为5′-UUAACCUCUUCCUAUCUCATT-3′(正义链)和5′-UGAGAUAGGAAGAGGUUAA-TT-3′ (反义链)。CCAT2阴性对照序列为5′-UUCUCCGAACGUGUCACGUTT-3′(正义链);5′-ACGUGACACGUUCGGAGAATT-3′(反义链)。细胞转染采用Lipofectamine 2000进行转染,转染前1 d,分细胞至6孔板,每孔细胞数为1×106/孔,每孔中加入不加抗生素的培养基1.5 mL,使转染时的细胞密度为30% ~50%。具体操作按照说明书进行。
1.4 qRT-PCR检测肝癌组织中CCAT2的表达采用TRIzol提取肝癌组织和细胞中的总RNA,使用分光光度仪计量RNA水平;以GAPDH为内参,测量260 nm和280 nm波长下光密度值。qRT-PCR按照SYBR Green试剂盒说明书进行反应体系的配制,检测CCAT2在各组织和细胞中的表达。采用比较CT值法对获得的数据进行相对定量分析。其中CCAT2引物序列为5′-CCCTGGTCAAATTGCTTAACCT-3′ (正义链)和5′-TTATTCGTCCCTCTGTTTTATGGAT-3′ (反义链), 66 bp;GAPDH引物序列为5′-CCACATCGCTCAG-ACACCAT-3′ (正义链)和5′-ACCAGGCGCCCAATAC-G-3′(反义链), 452 bp。
1.5 CCK-8检测肝癌细胞增殖制备转染24 h后的SMMC和HLE细胞悬液,以2×106 /孔接种于96孔板,培养48 h后,各组终止反应弃去培养液,加人10 μL的CCK-8溶液,孵育10 min, 用酶标仪测定光密度值[D(405)]。实验过程中,空气气泡被严格避免。每个实验至少重复3次。
1.6 Transwell实验检测细胞迁移和侵袭SMMC和HLE细胞转染24 h后,以3×104/孔接种于24孔板Transwell中,每组设置3个复孔,并在上室加入200 μL DMEM培养基,下室加入600 μL DMEM培养基,在37 ℃细胞培养箱中培养48 h后取出上室,并吸取下室中培养液,加入结晶紫染色液100 μL/孔,染色10 min,PBS洗涤2遍,400倍显微镜下选取5个视野观察细胞并计算平均值。在侵袭实验中,小室以基质膜包被,后续步骤同迁移实验。
1.7 流式细胞仪分析细胞周期和凋亡率用不含EDTA的胰酶消化收集转染24 h后的SMMC和HLE细胞悬液,接种于6孔板,浓度为3×105 /孔,在4 ℃低速离心收集细胞(1 000 r/min,5 min),细胞颗粒再悬浮于1 mL PBS溶液,用冰冷的75%乙醇固定,于20 ℃储存2 d。流式细胞仪分析之前,细胞溶解离心后重悬于含50 μL/mL的PI和250 μL/mL RNase A染色缓冲液,将其混匀,在4 ℃避光条件反应30 min,采用流式细胞仪检测细胞周期和凋亡率。
1.8 Western blot检测P53、Bcl-2和Caspase-8蛋白表达收集转染24 h的SMMC和HLE细胞,PBS洗2次,裂解,离心,收集上清,即为细胞总蛋白,进行蛋白定量,调节每份样品蛋白浓度,在上样缓冲液加入等量蛋白,煮沸,在SDS聚丙烯酰胺凝胶中进行电泳,电转至PVDF膜,封闭液室温封闭3 h,分别P53、Bcl-2、Caspase-8和GAPDH一抗4 ℃过夜,HRP标记二抗,室温孵育2 h,ECL发光剂发光。图片经吸光度图像扫描仪扫描,采用AlphaEase FC软件对图片进行灰度值分析。结果以GAPDH作内参,采用相对于正常组蛋白表达量的倍数表示。
1.9 统计学分析实验数据以x±s表示,采用SPSS 21.0统计软件,两组间比较采用t检验,采取Kaplan-Meier方法绘制生存曲线,采用Log-rank检验分析两组生存差异。P < 0.05认为差异有统计学意义。
2 结果 2.1 LncRNA CCAT2在肝癌中的表达CCAT2在肝癌组织中的相对表达量明显高于癌旁组织,差异具有统计学意义(2.070±0.657 vs 0.543±0.657, t=15.972,P < 0.05);CCAT2在肝癌患者伴有淋巴结转移的肿瘤组织中的相对表达量明显高于不伴有淋巴结转移的肿瘤组织,差异具有统计学意义(2.234±0.734 vs 1.714±0.411, t=3.165,P < 0.05)。
2.2 LncRNA CCAT2表达与患者预后的关系及CCAT2在肝癌细胞系中表达CCAT2高表达的肝癌患者3年总生存率低于CCAT2低表达的肝癌患者,差异具有统计学意义(χ2=4.670,P < 0.05,图 1A)。与正常肝细胞L02比较,CCAT2在HepG、H2P、SMMC和HLE细胞的相对表达量升高,差异具有统计学意义(t=7.582、10.581、11.841、11.111,P < 0.05),其中SMMC和HLE细胞中的CCAT2相对表达量最高(图 1B)。
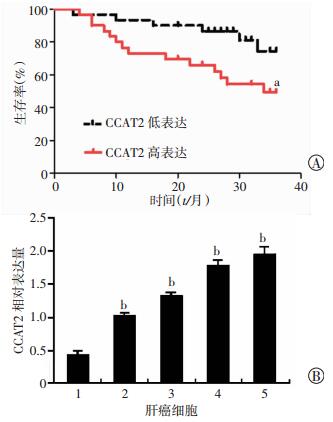
|
| 1: L02细胞;2:HepG2细胞;3:H2P细胞;4:SMMC细胞;5:HLE细胞; a: P < 0.05, 与CCAT 2低表达的患者比较;b: P < 0.05,与L02细胞比较 图 1 LncRNA CCAT2表达与患者预后的关系(A)及CCAT2在肝癌细胞系中表达(B) |
2.3 LncRNA CCAT2对肝癌细胞增殖的影响
转染siRNA-NC和siRNA-CCAT2 24 h后,SMMC和HLE细胞转染siRNA-CCAT2组中CCAT2的相对表达量(0.627±0.081、0.520±0.076) 均低于转染siRNA-NC组(1.775±0.159、1.943±0.206),差异具有统计学意义(t=11.116、11.260,P均 < 0.05)。这说明转染siRNA-CCAT2能够显著降低肝癌细胞中CCAT2的表达。干扰CCAT2表达后,SMMC和HLE细胞培养72、96 h,细胞的增殖数目低于转染siRNA-NC组,差异具有统计学意义(t=10.704、15.941、11.464、15.914,P均 < 0.05),同时其增殖速率也受到影响(图 2)。
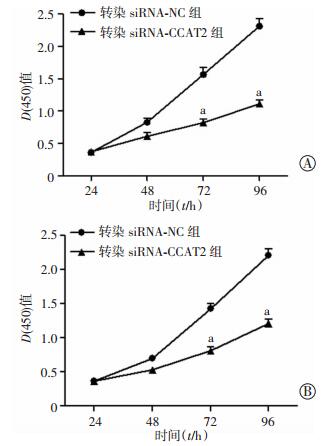
|
| a: P < 0.05,与对照组(转染siRNA-NC)比较 图 2 LncRNA CCAT2对SMMC(A)和HLE(B)细胞增殖的影响 |
2.4 LncRNA CCAT2对肝癌细胞迁移和侵袭的影响
Tanswell实验结果显示:SMMC和HLE细胞转染siRNA -CCAT2组的迁移和侵袭能力均低于转染siRNA-NC组,差异具有统计学意义(t=6.146、9.827、5.533、6.504,P均 < 0.05,图 3)。

|
| a: P < 0.05, 与对照组(转染siRNA-NC)比较 图 3 LncRNA CCAT2对肝癌细胞迁移(A)和侵袭(B)的影响 |
2.5 LncRNA CCAT2对肝癌细胞周期分布和凋亡率的影响
SMMC和HLE细胞转染siRNA-CCAT2组中G0/G1期比例明显升高,显著高于转染siRNA-NC组(t=9.340、12.909,P均 < 0.05);SMMC和HLE细胞转染siRNA-CCAT2组S期比例低于转染siRNA-NC组(t=17.589、12.070,P均 < 0.05),各细胞G2/M期比例无明显区别(t=0.166、0.171,P均 > 0.05)。SMMC和HLE细胞转染siRNA-CCAT2组的凋亡率均明显高于转染siRNA-NC组(t=12.481、16.536,P均 < 0.05,图 4)。表明干扰CCAT2表达能够通过阻滞SMMC和HLE细胞停于G1期比例增高,减少S期细胞比例,从而诱导细胞凋亡。
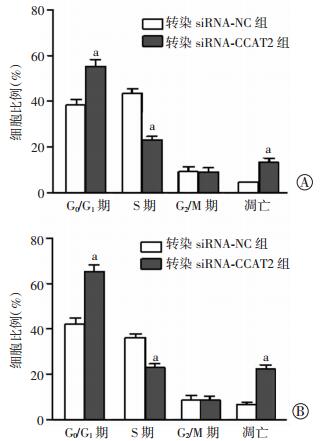
|
| a: P < 0.05, 与对照组(转染siRNA-NC)比较 图 4 LncRNA CCAT2对SMMC(A)和HLE(B)细胞周期分布和凋亡率的影响 |
2.6 LncRNA CCAT2对肝癌细胞凋亡相关蛋白表达的影响
Western blot结果显示:SMMC和HLE细胞转染siRNA-CCAT2组中P53和Caspase-8蛋白的相对表达量均显著高于转染siRNA-NC组(t=13.536、11.143、15.447、16.991,P均 < 0.05);SMMC和HLE细胞转染siRNA-CCAT2组Bcl-2蛋白的相对表达量明显低于转染siRNA-NC组(t=11.853、11.660,P均 < 0.05,图 5)。
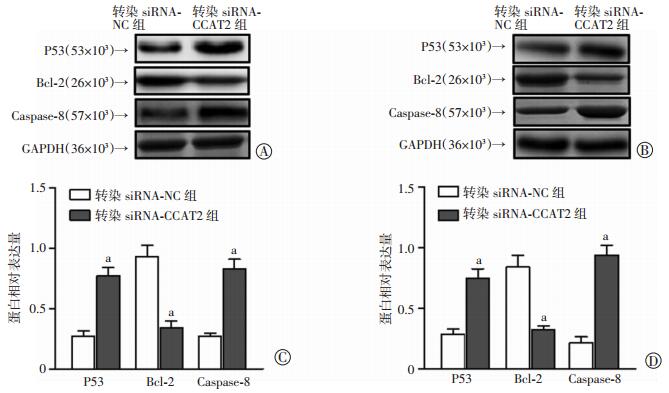
|
| A、B:分别为Western blot检测SMMC、HLE细胞凋亡相关蛋白的表达;C、D:分别为A、B的半定量分析 a: P < 0.05, 与对照组(转染siRNA-NC)比较 图 5 LncRNA CCAT2对SMMC和HLE细胞凋亡相关蛋白表达的影响 |
3 讨论
肝癌具有高侵袭性,细胞增殖快速和生存率低等特点[12]。目前在肝癌的治疗上尚缺乏有效手段,越来越多的研究集中于运用新的分子生物标志物进行早期阶段的诊断和治疗[13]。有证据已经表明:LncRNAs在多种癌症中扮演着重要的角色,涉及多基因调控网络,包括基因转录的RNA剪接和肿瘤转录修饰[4-5]。多种lncRNAs在肝癌的发生、发展中具有重要作用,其中包括lncRNA lncCAMTA1、lncRNA HULC、lncRNA DILC、lncRNA PVT1和lncRNA GPC3等[14-18]。最近有研究显示CCAT2在乳腺癌、胃癌、膀胱癌、卵巢癌和结直肠癌等中均存在异常表达,并与肿瘤的发生、发展密切相关;CCAT2作为一种肿瘤抑制基因,长期调控细胞周期相关基因的表达[7-10]。
本研究结果显示:CCAT2在肝癌患者肿瘤组织中的相对表达量明显高于癌旁组织,同时CCAT2在肝癌患者伴有淋巴结转移的肿瘤组织中的相对表达量明显高于不伴有淋巴结转移的肿瘤组织。进一步分析CCAT2对预后的影响,发现CCAT2高表达的肝癌患者3年生存率明显低于CCAT2低表达的肝癌患者。这说明CCAT2不仅在肝癌中存在高表达,还能显著影响肝癌的发生、发展。
本研究在细胞层面进一步验证CCAT2对肝癌发生、发展的影响,研究发现:与正常肝细胞L02比较,CCAT2在HepG、H2P、SMMC和HLE细胞的相对表达量显著升高,其中SMMC和HLE细胞中的CCAT2相对表达量最高。这说明CCAT2在多种肝癌细胞系中均存在高表达。SMMC和HLE细胞分别转染siRNA-NC和siRNA-CCAT2 24 h后,转染siRNA-CCAT2组中CCAT2的相对表达量均明显低于转染siRNA-NC组,表明转染siRNA-CCAT2能够显著降低肝癌细胞中CCAT2的表达。干扰SMMC和HLE细胞CCAT2表达后,SMMC和HLE细胞培养72、96 h,细胞的增殖数目显著低于空白干扰组,同时其增殖速率也受到影响,这说明在干扰肝癌细胞中CCAT2表达后其增殖受到影响。Tanswell实验结果显示:转染siRNA-CCAT2后,SMMC和HLE细胞的迁移和侵袭能力均明显低于转染siRNA-NC细胞的迁移和侵袭能力,表明CCAT2能明显影响肝癌细胞转移。
生命的平衡是由出生、生长、分化和死亡的细胞周期来维持的。多细胞生物中的细胞凋亡是消除有害或不必要的细胞的最有效的方法之一,可能与肿瘤的发生有关。细胞凋亡的启动主要有两个途径:细胞自杀后应激刺激的内在途径和受到来自其他细胞的信号的外在途径。本研究结果显示:转染siRNA-CCAT2后,SMMC和HLE细胞中G0/G1期比例明显高于转染siRNA-NC组,SMMC和HLE细胞S期比例明显低于转染siRNA-NC组,在G2/M期中各细胞比例无明显区别。干扰SMMC和HLE细胞CCAT2表达后,SMMC和HLE细胞的凋亡率均明显高于转染siRNA-NC组。该结果与其他研究在肿瘤细胞系观察的结果一致[19-20]。肿瘤细胞的重要特点是细胞凋亡受阻,而很多抗肿瘤药物就是通过促进肿瘤细胞凋亡而产生作用。细胞的增殖速度主要在于细胞周期长短,细胞周期长短主要在于G期,则细胞G期的停滞会使细胞周期增长而导致细胞出现凋亡。本研究结果表明:干扰CCAT2表达能够通过阻滞SMMC和HLE细胞停于G1期比例增高,减少S期细胞比例,从而诱导细胞凋亡。
Caspase-8作为Caspase家族成员中执行细胞凋亡的关键酶之一,是细胞凋亡的中枢效应器。多种刺激因素都可以激活Caspase-8,然后裂解多种蛋白,阻止DNA的复制和细胞修复,最终引起细胞凋亡,同时,Caspase-8活化程度也是判断细胞凋亡严重性的可靠指标之一。Bcl-2可以通过改变线粒体巯基的氧化还原状态、调节粒体膜对一些凋亡蛋白前体的通透性等机制抑制细胞凋亡。本研究Western blot结果显示:转染siRNA-CCAT2后,SMMC和HLE细胞中P53和Caspase-8蛋白的相对表达量均明显高于转染siRNA-NC组,SMMC和HLE细胞Bcl-2蛋白的相对表达量明显低于转染siRNA-NC组。这说明抑制CCAT2表达能够通过调控P53、Bcl-2、Caspase-8蛋白的表达,从而促进细胞凋亡。
综上所述,本研究初步探讨了干预CCAT2表达对肝癌细胞增殖、迁移、侵袭、细胞周期分布和凋亡的影响及其分子机制。研究结果表明CCAT2在肝癌中高表达,低表达的CCAT2能够抑制肝癌细胞增殖、迁移、侵袭以及促进肝癌细胞的凋亡,其机制可能与增加P53和Caspase-8蛋白的表达和降低Bcl-2蛋白的表达有关。这为将来CCAT2应用于肝癌的治疗提供了一定的理论基础。
| [1] | Negoi I, Runcanu A, Paun S, et al. Resection of large metachronous liver metastasis with gastric origin: case report and review of the literature[J]. Cureus, 2016, 8(10): e814. DOI:10.7759/cureus.814 |
| [2] | Bellon E, Gebauer F, Tachezy M, et al. Pancreatic cancer and liver metastases: state of the art[J]. Updates Surg, 2016, 68(3): 247–251. DOI:10.1007/s13304-016-0407-7 |
| [3] | Zhou N, Si Z, Li T, et al. Long non-coding RNA CCAT2 functions as an oncogene in hepatocellular carcinoma, regulating cellular proliferation, migration and apoptosis[J]. Oncol Lett, 2016, 12(1): 132–138. DOI:10.3892/ol.2016.4580 |
| [4] | Chen X, Liu L, Zhu W. Up-regulation of long non-coding RNA CCAT2 correlates with tumor metastasis and poor prognosis in cervical squamous cell cancer patients[J]. Int J Clin Exp Pathol, 2015, 8(10): 13261–13266. |
| [5] | Redis R S, Vela L E, Lu W, et al. Allele-specific reprogramming of cancer metabolism by the long non-coding RNA CCAT2[J]. Mol Cell, 2016, 61(4): 520–534. DOI:10.1016/j.molcel.2016.01.015 |
| [6] | Dickson I. Hepatocellular carcinoma: A role for lncRNA in liver cancer[J]. Nat Rev Gastroenterol Hepatol, 2016, 13(3): 122–123. DOI:10.1038/nrgastro.2016.21 |
| [7] | Li J, Zhuang C, Liu Y, et al. shRNA targeting long non-coding RNA CCAT2 controlled by tetracycline-inducible system inhibits progression of bladder cancer cells[J]. Oncotarget, 2016. DOI:10.18632/oncotarget.8259 |
| [8] | Kasagi Y, Oki E, Ando K, et al. The expression of CCAT2, a novel long noncoding RNA transcript, and rs6983267 single-nucleotide polymorphism genotypes in colorectal cancers[J]. Oncology, 2017, 92(1): 48–54. DOI:10.1159/000452143 |
| [9] | Chen S, Wu H, Lv N, et al. LncRNA CCAT2 predicts poor prognosis and regulates growth and metastasis in small cell lung cancer[J]. Biomedecine & pharmacotherapie, 2016, 82: 583–588. DOI:10.1016/j.biopha.2016.05.017 |
| [10] | Huang S, Qing C, Huang Z, et al. The long non-coding RNA CCAT2 is up-regulated in ovarian cancer and associated with poor prognosis[J]. Diagn Pathol, 2016, 11(1): 49. DOI:10.1186/s13000-016-0499-x |
| [11] | Weiskirchen R, Tacke F. Immune surveillance of liver cancer in non-alcoholic fatty liver disease: excess lipids cause CD4 T-cells loss and promote hepatocellular carcinoma development[J]. Hepatobiliary Surg Nutr, 2016, 5(5): 433–437. DOI:10.21037/hbsn.2016.09.10 |
| [12] | Li Y C, Zhao L, Wu J P, et al. Cytokine-induced killer cell infusion combined with conventional treatments produced better prognosis for hepatocellular carcinoma patients with barcelona clinic liver cancer B or earlier stage: A systematic review and meta-analysis[J]. Cytotherapy, 2016, 18(12): 1525–1531. DOI:10.1016/j.jcyt.2016.09.002 |
| [13] | Soldera J. Diagnostic and therapeutic approaches to hepatocellular carcinoma: understanding the barcelona Clinic liver cancer protocol[J]. Clin Med Insights Gastroenterol, 2016, 9: 67–71. DOI:10.4137/cgast.s30190 |
| [14] | Ding L J, Li Y, Wang S D, et al. Long noncoding RNA lncCAMTA1 promotes proliferation and cancer stem cell-like properties of liver cancer by inhibiting CAMTA1[J]. Int J Mol Sci, 2016, 17(10). DOI:10.3390/ijms17101617 |
| [15] | Li S P, Xu H X, Yu Y, et al. LncRNA HULC enhances epithelial-mesenchymal transition to promote tumorigenesis and metastasis of hepatocellular carcinoma via the miR-200a-3p/ZEB1 signaling pathway[J]. Oncotarget, 2016, 7(27): 42431–42446. DOI:10.18632/oncotarget.9883 |
| [16] | Wang X, Sun W, Shen W, et al. Long non-coding RNA DILC regulates liver cancer stem cells via IL-6/STAT3 axis[J]. J Hepatol, 2016, 64(6): 1283–1294. DOI:10.1016/j.jhep.2016.01.019 |
| [17] | Yu J, Han J, Zhang J, et al. The long noncoding RNAs PVT1 and uc002mbe.2 in sera provide a new supplementary method for hepatocellular carcinoma diagnosis[J]. Medicine (Baltimore), 2016, 95(31): e4436. DOI:10.1097/MD.0000000000004436 |
| [18] | Zhu X T, Yuan J H, Zhu T T, et al. Long noncoding RNA glypican 3 (GPC3) antisense transcript 1 promotes hepatocellular carcinoma progression via epigenetically activating GPC3[J]. FEBS J, 2016, 283(20): 3739–3754. DOI:10.1111/febs.13839 |
| [19] | Zhang X, Xu Y, He C, et al. Elevated expression of CCAT2 is associated with poor prognosis in esophageal squamous cell carcinoma[J]. J Surg Oncol, 2015, 111(7): 834–839. DOI:10.1002/jso.23888 |
| [20] | Zhang D, Cai Y, He J. Long noncoding RNA CCAT2 promotes breast tumor growth by regulating the Wnt signaling pathway[J]. Onco Targets Ther, 2015, 8: 2657–2664. DOI:10.2147/ott.s90485 |



