骨骼是人类最大的器官,骨骼的生长发育是一个复杂的过程。骨骼的生长主要分为膜内成骨与软骨内成骨。其中软骨内成骨是四肢长骨、躯干以及部分不规则短骨增长的主要方式。软骨内成骨的过程十分复杂[1-2],在胚胎发育、长骨生长等方面发挥重要的作用,软骨内成骨发生异常,会引起以生长延迟及干骺端结构异常为临床表现的多种疾病[3]。软骨内成骨的调控因素十分复杂,尚不完全清楚。很多证据表明成纤维细胞生长因子(fibroblast growth factor,FGF)信号通路在软骨内成骨中发挥重要的作用[4-7]。
成纤维细胞生长因子家族有22个成员,其中FGF2是表达最广泛的细胞因子。FGF通过与细胞膜上的成纤维细胞生长因子受体(fibroblast growth factor receptor,Fgfr)结合,产生相应的生物学效应。在人类软骨系统中,FGF主要与Fgfr1和Fgfr3两种受体结合,激活下游多种信号通路。人类及小鼠模型中FGF受体点突变能引起多种侏儒临床疾病和表型。在软骨细胞中,FGF信号通路能抑制细胞的增殖[7-9]。
近年来,长链非编码RNA(long non-coding RNA,LncRNA)在生物发育及疾病过程中的作用正被不断地揭示出来[10]。LncRNA拥有的一些特点赋予了它独特的调控功能,包括高度组织和时间特异性表达,参与生物发育及病理过程等[10-12]。Malat1是一个在哺乳动物中保守存在的LncRNA,研究显示Malat1在骨骼系统中发挥一定的作用,但它在软骨细胞中的作用尚不清楚,与在软骨发育过程中起重要作用的FGF信号通路有无联系也不清楚。
关于FGF信号通路所影响的下游蛋白分子已有很多研究,但在软骨系统中FGF信号通路是否通过影响非蛋白类分子,比如LncRNA,从而发挥其对软骨细胞的调控作用,目前尚不清楚。因此,本研究主要以小鼠原代软骨细胞、小鼠及人类软骨细胞系为模型,通过实时荧光定量PCR技术检测Malat1在小鼠及人类软骨细胞/细胞系中的表达;采用siRNA瞬时转染ATDC5细胞,比较转染后细胞增殖能力的变化;利用FGF2及下游通路抑制剂处理ATDC5细胞,或瞬时转染FGF受体,比较处理后Malat1的变化,利用FGF受体基因敲除小鼠来源的软骨细胞,检测Malat1的表达水平,探讨Malat1在软骨细胞中发挥的作用及其与FGF信号通路的关系。
1 材料与方法 1.1 材料 1.1.1 实验动物野生型C57小鼠、Fgfr3敲除小鼠以及Fgfr1软骨组织特异性可诱导敲除小鼠(Fgfr1 Col2CreERT)、β-catenin条件性敲除小鼠及PI3K条件性敲除小鼠均由本实验室保种,由第三军医大学大坪医院野战外科研究所实验动物中心培养。
1.1.2 细胞的来源与培养小鼠NIH3T3细胞、ATDC5细胞、C28I2细胞及SW1353细胞均由本实验室冻存。小鼠生长板原代软骨由C57小鼠幼仔分离而来。
1.1.3 主要试剂荧光定量PCR试剂盒、RT反转录试剂盒均订购自TaKaRa公司。DMEM/F12及DMEM/High Glucose培养基、青链霉素双抗、胎牛血清、DPBS缓冲液均购自HyClone公司。加药处理所用FGF2购自Peprotech公司。U0126试剂购自Sigma公司。转染所用RNAiMax siRNA转染试剂、Lipo3000 transfectamine以及RNA提取所用Trizol试剂盒购自Invitrogen公司。RT-PCR薄壁管及八连薄壁管购自eppendorf公司,其余试剂由本实验室自备。
1.2 方法 1.2.1 细胞系的培养NIH3T3细胞使用含10%的胎牛血清和1%的青链霉素双抗DMEM/High Glucose培养基;ATDC5与C28I2细胞使用含5%的胎牛血清和1%的青链霉素双抗DMEM/F12培养基;SW1353细胞使用含10%的胎牛血清和1%的青链霉素双抗DMEM/High Glucose培养基。细胞均在37 ℃、5%CO2饱和湿度的培养箱内常规培养。待处理完毕后收取RNA或行特定时间点细胞计数。
1.2.2 原代软骨细胞的分离与培养取出生后3 d的C57小鼠幼仔,75%乙醇浸泡处死后剪取下肢关节段,浸泡于加有0.25%TRIPSIN胰酶的EP管中,置于37 ℃培养箱内消化20 min后取出,在解剖显微镜下将剪取的关节段中的结缔组织及长骨残端彻底去除,然后将分离出的生长板原代软骨置于加有0.01%Ⅱ型胶原酶的EP管中,将EP管放入37 ℃培养箱内消化,使原代软骨细胞从软骨基质中游离出来,消化12~16 h后加入等量血清停止消化,离心(800 r/min,5 min)并接种至12孔板中。原代软骨细胞使用含10%的胎牛血清和1%的青链霉素双抗DMEM/F12培养基,在37 ℃、5%CO2饱和湿度的培养箱内常规培养。
1.2.3 细胞总RNA的提取细胞处理完毕,达到收取时间后,显微镜下观察细胞状态,收集状态良好的细胞,DPBS清洗3次,严格按照TRIzol说明书进行RNA提取,样本置于-80 ℃保存。
1.2.4 RNA的反转录将RNA提取得到的样本在NanoDrop分光光度计上测定浓度后,取含有1 μg RNA的样本,按TaKaRa说明书加入试剂盒内各项反转录试剂,按说明书所示流程反转录成cDNA,置于-20 ℃待用。
1.2.5 qPCR测定目标基因的表达取10 μL SYBRⅡ,0.2 μL ROX,0.5 μL正向引物,0.5 μL反向引物,7.8 μL ddH2O,以及1 μL样本,严格按照TaKaRa荧光定量PCR试剂盒说明书依次加入八连管内,在Mx3000P、StrataGene、Agilent、qPCR、Real-time PCR System进行qPCR反应。不同目的基因的引物序列:内参基因Cyclophilin A正向引物为5′-CGAGCTCTGAGCACTGGAGA-3′,反向引物为5′-TGGCGTGTAAAGTCACCACC-3′,产物长度为899 nt;Malat1(人鼠共用)正向引物为5′-CCTAACGACTAGCATTGGCA-3′,反向引物为5′-GCACTCTTTCCTGGGCTATC-3′,产物长度为168 nt;Fgfr1正向引物为5′-CTGGTATCCTGTGCCTATC-3′,反向引物为5′-CAATCTGATCCCAAGACCAC-3′,产物长度为329 nt;Fgfr3正向引物为5′-CC-AGACAGATGGATGGACAGGAA-3′,反向引物为5′-GA-TGCCTCAACAATACTGGTAGCCC-3′,产物长度为320 nt。
1.2.6 细胞计数检测增殖在细胞用药物处理后特定时间点,吸净待检测细胞孔中的培养基,DPBS洗3次,加入0.25%TRIPSIN胰酶,37 ℃培养箱内消化2 min,离心得到细胞沉淀样本,用DPBS重悬,吸取10 μL样本加至细胞计数板上,显微镜下进行细胞计数并记录。未处理组记为NC组,经si-Malat1 50 nmol/L处理组记为si-Malat1组,分为24、36、46和60 h等4组(n=3)。
1.2.7 siRNA的合成所用的siRNA-Malat1及siRNA-Fgfr1由广州锐博生物技术有限公司设计并合成。同时购入一个干扰无效片段的阴性对照siRNA。设计合成后的3条siRNA-Malat1及3条siRNA-Fgfr1进行了预实验,选出在ATDC5细胞中效果最好的1条进行正式实验。正式实验所用的siRNA-Malat1靶序列为:5′-GTGAATGAGTGATAAGTAA-3′。siRNA-Fgfr1靶序列为:5′-GCTCTGTCATCATCTATAA-3′。
1.2.8 pcDNA3.1-Fgfr1质粒的构建Fgfr1质粒连接在pcDNA3.1载体上,由实验室技术人员设计并构建。
1.2.9 细胞的转染细胞传代24 h后显微镜下观察,待细胞融合度达到40%~50%后将原有培养基吸出,加入新培养基。质粒的转染严格按照Lipo3000 transfectamine说明书流程进行,siRNA的转染严格按照RNAiMax transfect reagent说明书流程进行。转染后12 h更换培养基,24 h收取细胞提取RNA,或在特定时间点进行细胞计数实验。
1.2.10 细胞的加药处理待用细胞培养至60%融合度时,将原有的培养基更换为无血清,含双抗的F12培养基,饥饿处理12 h后,加入相应药物(FGF2或U0126)。FGF2的使用剂量为10~30 ng/mL,具体剂量在图注中标明。U0126的剂量为10 nmol/mL。以未做任何处理的样本作为空白对照组。
1.3 统计学分析计量数据以x±s表示,采用SPSS 13.0统计软件进行多因素方差分析,两两比较采用独立样本t检验。
2 结果 2.1 Malat1在小鼠多种细胞中高丰度表达小鼠成纤维细胞系NIH3T3、新生幼鼠原代软骨、小鼠软骨前体细胞系ATDC5、人正常软骨细胞系C28I2以及人骨肉瘤细胞系SW1353均在传代后48 h收取,小鼠原代细胞于分离接种后72 h收取。以NIH3T3细胞中Malat1的表达水平作为参照,结果表明,Malat1在小鼠原代软骨细胞、小鼠软骨前体细胞系ATDC5、人正常软骨细胞系C28I2以及人骨肉瘤细胞系SW1353中均呈高丰度表达。以SW1353细胞中的表达丰度最高,其余几种细胞中Malat1的表达丰度与NIH3T3中Malat1的表达丰度基本相等(图 1)。
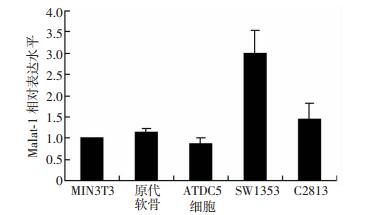
|
| 图 1 qPCR检测Malat1在多种软骨来源细胞中的表达(n=3,x±s) |
2.2 Malat1干扰使ATDC5细胞增殖减慢
首先设计了针对Malat1的siRNA,通过干扰Malat1在细胞中的表达,探究其可能的生物学功能。通过荧光指示剂确认siRNA在多种软骨细胞系中的转染效率,发现其在ATDC5细胞中的转染效率较好(图 2A),而在其他软骨细胞系中的转染效率不佳。因此进一步的转染实验采用ATDC5细胞。之后利用qPCR检测了si-Malat1在ATDC5细胞中的干扰效率,发现Malat1的表达受到有效地干扰(图 2B,P < 0.05)。在siRNA转染ATDC5细胞后,分别于24、36、48、60 h进行了细胞计数,结果表明Malat1被干扰后,ATDC5细胞的增殖速度减慢(图 2C,P < 0.05),提示Malat1可能起到促进ATDC5细胞增殖的作用。
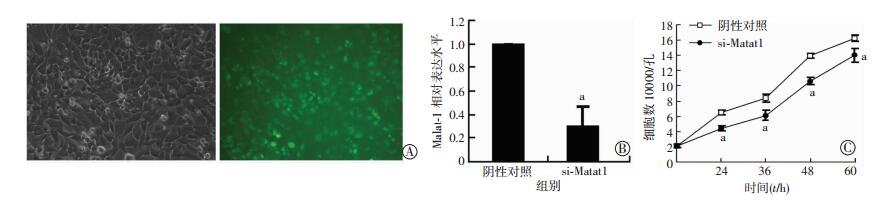
|
| A:si-Malat1转染效率(×200) 左:普通视野;右:荧光视野;B:si-Malat1转染效率检测(n=3,x±s) a:P < 0.05,与阴性对照比较;C:si-Malat1处理ATDC5细胞后不同时间点细胞计数(n=3,x±s) a:P < 0.05,与阴性对照比较 图 2 Malat-1被干扰使ATDC5细胞增殖减慢 |
2.3 FGF2通过激活下游ERK通路抑制细胞中Malat1的表达
用FGF2处理出生后4 d的小鼠幼仔原代软骨细胞以及ATDC5细胞。Malat1的表达水平,结果表明在FGF2处理24 h后,不论是在小鼠ATDC5细胞,还是在原代软骨细胞中,Malat1的表达水平均以非剂量依赖的方式出现明显的下调(图 3A,左为ATDC5细胞,右为原代软骨细胞),同时在FGF2处理后24 h和36 h收集细胞,发现在FGF2在这两个时间点对Malat1均有抑制作用(图 3B)。
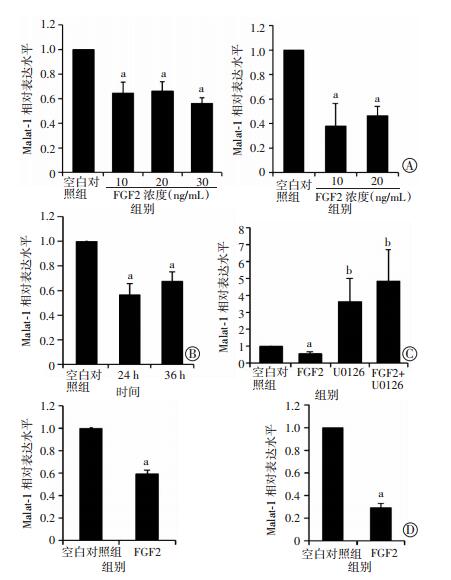
|
| a:P < 0.05,b:P < 0.01,与空白对照组比较 A:不同浓度FGF2处理小鼠ATDC5细胞(左)和原代软骨细胞(右)Malat1的表达(n=3,x±s);B:FGF2处理不同时间原代软骨细胞Malat1的表达(n=3,x±s);C:U0126处理ATDC5细胞Malat1的表达(n=4,x±s);D:FGF2处理人源性软骨细胞系C28I2(左)和SW1353(右)Malat1的表达(n=3,x±s) 图 3 qPCR检测FGF2对细胞中Malat1表达的影响 |
利用本室的β-catenin及PI3K条件性敲除小鼠原代软骨细胞检测Malat1的表达,结果显示在这些小鼠的原代软骨细胞中Malat1的表达水平没有明显的变化(数据未显示)。进一步利用ERK通路抑制剂U0126处理ATDC5细胞。处理24 h后收取细胞,qPCR检测Malat1的表达水平。结果表明U0126处理显著提升了Malat1的表达,且FGF2与U0126共同处理细胞时,FGF2不能抑制Malat1的表达水平(图 3C)。提示FGF2对Malat1的抑制可能是通过FGF受体激活下游ERK通路完成的。不仅如此,同时使用U0126及FGF2处理ATDC5细胞后,Malat1的表达水平相比于U0126组,无统计学上显著的差异。我们推测这可能不仅提示在小鼠软骨细胞中,ERK通路对Malat1可能有很强的抑制作用,而且提示FGF2可能主要通过ERK通路抑制了Malat1的表达,因此当ERK通路被阻断以后,FGF2对Malat1的表达完全失去了抑制作用。
FGF2处理人类正常软骨细胞系C28I2细胞以及人骨肉瘤细胞系SW1353细胞24 h后,Malat1的表达水平出现了明显的下降(图 3D)。提示FGF2能够抑制小鼠软骨细胞中Malat1的表达。
2.4 FGF2通过Fgfr1影响Malat1的表达首先分离Fgfr3敲除小鼠幼仔以及Fgfr1 Col2Cre-ERT小鼠幼仔的原代软骨,经FGF2处理后,qPCR检测Fgfr3敲除或Fgfr1条件性敲除软骨细胞中Malat1的表达。qPCR确认了Fgfr3敲除小鼠原代软骨细胞中Fgfr3的敲除效率(图 4A),之后检测Fgfr3敲除(R3 KO组)的小鼠幼仔原代软骨中Malat1的表达水平,结果表明其Malat1的表达与野生型组(WT组)相比没有明显变化;此外,Fgfr3敲除的小鼠幼仔原代软骨经FGF2处理后,Malat1的表达仍然是下调的(图 4B);Fgfr1 Col2CreERT小鼠原代软骨细胞加Tamoxifen处理后,结果表明Fgfr1被成功地敲除(图 4C),而Malat1的表达增高,并且在条件性敲除Fgfr1(R1 cKO组)的小鼠原代软骨中,与不加Tamoxifen的对照组(C组)相比,FGF2处理不能再抑制Malat1的表达(图 4D)。值得注意的是与不经FGF2处理的对照组相比,条件性敲除Fgfr1的小鼠幼仔原代软骨经FGF2处理后,Malat1的表达是升高的,但与不经FGF2处理的R1 cKO组相比,Malat1的表达仍有所降低。这种现象可能是因为Fgfr1 CreERT的敲除效率无法达到100%,在Fgfr1被诱导性敲除后细胞仍然有少量的FGFR1蛋白发挥作用,从而FGF2处理仍然可以部分抑制Malat1的表达,但无法将其抑制到对照组水平以下。
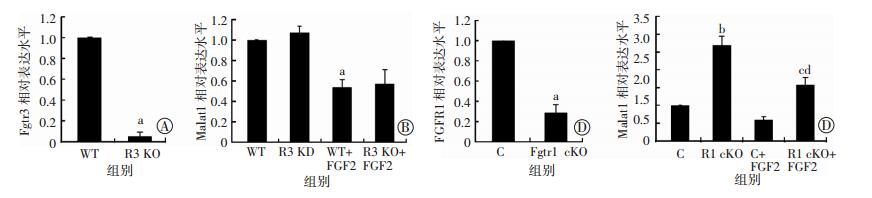
|
| A:Fgfr3敲除效率验证(n=3,x±s) a:P < 0.01,与WT组比较;B:FGF2处理Fgfr3 KO原代软骨细胞Malat1的表达(n=3,x±s) a:P < 0.05,与WT组比较;b:P < 0.05,与R3 KO组比较;C:Fgfr1的敲除效率验证(n=3,x±s) a:P < 0.01,与C组比较;D:FGF2处理Fgfr1诱导敲除的原代软骨细胞Malat1的表达(n=3,x±s) a:P < 0.05,b:P < 0.01,与C组比较;c:P < 0.05,与R1 cKO组比较;d:P < 0.05,与C+FGF2组比较 图 4 qPCR检测FGF2对Fgfr3敲除或Fgfr1条件性敲除软骨细胞中Malat1表达的影响 |
为进一步验证Fgfr1对Malat1的影响,设计了针对Fgfr1的siRNA,将si-Fgfr1转染至ATDC5细胞中,利用qPCR检测Malat1的表达变化,确定si-Fgfr1的干扰效率(图 5A),发现Fgfr1被干扰后Malat1表达水平增高,与FGF2处理的空白对照组(NC组)相比,Fgfr1被干扰后FGF2不能有效地抑制Malat1的表达(图 5B)。这与之前的实验结果趋势是一致的。进一步制备了pcDNA3.1-Fgfr1质粒并确认其转染至ATDC5细胞中的表达(图 5C)。将Fgfr1质粒转染入ATDC5细胞中后采用qPCR检测Malat1的表达。结果表明Malat1的表达受到了抑制(图 5D)。值得注意的是转染Fgfr1同时用FGF2处理ATDC5细胞时,对Malat1的抑制效果和单一因素处理没有显著区别(图 5D)。这可能与Malat1在软骨细胞中表达水平很高,无法被完全抑制有关。进一步提示FGF2可能通过与FGFR1结合,激活下游ERK通路,从而抑制了Malat1的表达。
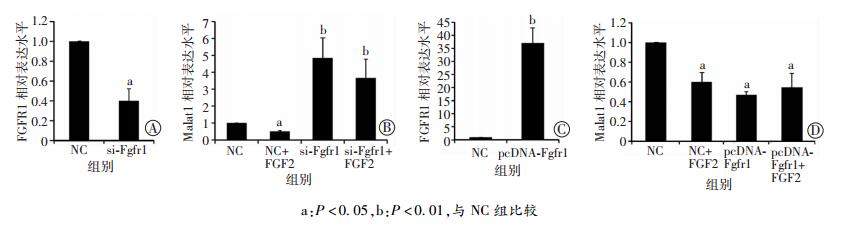
|
| A:转染si-Fgfr1干扰效率(n=5,x±s);B:转染si-Fgfr1干扰后Malat1的表达(n=5,x±s);C:转染pcDNA-Fgfr1质粒转染效率(n=3,x±s);D:转染pcDNA-Fgfr1质粒后Malat1的表达(n=3,x±s) 图 5 qPCR检测FGF2对ATDC5细胞转染si-Fgfr1和pcDNA-Fgfr1质粒后Malat1表达的影响 |
3 讨论
骨骼系统是人体最大的器官,在骨骼系统的形成与发育过程中软骨起着重要的作用,软骨内成骨是长骨增长的主要方式。在软骨中FGF信号通路对细胞的增殖起着重要作用[8]。关于FGF信号通路调控的基因,既往研究关注过传统的编码蛋白质的基因。而近年研究日益揭示出非编码RNA在生命过程中的重要性。非编码RNA有多种类型,其中长链非编码RNA是指长度超过200个碱基对的,不具有编码蛋白潜力的RNA。长链非编码RNA的数量十分巨大,在哺乳动物基因组中占到80%以上,已经发现LncRNA是基因表达的一类重要调控因子,已有较多研究探讨了它们的生理学和病理学功能。FGF信号通路是否调控了非编码RNA特别是长链非编码RNA的表达,发挥了何种生物学功能,目前尚不清楚。
Malat1是一个LncRNA,在人类中定位于11号染色体上,长度为6 815 nt。在小鼠中定位于19号染色体上,长度为6 981 nt。研究表明其在人类肿瘤组织、小鼠成纤维细胞中高丰度表达,Malat1不翻译成蛋白质,主要位于细胞核小斑(nuclear speckle)。核小斑是一个位于哺乳动物细胞核内的动态结构,在核小斑内蛋白质与RNA-蛋白质复合物发生频繁的相互作用,从而完成对细胞生物学行为的一系列调控。
2003年,在非小细胞肺癌中第一次筛选出Malat1[13]。之后较多研究揭示出Malat1在多种肿瘤及组织中广泛高丰度表达,并与肿瘤侵袭、细胞增殖等方面密切相关,可以充当肿瘤的标志物[14-17]。另有研究表明它在成骨细胞增殖、骨肉瘤增殖侵袭等方面具有促进作用[18-19]。同时它在神经系统中发挥重要的作用,参与神经突触的形成,Malat1被干扰后神经突触的形成数量减少[14, 20]。有研究表明RANKL通过诱导Malat1表达抑制了成骨细胞增殖[21]。到目前为止,对Malat1的研究主要集中在肿瘤领域,Malat1在肿瘤细胞中产生的作用已有比较明确的认识,但Malat1在正常生理组织中表达水平也很高,提示它在正常生理过程中也发挥重要作用。但它在人类软骨细胞,及小鼠软骨细胞中的表达水平尚不清楚,关于Malat1在软骨细胞中发挥的作用尚少见研究。
本研究首先测定了Malat1在多种软骨细胞系及原代软骨细胞中的基础表达水平,Malat1在这些细胞中均呈现高丰度表达,提示其可能参与调节软骨细胞的生物学功能。由于之前很多研究提示Malat1主要影响细胞的增殖,我们进一步研究了Malat1对软骨细胞/细胞系增殖的影响。Malat1是一个长达6 981 nt的基因,将其连接在质粒上进行过表达的效果不佳,本研究首先设计了针对Malat1的siRNA,利用小片段干扰RNA技术,发现在软骨细胞模型中,Malat1能促进细胞的增殖。这一结果提示Malat1很可能不仅仅是肿瘤细胞中一个重要的侵袭性调控因素,而且在正常软骨组织中也起到了调控细胞增殖的作用。FGF/FgfrS信号通路在软骨细胞的增殖方面起着重要作用。FGF2处理胚胎期软骨能显著抑制骨骼长度,目前认为FGF2能通过Fgfr3抑制软骨增殖,本实验室之前的工作也提示FGF2对软骨细胞的增殖存在抑制作用[22]。一些LncRNA受到细胞信号分子的调控,从而影响细胞的增殖状态,前期结果表明Malat1也能够影响ATDC5细胞的增殖,本研究进一步利用重组FGF2验证FGF信号通路是否对Malat1的表达有调控作用,结果提示不论是人源性软骨细胞还是小鼠源性的软骨细胞中,Malat1的表达均受到FGF信号通路的调控。
本研究利用基因编辑小鼠的原代软骨,ERK信号通路阻断剂处理的软骨细胞系,以及小片段干扰RNA技术进行综合检测分析,结果进一步证实了FGF信号对Malat1表达的抑制作用,同时还表明这种抑制作用是通过Ⅰ型Fgfr而不是Ⅲ型Fgfr完成的,FGF2与Fgfr1结合后,通过激活下游ERK通路,实现对Malat1的抑制,从而抑制了软骨细胞的增殖。有趣的是,以前有研究显示Malat1也能通过激活ERK/MAPK通路完成对肿瘤细胞增殖的影响。这提示Malat1与ERK/MAPK通路之间可能存在着相互作用。
研究显示,FGF信号通路会抑制软骨细胞的增殖,并且探明了造成这种抑制的几条FGF下游信号通路,但具体机制尚不完全清楚。本研究结果表明,FGF信号通路不仅影响了编码蛋白的基因,也能调控非编码蛋白的基因并完成生物学功能。本研究发现在软骨细胞中FGF信号通路通过Fgfr1,激活下游ERK通路,抑制了一种长链非编码RNA-Malat1的表达水平,通过这种调控作用,抑制了软骨细胞的增殖。并且,Malat1不仅仅影响着肿瘤细胞的增殖,也能影响正常软骨细胞增殖。不过,FGF信号下游多种信号通路均能对细胞的增殖产生影响,因此FGF-ERK-Malat1通路可能在其中只发挥一部分作用。由于Malat1是一个较长的片段,传统的质粒及慢病毒技术均无法将这样长的片段稳定转染到软骨细胞中,因此无法验证过表达Malat1能否回复由FGF2引起的胚胎期软骨生长延迟。因此在Malat1与FGF2的更多联系方面,尚有待进一步的研究。
鉴于Malat1在肿瘤及神经系统中的重要作用,有研究显示Malat1敲除后的小鼠能够正常存活,无明显表型[22-23]。这提示Malat1在生物发育过程中的作用是可以被替代的,也支持了Malat1在软骨细胞增殖过程中只部分参与,并不起决定性作用这一猜想。不过,由于之前的研究是针对神经系统、心肌系统进行的,因此Malat1敲除小鼠有无可诱导性的骨骼表型尚无详细探究,这方面还有待后续研究进行验证。但无论如何,就骨骼系统而言,Malat1本身可能并不能引起骨骼系统的异常发育,但本研究结果提示,它至少参与了骨骼系统,特别是软骨部分的正常发育状态的维持。总而言之,本研究初步探究了Malat1对软骨细胞增殖的作用,同时探究了在软骨细胞模型中FGF2对Malat1是否存在调控作用以及这种调控作用的机制,为进一步研究FGF2通过长链非编码RNA Malat1对软骨细胞增殖产生的影响打下基础。
| [1] | Long F, Ornitz D M. Development of the endochondral skeleton.[J]. Cold Spring Harbor Perspectives in Biology, 2013, 5(1): a008334. DOI:10.1101/cshperspect.a008334 |
| [2] | Su N, Jin M, Chen L. Role of FGF/Fgfr signaling in skeletal development and homeostasis: learning from mouse models[J]. Bone Research, 2014, 2(1): 9–32. DOI:10.1038/boneres.2014.3 |
| [3] | Horton W A, Hall J G, Hecht J T. Achondroplasia[J]. Lancet, 2007, 370(9582): 162–172. DOI:10.1016/S0140-6736(07)61090-3 |
| [4] | Naski M C, Ornitz D M. FGF signaling in skeletal development[J]. Front Biosci, 1998, 3: d781–d794. DOI:10.2741/a321 |
| [5] | Ornitz D M. FGF signaling in the developing endochondral skeleton[J]. Cytokine Growth Factor Rev, 2005, 16(2): 205–213. DOI:10.1016/j.cytogfr.2005.02.003 |
| [6] |
李晓刚, 苏楠, 唐玉彬, 等. FGF2对破骨细胞体外分化以及骨吸收功能的直接调控作用[J].
第三军医大学学报, 2014, 36(7): 636–639.
Li X G, Su N, Tang Y B, et al. Fibroblast growth factor 2 directly regulates osteoclast differentiation and bone resorption function[J]. J Third Mil Med Univ, 2014, 36(7): 636–639. DOI:10.16016/j.1000-5404.2014.07.003 |
| [7] |
谢杨丽. Fgfr3在骨骼发育、稳态维持中的作用与相关机制研究[D].第三军医大学, 2013.
Xie Y L.The role and mechanism of Fgfr3 in skeleton development and homostasis[D]. Third Military Medical University, 2013. |
| [8] | Karuppaiah K, Yu K, Lim J, et al. FGF signaling in the osteoprogenitor lineage non-autonomously regulates postnatal chondrocyte proliferation and skeletal growth[J]. Development, 2016, 143(10): 1811–1822. DOI:10.1242/dev.131722 |
| [9] | Ornitz D M, Marie P J. FGF signaling pathways in endochondral and intramembranous bone development and human genetic disease[J]. Genes Dev, 2002, 16(12): 1446–1465. DOI:10.1101/gad.990702 |
| [10] | Flynn R A, Chang H Y. Long noncoding RNAs in cell-fate programming and reprogramming[J]. Cell Stem Cell, 2014, 14(6): 752–761. DOI:10.1016/j.stem.2014.05.014 |
| [11] | Wang K C, Chang H Y. Molecular mechanisms of long noncoding RNAs[J]. Mol Cell, 2011, 43(6): 904–914. DOI:10.1016/j.molcel.2011.08.018 |
| [12] | Whitehead J, Pandey G K, Kanduri C. Regulation of the mammalian epigenome by long noncoding RNAs[J]. BiochimBiophys Acta, 2009, 1790(9): 936–947. DOI:10.1016/j.bbagen.2008.10.007 |
| [13] | Ji P, Diederichs S, Wang W, et al. MALAT-1, a novel noncoding RNA, and thymosin beta4 predict metastasis and survival in early-stage non-small cell lung cancer[J]. Oncogene, 2003, 22(39): 8031–8041. DOI:10.1038/sj.onc.1206928 |
| [14] | Gutschner T, Hammerle M, Diederichs S. MALAT1--a paradigm for long noncoding RNA function in cancer[J]. J Mol Med, 2013, 91(7): 791–801. DOI:10.1007/s00109-013-1028-y |
| [15] | Liu M, Sun W, Liu Y, et al. The role of lncRNA MALAT1 in bone metastasis in patients with non-small cell lung cancer[J]. Oncol Rep, 2016, 36(3): 1679–1685. DOI:10.3892/or.2016.4909 |
| [16] |
齐文川, 李骞, 吴传芳. 低表达长非编码RNA MALAT1对人宫颈癌HeLa细胞体外生长和迁移的影响[J].
四川大学学报(自然科学版), 2015, 52(4): 901–905.
Qi W C, Li Q, Wu C F. Lower expression lncRNA MALAT1 effect on the proliferation and migration of HeLa cells in vitro[J]. J Sichuan University(Nature Science Edition), 2015, 52(4): 901–905. |
| [17] |
宋铁峰, 袁颖, 王会琴, 等. 长链非编码RNA MALAT1的研究进展[J].
生物技术通报, 2016, 32(1): 20–28.
Song T F, Yuan Y, Wang H Q, et al. Research Progress on a Long Non-coding RNA MALAT1[J]. BIOTECHNOLOGY BULLETIN, 2016, 32(1): 20–28. DOI:10.13560/j.cnki.biotech.bull.1985.2016.01.005 |
| [18] | Fang D, Yang H, Lin J, et al. 17β-estradiol regulates cell proliferation, colony formation, migration invasion and promotes apoptosis by upregulating miR-9 and thus degrades MALAT-1 in osteosarcoma cell MG-63 in an estrogen receptor-independent manner[J]. Biochem Biophys Res Commun, 2015, 457(4): 500–506. DOI:10.1016/j.bbrc.2014.12.114 |
| [19] | Dong Y, Liang G, Yuan B, et al. MALAT1 promotes the proliferation and metastasis of osteosarcoma cells by activating the PI3K/Akt pathway[J]. Tumour Biol, 2015, 36(3): 1477–1486. DOI:10.1007/s13277-014-2631-4 |
| [20] | Jin M, Yu Y, Qi H, et al. A novel Fgfr3-binding peptide inhibits Fgfr3 signaling and reverses the lethal phenotype of mice mimicking human thanatophoric dysplasia[J]. Hum Mol Genet, 2012, 21(26): 5443–5455. DOI:10.1093/hmg/dds390 |
| [21] | Che W, Dong Y, Quan H B. RANKL inhibits cell proliferation by regulating MALAT1 expression in a human osteoblastic cell line hFOB 1.19[J]. Cell Mol Biol (Noisy-le-grand), 2015, 61(1): 7–14. |
| [22] | Zhang B, Arun G, Mao Y S, et al. The lncRNA Malat1 is dispensable for mouse development but its transcription plays a cis-regulatory role in the adult[J]. Cell Rep, 2012, 2(1): 111–123. DOI:10.1016/j.celrep.2012.06.003 |
| [23] | Chen L, Feng P, Zhu X, et al. Long non-coding RNA Malat1 promotes neurite outgrowth through activation of ERK/MAPK signalling pathway in N2a cells[J]. J Cell Mol Med, 2016, 20(11): 2102–2110. DOI:10.1111/jcmm.12904 |



